斑马鱼fem-1c cDNA克隆与表达分析
2015-02-27侍建涛李志桂建芳周
侍建涛李 志桂建芳周 莉
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京100049)
斑马鱼fem-1c cDNA克隆与表达分析
侍建涛1,2李 志1桂建芳1周 莉1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京100049)
为进一步探究鱼类性别决定的相关机理, 增加对鱼类性控基因表达和功能的认识, 克隆斑马鱼fem-1c基因并对其进行表达分析。研究采用RACE-PCR方法从斑马鱼卵巢组织cDNA中克隆了fem-1c的cDNA全长序列, 其大小为2701 bp, 编码618个氨基酸。生物信息学分析显示, 斑马鱼FEM-1C蛋白包含9个ANK结构域、2个TPR结构域和2个低复杂性区域, 与其他脊椎动物的FEM-1C蛋白序列保守性较高。脊椎动物的fem-1c与tmed7、trim36等邻近的4—5个基因具有保守的同线性关系。半定量RT-PCR实验结果显示斑马鱼fem-1c在受精后17d开始表达, 并特异地表达于成体卵巢组织中。RNA原位杂交结果显示, fem-1c基因mRNA定位于卵巢组织的Ⅰ期和Ⅱ期卵母细胞胞质中。fem-1c的时空表达特征暗示其在斑马鱼卵巢分化中具有重要作用。
fem-1c; 卵巢分化; 原位杂交; 斑马鱼
fem-1(Feminization-1)基因最早发现于秀丽隐杆线虫, 参与线虫性别决定。fem-1基因与 her-1 (hermaphroditization-1)、tra-1 (transformer-1)、tra-2、tra-3、fem-2(feminization-2)和 fem-3等其他基因共同调控线虫性别分化[1—5]。线虫fem-1基因编码一种锚蛋白-重复蛋白(ankyrin-repeats protein), 并与FEM-2、FEM-3及 CUL-2泛素连接酶(Cullin-2 ubiquitin ligase complex)等蛋白组成复合体负调控TRA-1(transformer-1)。TRA-1是一种 DNA-结合锌指蛋白转录因子, 其作用是促进线虫的雌性化发育。有研究显示, 线虫 fem-1的突变导致对 TRA-1蛋白的负调节效应降低或失效, 进而促使线虫向雌性化发育(雄性转变为雌雄同体)[6—8]。
目前, 在人和其他脊椎动物如小鼠、斑胸草雀和斑马鱼中已发现线虫fem-1基因的同源基因家族成员。脊椎动物fem-1基因家族由fem-1a、fem-1b和fem-1c三个成员组成[9]。fem-1基因家族编码蛋白有一个共同特征, 即C端以一个保守的11个氨基酸结构终止: Proline(P)-x-x-Leucine(L)-x-x-Phenylalanine (F)-x-x-x-Histidine(H)(x=可变氨基酸)[10,11]。fem-1a与fem-1c编码蛋白序列相似度较高, 其区别在于fem-1c末尾还有一个精氨酸残基(Arginine residue, R)[9]。
近期的一些研究显示, fem-1基因家族成员在其他动物中的表达, 同样呈现出与性别相关的特征。譬如, 对大马哈鱼虱(Caligus rogercresseyi)雌雄个体的转录组测序筛选到fem-1B , 该基因具有性别表达差异[12]。在斑胸草雀(zebra finch)中, fem-1c有两个拷贝fem1c-Z和fem1c-W, 分别位于Z和W性染色体中。fem1c-Z表达于纤维原细胞的细胞质中; 而fem1c-W 发生了点突变, 导致第一个外显子出现了缺失从而没有功能[13]。在人类中, FEM-1A 或FEM-1B 突变与女性多囊卵巢综合症(Polycystic ovary syndrome, PCOS)的发生相关[14,15]。在斑马鱼中, 对雌雄性腺组织进行转录组分析表明, 卵巢组织中高表达fem-1c[16], 但目前对斑马鱼fem-1c的分子和表达特征并不清楚。
斑马鱼(Danio rerio)作为模式生物, 具有发育周期短、发育速度快、胚胎透明、个体小且易养殖等优点[17], 在发育生物学等研究领域有重要地位。为了进一步研究fem-1c基因在斑马鱼卵巢分化中的作用, 我们首先从斑马鱼中克隆了fem-1c基因的全长 cDNA序列, 采用生物信息学方法分析了脊椎动物fem-1c的结构特征和同线性等特征, 并揭示出斑马鱼fem-1c在受精后17d开始表达, 特异地表达于成体卵巢Ⅰ期和Ⅱ期卵母细胞胞质中。fem-1c的克隆鉴定可为进一步研究 fem-1基因家族成员在脊椎动物性别分化中的作用提供线索和参考。
1 材料与方法
1.1 实验动物
野生型的斑马鱼来自AB型健康成鱼的交配,饲养于中国科学院水生生物研究所。获得的受精卵置于28.5℃培养箱中孵化, 采用14h光照/10h黑暗光周期饲养。胚胎的培育和分期以及后续实验取材均根据Kimmel等[18]进行。
1.2 cDNA模板制备与斑马鱼fem-1c基因cDNA序列获取
取斑马鱼新鲜卵巢组织于1 mL Trizol (Invitrogen)中, 按照说明书提取总 RNA。用购自 Clontech公司的SMART cDNA合成试剂盒合成斑马鱼卵巢cDNA文库, 具体文库构建步骤可详见 SMART cDNA synthesis Kit (Clontech)操作手册。根据Ensembl数据库中得到 fem-1c部分序列, 设计引物5′-RACE-R1、5′-RACE-R2、3′-RACE-F1和3′-RACE-F2 (表1)。按照SMARTTMRACE cDNA Amplification Kit 操作说明书, 进行5′和 3′ RACE从斑马鱼卵巢cDNA文库中扩增 fem-1c的 5′端与 3′端[19], 其中, 5′UPM和 3′UPM(表 1)为试剂盒提供的通用引物。PCR反应条件如下: 94℃预变性5min; 然后94℃变性30s, 66℃复性30s, 72℃延伸2min, 反应进行30个循环, 最后72℃延伸10min。PCR产物经1%琼脂糖凝胶电泳分离检测后, 切胶回收相应的目的片段,并克隆到pMD19-T载体上, 16℃水浴连接4h。连接产物转化DH5α大肠杆菌, 挑单克隆摇菌, PCR筛选阳性克隆进行测序, 测序后进行结果比对拼接, 获得fem-1c的 cDNA全长序列。
1.3 蛋白序列分析及系统发育树构建
根据所获得的斑马鱼fem-1c基因cDNA全长序列, 结合Ensembl数据库信息检索, 我们得到FEM-1C蛋白序列。采用SMART 在线程序(http:// smart.embl-heidelberg.de/)预测斑马鱼fem-1c的蛋白结构[20]。在Ensembl数据库中搜索其他脊椎动物fem-1c基因编码的FEM-1C蛋白序列(表2)。采用ClustalX 1.83对斑马鱼及其他脊椎动物FEM-1C蛋白序列进行比对, 使用MEGA 5.2软件构建FEM-1C基因的系统发育树[21], 方法为邻接法(Neighbor-Joining), 并进行1000 次自展检验(bootstrap)评估进化树分支可信度。
1.4 不同物种 fem-1c基因及其邻近基因同线性分析
根据Ensembl数据库获得斑马鱼及其他不同脊椎动物fem-1c及其上下游基因, 按照相同的比例绘制各物种fem-1c及其周边基因的同线性关系, 部分基因间距较大, 绘图中采用双斜线省略处理。其中银鲫(Carassius auratus gibelio)相关数据来自本实验室BAC测序, BAC文库构建及筛选参照[22]进行。采用Genscan和Fgenesh软件预测基因, 暂命名为BAC L-16。

表1 实验所用引物及用途Tab. 1 The sequences and usage of primers used in this study

表2 斑马鱼FEM-1C与其他脊椎动物同源蛋白序列一致性(Ensembl数据库)Tab. 2 Pairwise identity of zebrafish FEM-1C with other selected homologues (Ensembl database)
1.5 斑马鱼fem-1c在组织中表达分布
分别取雌性成体斑马鱼的心脏、脑、脾脏、肾、肝脏、皮肤、肌肉、卵巢组织以及雄性成体斑马鱼的精巢组织, 液氮速冻, –80℃保存。将各组织置于1 mL Trizol 中, 提取总RNA, 取1 μg总RNA DNaseI (Fermentas)处理后, 采用RevertAid™ First Strandc DNA Synthesis Kit (Fermentas)制备cDNA 模板。以各组织cDNA 为模板, 用fem-1c基因特异引物Fem1c-F1和Fem1c-R1(表1)进行半定量RT-PCR 检测, 以β-actin为内参。反应体系: 1 μL cDNA为模板, 0.6 μL mol/L 引物, 10 μL 2× Taq DNA 聚合酶Mix,补H2O 至总体积20 μL。调整好各模板浓度及PCR循环数后进行反应: 94℃预变性4min, 94℃变性 20s, 58℃复性20s, 72℃延伸 50s, 反应进行24 个循环,最后72℃延伸10min。
1.6 fem-1c在斑马鱼早期性腺发育中表达时序
取斑马鱼受精后发育至8胞期、尾牙期、24h、 48h、72h受精卵各30颗, 5d、10d、15d鱼苗各30尾并去除头部和尾部, 液氮速冻, –80℃保存; 取16d、17d、18d、19d、23d、35d和 45d鱼苗各 30尾, 3月龄雌性斑马鱼 1尾, 取性腺组织, 于 RNA later中–20℃保存。提取上述样品的总 RNA, 并反转录合成 cDNA。以各发育时期的 cDNA 为模板,用跨内含子的 fem-1c特异引物 Fem1c-F2和Fem1c-R2(表1)进行半定量RT-PCR检测, 以β-actin为内参。半定量RT-PCR按如下程序进行扩增: 94℃预变性5min, 然后以94℃变性30s, 54℃复性30s, 72℃延伸50s, 反应进行26个循环, 再以72℃延伸10min。
1.7 卵巢组织原位杂交
根据fem-1c已知的cDNA序列, 设计引物probe-F和probe -R(表1)。在引物的5′端加入T7启动子序列, 经过PCR获得带有T7启动子的DNA片段。体外转录获得带地高辛(Digoxigenin)标记的反义和正义RNA探针(Roche), 1%琼脂糖电泳检测RNA探针的质量。取6月龄斑马鱼卵巢, 于4% PFA中4℃固定16—18h, 再经30%蔗糖4℃渗透过夜, OTC包埋后进行冰冻切片, 切片的厚度为10 μm。之后利用地高辛标记的RNA探针进行切片原位杂交。实验过程主要包括: 切片复水, 蛋白酶消化, PFA固定, 杂交,洗脱, 抗体孵浴, 染色, 显色等步骤, 具体操作步骤参照本实验室方法[23—25]以及斑马鱼整体原位杂交方法[26]。
2 结果
2.1 斑马鱼 fem-1c的基因组结构及其邻近基因保守的共线性关系
通过搜索和分析Ensembl和NCBI数据库并结合RACE-PCR扩增fem-1c全长cDNA序列, 我们获得了斑马鱼 fem-1c基因的结构示意图(图 1)。斑马鱼 fem-1c位于斑马鱼 8号染色体, 基因全长约13.8 kb, 由 5个外显子和 4个内含子组成; 全长cDNA大小为 2701 bp, 其中5′非编码区长279 bp, 3′非编码区长 549 bp, 编码区长度 1857 bp, 编码618个氨基酸。
根据Ensembl 数据库获得的fem-1c相关区域数据, 我们绘制了斑马鱼及其他脊椎动物fem-1c及其上下游基因连锁图(图2), 比较发现fem-1c与其邻近的4—5个基因具有保守的共线性关系。具体表现在: fem-1c上游, 除银鲫(由于 BAC序列接近尾端而缺失相关信息)和原鸡外, 其他物种均存在tmed7基因; fem-1c下游, 所分析物种中均依次出现 trim36、pggt1b、CCDC112等基因或特征序列, 没有基因错位或颠倒现象发生。另外, 随着物种的进化, 总体来讲, 越高等的物种, 上述基因的间距越大, 即彼此邻近的基因在物种的进化历程中呈位置“扩散”趋势。

图2 fem-1c基因与其邻近基因保守的共线性关系(数据来自ensembl数据库)Fig. 2 Schematic diagram for fem-1c gene and context genes of zebrafish and the fem-1c homologs of other species from ensemble database
2.2 斑马鱼fem-1c编码蛋白的分子特征、保守的种间结构及其系统进化关系
用 SMART 在线程序(http://smart.embl-heidelberg.de/)预测了斑马鱼fem-1c的蛋白结构(图3), 斑马鱼FEM-1C包含9个ANK结构域、2个TPR结构域和2个低复杂性区域。其中, 有7个ANK结构域串联排布于蛋白 N端(第 1—200个氨基酸范围内), 另外2个ANK结构域位于第500—550个氨基酸范围内; 2个TPR结构域分别位于第240—270和第320—350个氨基酸范围内; 2个低复杂性区域分别位于第 380—390和第 440—460个氨基酸范围内。
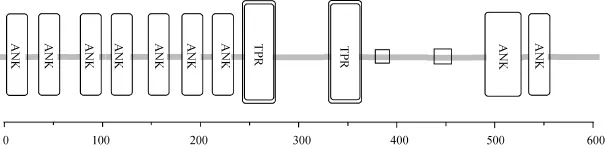
图3 斑马鱼FEM-1C蛋白结构预测Fig. 3 Schematic diagram for structure prediction of zebrafish FEM-1C
不同物种FEM-1C蛋白序列比对结果(表2)显示, FEM-1C蛋白序列在各物种中具有较高的保守性。斑马鱼 FEM-1C蛋白序列与银鲫(Carassius auratus gibelio)FEM-1C蛋白序列的一致性最高, 为87.10%;与原鸡(Gallus gallus)的最低, 为75.93%。与其他鱼类的FEM-1C蛋白序列的一致性在82.07%以上, 而与其他脊椎动物 FEM-1C蛋白序列的一致性在75.93%—79.48%。但斑马鱼FEM-1C与无脊椎动物动物FEM-1蛋白一致性较低。譬如, 与线虫FEM-1蛋白的一致性仅为33.08%。
采用MEGA5.2软件邻接法构建了N-J系统树(图 4)。从图中可以看出, 系统树分为两支: 其中一支, 斑马鱼和银鲫的 FEM-1C聚为一簇, 鳕、阔尾鱼、罗非鱼和青鳉的 FEM-1C聚为一簇, 两簇再聚为一支。在另一支中, 智人、大猩猩和黑猩猩的FEM-1C聚为一簇, 家猫、大熊猫、羊驼的FEM-1C聚为另一簇, 两簇再聚为一个亚支; 蜥蜴、中华软壳龟、斑胸草雀和原鸡的 FEM-1C聚为一个亚支; 非洲爪蟾FEM-1C独立为一个亚支。
2.3 fem-1c特异地表达于斑马鱼卵巢组织并定位于Ⅰ、Ⅱ期卵母细胞胞质
采用半定量RT-PCR 方法分析fem-1c在斑马鱼成体组织、胚胎发育以及个体发育过程中的表达情况, 结果表明, 斑马鱼fem-1c 特异地表达于卵巢组织, 而在心脏、脑、脾脏、肾、肝脏、皮肤、肌肉和精巢组织中没有表达(图5A)。斑马鱼fem-1c在胚胎发育中不表达(结果未显示), 从受精后 17d起鱼苗性腺中可以检测到fem-1c的转录本, 随后表达逐渐增强, 35d后表达达到高峰(图5B)。
利用合成的fem-1c正、反义探针对斑马鱼卵巢组织进行原位杂交, 结果显示, 杂交信号主要出现在Ⅰ期和Ⅱ期卵母细胞细胞质中。伴随卵母细胞发育的不同时期, 信号强度也有变化。其中Ⅰ期卵母细胞(50 μm <φ<150 μm)信号最强, 信号出现在胞质中, 呈明显环状分布, 中间的核区清晰可见。Ⅱ期卵母细胞(140 μm <φ<340 μm)信号强度减弱, 杂交信号均匀分布于除皮质小泡和细胞核以外的胞质中。Ⅲ期(340 μm <φ<700 μm)和Ⅳ期(φ>700 μm)卵母细胞信号消失(图6A)。
3 讨论

图4 NJ法构建的不同物种FEM-1C基因的系统发育树Fig. 4 Phylogenetic tree of FEM-1C in different species based on NJ method

图 5 fem-1c在斑马鱼成体组织(A)和个体发育(B)中的表达分析Fig. 5 Expression pattern of fem-1c in zebrafish adult tissues (A) and larvae at different development stages (B)

图6 斑马鱼fem-1c mRNA在卵巢组织中的细胞定位(φ表示细胞直径)Fig. 6 Cellular distribution of fem-1c mRNA in zebrafish ovarian tissue (φstands for cellular diameter)
斑马鱼fem-1c蛋白主要由ANK结构域和TPR结构域构成。ANK结构域(锚蛋白重复, Ankyrin repeats)是一种广泛存在于各类蛋白的结构域, 一般由30个左右的氨基酸残基构成, 通常以重复结构串联排列在蛋白中, 具体重复数目因蛋白行使功能及物种的不同而不同[27]。具有串联 ANK结构域的蛋白可以行使多种功能, 在蛋白-蛋白相互作用过程中发挥重要作用, 在动物界中广泛存在。例如在周期蛋白激酶抑制因子[Cyclin-dependent kinase (CDK) inhibitors]、转录调控因子(Transcriptional regulators)以及细胞骨架蛋白(Cytoskeletal organizers)中均存在 此类结构[28,29]。TPR结构域(三角形四肽重复, Tetratricopeptide repeats)通常由34个氨基酸残基组成, 以3—16个不等的基序串联排布在蛋白中, 多个TPR可组成支架结构介导蛋白-蛋白相互作用, 或者参与多蛋白复合物的组装[30]。如前所述, 线虫FEM-1蛋白N端存在6个串联ANK重复结构域, 与FEM-2和FEM-3组成蛋白复合体, 作为CUL-2泛素连接酶的酶识别底物, 并共同组成蛋白复合体调控下游TRA-1表达, 最终影响线虫性腺组织发育[6,8,31]。因此, 斑马鱼FEM-1C蛋白这种类似结构的存在暗示了FEM-1C可能也参与蛋白复合体的构成或者相关酶活性位点的识别。
从斑马鱼fem-1c基因与其他物种fem-1c基因蛋白序列比对结果来看, FEM-1C在各物种中具有较高的保守性: 蛋白N端都是由“MDLKTAV” 7个氨基酸残基结构为起始; C端都以R氨基酸结尾; 第80—190个氨基酸(包含第3—6个ANK结构域)和第310—400个氨基酸(包含第2个TPR结构域和第1个低复杂性区域)两区间保守性尤高, 分别仅有15个和9个氨基酸在不同物种中存在差异。此外, 对上述仅有的15个和9个氨基酸差异进行分析, 可以发现这些差异反映出鱼类与其他脊椎动物的不同。譬如, 第145个氨基酸和第355个氨基酸, 所列6种鱼类编码同一种氨基酸, 而其余物种编码另一种相同氨基酸。类似现象在其他位置(第407、431、438、441、479、483、513、550和557个氨基酸)也多次出现。这显示出鱼类在进化关系上有别于与其他陆生高等动物的特点。
在野生型斑马鱼中, 雌雄性腺分化始于受精后15d, 最明显的分化现象集中发生在受精后19—23d,期间未分化性腺经历了两种发育过程: 雄性斑马鱼性腺中, 出现了卵巢细胞凋亡及卵巢腔裂解; 而雌性斑马鱼性腺中, 卵母细胞继续发育直至成熟[32]。根据半定量RT-PCR分析fem-1c基因的时空表达特征, fem-1c基因在斑马鱼中的起始表达时间与斑马鱼性别分化期吻合。根据组织原位杂交结果, fem-1c基因在斑马鱼卵巢发育过程中定位于Ⅰ期、Ⅱ期卵母细胞胞质中。且随着卵母细胞的发育, 信号强度经历了由弱到强, 再减弱直至消失的过程, 显示出斑马鱼fem-1c只在斑马鱼卵母细胞发育的特定时期表达, 在成熟卵细胞中不表达的基本特征。fem-1c的这些表达特征, 暗示着该基因很可能与斑马鱼雌性个体的卵巢分化有关, 但其具体生物学功能有待进一步的研究。
[1] Jonathan H. Switch genes and sex determination in the nematode [J]. Journal of Embryooglogy Experimental Morphology, 1984, 83(suppl): 103—117
[2] Hodgkin J. Primary sex determination in the nematode C. elegans [J]. Development, 1987, 101: 5—16
[3] Manser J, Wood WB, Perry MD. Extragenic suppressors of adominant masculinizing her-1 mutation in C. elegans identify two new genes that affect sex determination in different ways [J]. Genesis, 2002, 34(3): 184—195
[4] Tabitha D, Jonathan H. A sexdetermining gene, fem-1 required for both male and hermaphrodite development in Caenorhabditis elegans [J]. Developmental Biology, 1984, 106(1): 223—235
[5] Simone Zanetti, Alessandro Puoti. Sex Determination in the Caenorhabditis elegans Germline [J]. Advances in Experimental Medicine and Biology, 2013, 757: 41—69
[6] Starostina N G, Lim J M, Schvarzstein M, et al. A CUL-2 ubiquitin ligase containing three FEM proteins degrades TRA-1 to regulate C. elegans sex determination [J]. Developmental Cell, 2007, 13(1): 127—139
[7] Sharon B S, Patricia E K. Proteolysis in Caenorhabditis elegans sex determination: cleavage of TRA-2A by TRA-3 [J]. Genes and Development, 2000, 14: 901—906
[8] Kuwabara P. A complex solution to a sexual dilemma [J]. Developmental Cell, 2007, 13(1): 6—8
[9] Holman V, Lu T, Maher E B, et al. The Fem1c genes: conserved members of the Fem1 gene family in vertebrates [J]. Gene, 2003, 314: 133—139
[10] Tereza V H, Michael F S, Li W H, et al. The murine Fem1 Gene family: homologs of the caenorhabditis elegans sex-determination protein FEM-1 [J]. Genomics, 1998, 54: 221—230
[11] Tereza V H, Joseph F M. Sequence, organization, and expression of the human FEM1B gene [J]. Biochemical and Biophysical Research Communications, 2000, 267(1): 317—320
[12] Rodolfo F, Jose A G, Cristian G E. Discovery of sex-related genes through high-throughput transcriptome sequencing from the salmon louse Caligus rogercresseyi [J]. Mar Genomics, 2014, 15: 85—93
[13] Yuichiro I, Kathy K, Arthur P A. Disruption of FEM1C-W gene in zebra finch evolutionary insights on avian ZW genes [J]. Chromosoma, 2009, 118(3): 323—334
[14] Goodarzi M O, Cui X G, Taylor R A. FEM1A and FEM1B: novel candidate genes for polycystic ovary syndrome [J]. Human Reproduction, 2008, 23(12): 2842—2849
[15] Joseph F M, Randall S H, Walter F, et al. FEM1A is a candidate gene for polycystic ovary syndrome [J]. Gynecological Endocrinology, 2005, 21(6): 330—335
[16] Rajini S, Cai M, Richard B, et al. Transcriptomic analyses reveal novel genes with sexually dimorphic expression in the zebrafish gonad and brain [J]. PLoS One, 2008, 3(3): e1791
[17] Gui J F. Zebrafish, the ideal model for the study of molecular developmental biology [J]. Bioengineering Progress, 1995, 16(3): 30—33 [桂建芳. 分子发育学研究的理想模式-斑马鱼. 生物工程进展, 1995, 16(3): 30—33]
[18] Kimmell C B, Williaml W, Ballard S R, et al. Stages of Embryonic Development of the Zebrafish [J]. Developmental Dynamics, 1995, 203: 253—310
[19] Jia H B, Zhou L, Shi Y H, et al. Molecular cloning and evolutionary implications of growth hormone/ prolactin family gene cDNAs in grouper Epinephelus coioides [J]. Zoological Research, 2004, 25(3): 242—248 [贾海波, 周莉,石耀华, 等. 斜带石斑鱼生长激素/ 催乳素家族基因cDNAs 的分子克隆及其进化意义. 动物学研究, 2004, 25(3): 242—248]
[20] Ivica L, Richard R C, Steffen S, et al. SMART 4.0: towards genomic data integration [J]. Nucleic Acids Research, 2004, 32: 142—144
[21] Koichiro T, Daniel P, Nicholas P, et al. Masatoshi Neiand Sudhir Kumar, MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Molecular Biology and Evolution, 2011, 28(10): 2731—2739
[22] Geng F S, Zhou L, Gui J F. Construction and characterization of a BAC library for Carassius auratus gibelio, a gynogenetic polyploid fish [J]. Animal Genetics, 2005, 36: 535—536
[23] Xia J H, Liu J X, Zhou L, et al. Apo-14 is required fordigestive system organogenesis during fish embryogenesis and larval development [J]. International Journal of Developmental Biology, 2008, 52(8): 1089—1098
[24] Yin J, Xia J H, Du X Z, et al. Developmental expression of Cag Mdkb during gibel carp embryogenesis [J]. International Journal of Developmental Biology, 2007, 51(8): 761—769
[25] Peng J X, Xie J L, Zhou L, et al. Evolutionary conservation of Dazl genomic organization and its continuous and dynamic distribution throughout germline development in gynogenetic gibel carp [J]. Journal of Experimental Zoology, 2009, 312: 855—871
[26] Thisse C, Thisse B. High-resolution in situ hybridization to whole-mount zebrafish embryos [J]. Nature Protocols, 2008, 3(1): 59—69
[27] Sedgwick S G, Stephen J. The ankyrin repeat: a diversity of interactions on a common structural framework [J]. Trends in Biochemical Sciences, 1999, 24(8): 311—316
[28] Bork P. Hundreds of ankyrin-like repeats in functionally diverse proteins: Mobile modules that cross phyla horizontally [J]? Proteins, 1993, 17: 363—374
[29] Peter M, Vann B. The ANK repeat: A ubiquitous motif involved in macromolecular recognition [J]. Trends in Cell Biology, 1992, 2(5): 127—129
[30] Amit K D, Patrical W C, David B. The structure of the tetratricopeptide repeats [J]. The European Molecular Biology Organization Journal, 1998, 17(5): 1192—1199
[31] Spence A M, Coulson A, Hodgkin J. The product of fem-1, a nematode sex-determining gene, contains a motif found in cell cycle control proteins and receptors for cell-cell interactions [J]. Cell, 1990, 60(6): 981—990
[32] Daisuke U, Michiaki Y, Takeshi K, et al. Oocyte apoptosis during the transition from ovary-like tissue to testes during sex differentiation of juvenile zebrafish [J]. The Journal of Experimental Biology, 2002, 205: 711—718
THE CLONING AND EXPRESSION ANALYSIS OF ZEBRAFISH FEM-1C, A MEMBER OF FEM-1 FAMILY
SHI Jian-Tao1,2, LI Zhi1, GUI Jian-Fang1and ZHOU Li1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Feminization-1 (fem-1) gene was first discovered in Caenorhabditis elegans, and it plays an important role in nematode sex determination. The mutation in fem-1c could feminize the nematode sex differentiation. There are three conservative members of fem-1 family in vertebrate, namely fem-1a, fem-1b and fem-1c. We cloned the entire cDNA sequence of fem-1c from zebrafish ovary cDNA library using RACE-PCR. The full length of zebrafish fem-1c cDNA was 2701 bp, encoding a 618-amino acid protein. We used online bioinformatic software and predicted that the FEM-1C protein contained 9 ANK domains, 2 TPR domains and 2 low complexity regions. Zebrafish FEM-1C shared a highly conservative protein sequence with its homologues in other vertebrates. The sequence analysis also revealed that in vertebrates there was a conservative synteny between fem-1c and its neighborhood genes, especially the nearest 4—5 genes such as tmed7 and trim36. We conducted the expression analysis in different tissues of adult zebrafish using RT-PCR and found that fem-1c was exclusively expressed in the ovary. The expression analysis in the gonad of larvae at different development stages showed that the expression of fem-1c began on the 17th day post-fertilization. The in situ hybridization results showed that fem-1c was expressed in cytoplasm at stage I and Ⅱ of oocyte. This specific expression pattern suggested that fem-1c might play a role in zebrafish ovary development.
fem-1c; Ovary differentiation; In situ hybridization; Zebrafish
Q344+.1
A
1000-3207(2015)03-0459-09
10.7541/2015.61
2014-05-04;
2014-08-11
国家973计划(2010CB126301); 现代农业产业技术体系建设专项资金(NYCYTX-49)资助
侍建涛(1987—), 男, 内蒙古阿拉善盟人; 硕士研究生; 主要从事发育遗传学研究。E-mail: sjt0408@163.com
周莉, E-mail: zhouli@ihb.ac.cn
