无机氮供应对甘蓝型油菜组培苗盐耐受能力的影响
2022-04-08张开艳吴沿友李海涛杭红涛
张开艳 吴沿友 李海涛 杭红涛
摘 要:该研究以甘蓝型油菜组培苗为材料,使用硝酸钠来提供唯一氮源和盐胁迫条件,测定甘蓝型油菜组培苗的生物量、叶绿素含量和叶片稳定碳同位素值,通过稳定碳同位素值评估甘蓝型油菜组培苗的自养能力,并基于自养能力研究甘蓝型油菜组培苗的无机氮供应与盐耐受能力的关系。结果表明:(1)供应40 mmol·L-1硝态氮能消除轻度盐胁迫的不利影响,供应80 mmol·L-1硝态氮能有效缓减中度盐胁迫的不利影响,但在重度盐胁迫条件下,即使供应过量的无机氮,甘蓝型油菜组培苗的生长仍然受到显著的抑制。(2)甘藍型油菜组培苗的叶绿素含量随盐胁迫程度的增加而逐渐降低。(3)甘蓝型油菜组培苗的自养能力在轻度盐胁迫时达到最大, 但盐胁迫程度的加剧会显著降低甘蓝型油菜组培苗的自养能力。由此可知,当植物的无机氮需求得到满足后,自养能力的强弱将决定植物的盐耐受能力,而过量的无机氮供应不能提高重度盐胁迫条件下植物的自养能力。
关键词: 甘蓝型油菜组培苗,硝酸钠,盐胁迫,稳定碳同位素,自养能力
中图分类号:Q945.78
文献标识码:A
文章编号:1000-3142(2022)03-0422-07
Effect of inorganic nitrogen supply on the salt-tolerance
of Brassica napus plantlets in vitro
ZHANG Kaiyan1, 2, WU Yanyou2*, LI Haitao3, HANG Hongtao1, 2
( 1. School of Karst Science, Guizhou Normal University, Guiyang 550001, China; 2. State Key Laboratory of Environmental
Geochemistry, Institute of Geochemistry, Chinese Academy of Sciences, Guiyang 550081, China; 3. Guizhou
Vocational College of Agriculture, Guiyang 551400, China )
Abstract:The Brassica napus (Bn) plantlets in vitro were used as the experimental materials in this study. The sodium nitrate was employed to provide the sole nitrogen source and salt stress. The growth parameters, chlorophyll contents and foliar δ13C of B. napus plantlets were measured in this study. The photosynthetic capacity of B. napus plantlets was estimated by the stable carbon isotope value. The relationship between inorganic nitrogen supply and salt-tolerance of the B. napus plantlets was studied based on the photosynthetic capacity. The results were as follows: (1)The deleterious effect of slight salt stress could be counteracted by 40 mmol·L-1 sodium nitrate, while the deleterious effect of moderate salt stress could be effectively relieved by 80 mmol·L-1 sodium nitrate. However, even if the inorganic nitrogen supply was excessive, the growth of B. napus plantlets was heavily inhibited by the severe salt stress. (2)The chlorophyll contents of B. napus plantlets decreased gradually with increasing salt stress. (3)The photosynthetic capacity of B. napus plantlets reached the maximum under slight salt stress condition. However, the photosynthetic capacity of B. napus plantlets decreased obviously with increasing salt stress. Hence, when the inorganic nitrogen demand is met for plants, the salt-tolerance of plants will depend on the photosynthetic capacity. Excessive inorganic nitrogen supply can not improve the photosynthetic capacity of plants suffered from the severe salt stress.
Key words: Brassica napus plantlets, sodium nitrate, salt stress, stable carbon isotope, photosynthetic capacity
盐胁迫是影响农作物产量的主要环境因子之一。当前,世界范围内有将近20%的耕地存在不同程度的盐渍化(Munns & Tester,2008;Zhao et al.,2015 ),而中国的盐渍化土地面积约为3 460万hm2(Zhou et al.,2018)。飽和土壤提取液的电导率大于4 dS·m-1 (粗略对应40 mmol·L-1钠)的土壤就被认为是盐渍土(Munns & Tester,2008)。在盐渍化土壤中,钠盐的含量占主导地位(Tavakkoli et al.,2010)。钠盐通常不是植物生长所必需的,土壤中高浓度的钠盐将对植物产生渗透胁迫和离子毒害效应(Munns & James,2006;Munns & Tester,2008)。根据植物对盐胁迫的忍受程度,植物通常被分为盐生植物和非盐生植物。然而,目前大多数农作物均属于非盐生植物(Wu,2018)。非盐生植物对盐浓度很敏感,25~50 mmol·L-1的钠离子浓度就会抑制其生长(Haro et al.,1993)。
植物在遭受盐胁迫时通常会合成大量的渗透调节物质来缓解盐胁迫带来的不利影响,合成的渗透调节物质一般是脯氨酸、甜菜碱和胺类物质等含氮物质(Siddiqui et al., 2010;Muchate et al.,2016;Negro et al.,2017)。然而,盐胁迫环境中又普遍存在无机氮供应不足的情况(Amonkar & Karmarkar,1995)。因此,为了避免农作物遭受盐胁迫的不利影响,普遍措施是增施氮肥来提高农作物对盐胁迫的耐受程度(Hessini et al.,2019),同时增加无机氮的供应还能显著促进植物的光合能力(Liu et al.,2013),为植物生长提供更多的能量。
虽然无机氮的供应为含氮物质的合成提供了氮源,但处于盐胁迫条件下的植物还会遭受钠离子的毒害,而植物将钠离子排除体外的过程需要消耗能量(Apse & Blumwald,2007)。由于植物所需的能量来自光合作用,因此在盐胁迫条件下,光合能力强的植物将有较大的盐耐受能力,反之则植物的盐耐受能力较弱。
植物光合能力的强弱通常是利用便携式光合仪来测定,但光合仪仅能给出植物瞬时的光合能力,若要获取植物在整个盐胁迫期间的光合能力则需要每天进行测定。然而,在植物组织培养条件下,可以通过测定组培苗的叶片稳定碳同位素值来确定组培苗在整个生长周期内的自养能力(光合能力)(Serret et al., 1997)。因此,本研究采用植物组织培养来研究盐胁迫条件下植物的光合能力。
通常,植物吸收利用的无机氮主要是硝态氮和铵态氮。虽然植物直接吸收利用铵态氮能省掉硝态氮的还原过程,消耗的能量较小,但是大多数植物吸收利用的无机氮主要是硝态氮。此外,植物在遭受高浓度的硝态氮供应时几乎不会发生硝酸盐毒害现象(Cruz et al.,2006;Hessini et al.,2009)。鉴于此,本研究使用硝酸钠来提供唯一氮源和盐胁迫条件。由于甘蓝型油菜在生长过程中的氮需求量大,且是广泛种植的油料作物,因此本研究选择无根甘蓝型油菜组培苗作为实验材料,测定处于增殖阶段的甘蓝型油菜组培苗在不同硝酸钠浓度下的生长情况、叶绿素含量和叶片稳定碳同位素值,旨在研究盐胁迫条件下甘蓝型油菜组培苗的自养能力与无机氮供应的关系,为通过无机氮管理来提高甘蓝型油菜的盐耐受能力提供理论依据。
1 材料与方法
1.1 材料
实验材料为继代培养4代后的无根甘蓝型油菜组培苗(单芽),带有4个未展开的叶片,单芽均重为0.08 g。
1.2 方法
1.2.1 实验设计 将甘蓝型油菜组培苗接种于增殖培养基中,培养基的类型为MS培养基,硝态氮是MS培养基中的唯一氮源,使用硝酸钠来提供硝态氮。设置5个硝酸钠浓度,分别是10、20、40、80和120 mmol·L-1。10、20 mmol·L-1硝酸钠浓度下的盐胁迫程度视为无,40 mmol·L-1硝酸钠浓度对应轻度盐胁迫,80 mmol·L-1硝酸钠浓度对应中度盐胁迫,120 mmol·L-1硝酸钠浓度对应重度盐胁迫。培养基中细胞分裂素6-BA 的浓度为2.0 mg·L-1,生长素NAA 的浓度为0.2 mg·L-1。在此细胞分裂素和生长素浓度比例下,甘蓝型油菜组培苗在整个增殖阶段没有根的生成。培养基蔗糖含量为30 g·L-1,琼脂粉含量为7.5 g·L-1。首先调节培养基pH值到5.8,每个三角瓶分装50 mL培养基,用封口膜密封;然后将培养基放置于高压灭菌锅中,在121 ℃下灭菌20 min。组培室的光周期为12 h,光照强度为50 μmol·m-2·s-1 PPFD,培养室温度为(25 ± 2)℃。
1.2.2 组培苗生长参数测定 组培苗的初始鲜重通过称重的方式测定。先称量未转接组培苗的培养基重量,再称量转接组培苗后的培养基重量,2次称量的差值即为接种组培苗的初始鲜重。
经过5周培养后,从三角瓶中取出组培苗,测定组培苗的鲜重,组培苗的鲜重减去初始鲜重即为甘蓝型油菜组培苗的增重。将组培苗的叶片剪下并于108 ℃杀青半小时,接着在60 ℃恒温下烘干,随后将烘干后叶片捣碎为粉末。
1.2.3 组培苗叶绿素含量测定 首先,将0.1 g组培苗叶片放入研钵中,倒入一定量的液氮,充分研磨后在研钵中加入5 mL 95%分析纯乙醇,将叶绿素提取液转入15 mL离心管中;然后,用5 mL 95%分析纯乙醇涮洗研钵,将涮洗研钵后的95%分析纯乙醇转入15 mL离心管中。将装有叶绿素提取液的离心管于4 ℃冰箱中静置24 h以上,待叶片组织变为白色后,先在离心机中进行离心,再进行叶绿素含量的测定。用分光光度计在665 nm和649 nm处测定叶绿素的吸光度,根据Alsaadawi 等(1986)的公式计算叶绿素的含量。
1.2.4 组培苗叶片稳定碳同位素测定 组培苗叶片稳定碳同位素比值(δ13C)通过气体同位素质谱仪(MAT253,Germany)进行测定,采用连续流模式。将20 μg叶片碳和相对应的碳标准物质分别包入锡杯中。首先,将包好的样品放入自动进样器中进行测定;然后,测定稳定碳同位素值。稳定碳同位素值用δ表示,计算公式如下:
δ13C (‰)=(Rsample/Rstandard-1)×1 000 (1)
式中: Rsample 为甘蓝型油菜组培苗叶片的同位素比值(13C/12C);Rstandard为标准物质的同位素比值。测定稳定碳同位素时用IAEA-CH-3 和IAEA-CH-6 进行校正(Yousfi et al.,2013)。MAT253测定稳定碳同位素值的精度为0.2‰。
1.2.5 数据统计与分析 所有测量的数据均用平均值 ± 标准差表示,对各处理间数据进行单因子显著性差异分析(P<0.05)。文中的图用Origin 软件(9.0 版本)绘制。
2 结果与分析
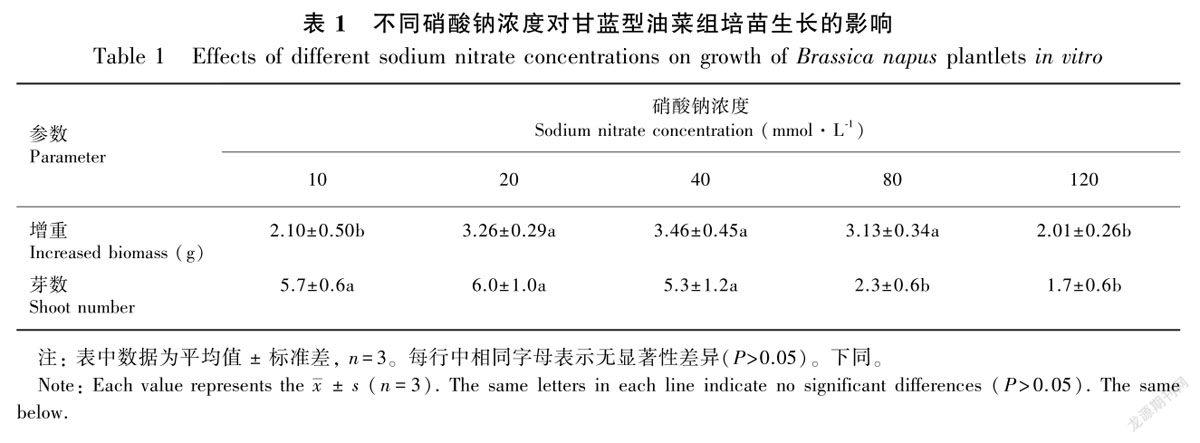
2.1 不同硝酸钠浓度对甘蓝型油菜组培苗生长的影响
甘蓝型油菜组培苗培养5周后的生长情况见表1。由表1可知,硝酸钠浓度对甘蓝型油菜组培苗的生长具有显著的影响;随着硝酸钠浓度的增加,甘蓝型油菜组培苗的增重呈现先增加后减少的趋势;甘蓝型油菜组培苗遭受轻度盐胁迫时,供应40 mmol·L-1硝态氮能消除轻度盐胁迫的不利影响;供应80 mmol·L-1的硝态氮能够有效缓减中度盐胁迫的不利影响。但是,当盐胁迫的程度达到最大时,过量的硝态氮供应也不能明显改善重度盐胁迫对甘蓝型油菜组培苗生长的抑制。
此外,盐胁迫的程度还会影响甘蓝型油菜组培苗芽的增殖效果,在中度和重度盐胁迫条件下,甘蓝型油菜组培苗的增殖效果最差,而轻度盐胁迫则对甘蓝型油菜组培苗的增殖不产生显著影响。
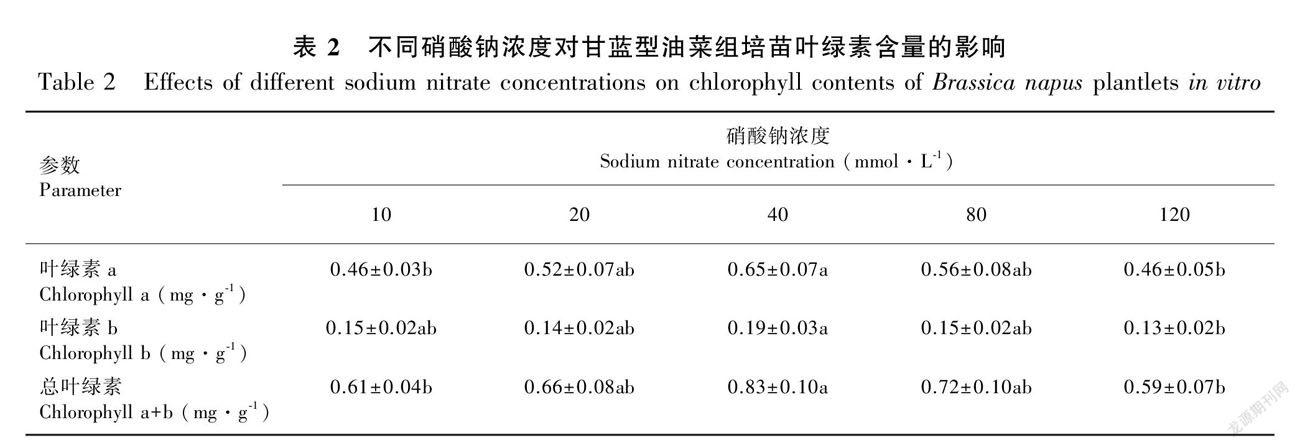
2.2 不同硝酸钠浓度对甘蓝型油菜组培苗叶绿素含量的影响
甘蓝型油菜组培苗叶片的叶绿素含量受到硝态氮供应量和盐胁迫程度的共同影响。从表2可以看出,随着硝酸钠浓度的增加,总叶绿素含量呈现先增加后减少的趋势。在10~40 mmol·L-1硝酸钠浓度范围内,继续增加无机氮的供应能明显提高叶片总叶绿素的含量。然而,随着盐胁迫程度的加强(轻度至重度盐胁迫),继续增加无机氮的供应对提高叶片总叶绿素含量无效, 且重度盐胁迫对甘蓝型油菜组培苗叶绿素合成的抑制作用最明显。
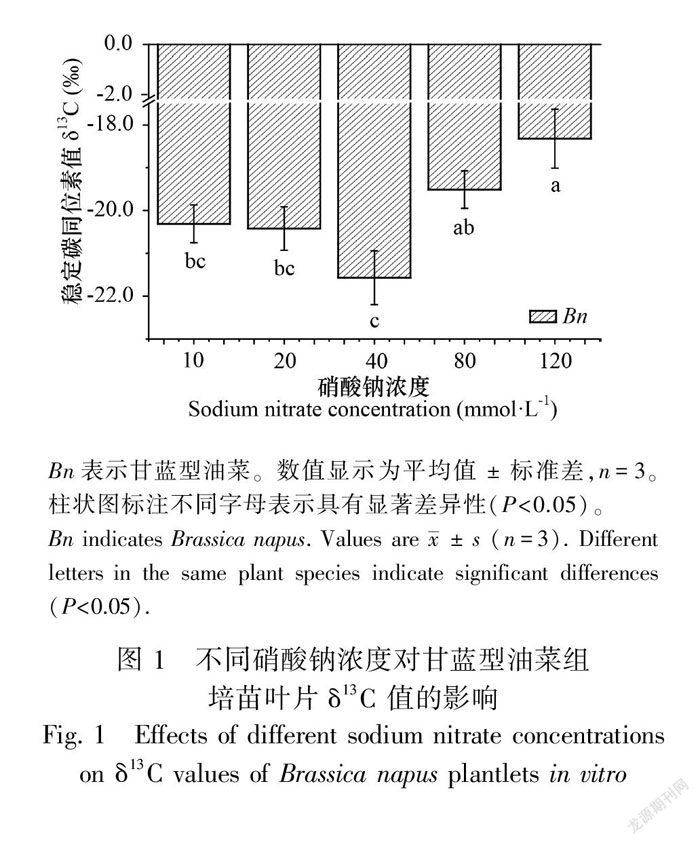
2.3 不同硝酸钠浓度对甘蓝型油菜组培苗叶片稳定碳同位素值的影响
硝酸钠的供应量对甘蓝型油菜组培苗的叶片稳定碳同位素值有显著的影响。如图1所示,随着硝酸钠浓度的增加,甘蓝型油菜组培苗的叶片稳定碳同位素值呈现先缓慢变小后急剧增大的趋势,在40 mmol·L-1硝酸钠浓度时的叶片稳定碳同位素值达到最小,而在最高硝酸钠浓度供应下获得最大的叶片稳定碳同位素值。甘蓝型油菜组培苗的叶片稳定碳同位素值随着盐胁迫程度的加强而显著增大。
3 讨论与结论
由于盐胁迫是限制农作物生长和产量的主要环境因子,因此在盐渍土上种植的农作物将因为盐胁迫的存在而导致其生长受到抑制,从而影响农作物的产量(Liang et al.,2019)。通常,遭受钠盐胁迫的植物除了受到渗透胁迫的逆境外,钠离子的毒害作用也是抑制植物生长的主要因素(Parida & Das,2005)。本研究结果表明,重度盐胁迫显著抑制了甘蓝型油菜组培苗的生长,而甘蓝型油菜组培苗在轻度和中度盐胁迫条件下生长的改善可能归功于硝态氮供应量的增加。虽然盐胁迫的加剧会导致硝酸还原酶活力的下降(Kaiser & Huber,2001),但在本研究中,随着盐胁迫程度的加剧,硝态氮的供应量也随之增加。硝态氮供应量的增加能提高硝酸還原酶的活力(Kaiser & Huber,2001;Black et al.,2002)。Zhang & Wu(2017)的研究也表明随着硝酸钠浓度的增加,甘蓝型油菜组培苗的叶片氮含量显著增加。因此,硝态氮供应量的增加能提高叶片的氮含量。在盐胁迫条件下,当植物的无机氮供应量大于植物正常生长所需量后,植物体内一般会合成大量的渗透调节物质来应对盐胁迫的不利影响(Carillo et al., 2005)。重度盐胁迫条件下甘蓝型油菜组培苗生长的抑制可能还与钠离子的毒害作用相关联。
在盐胁迫条件下,植物为了减轻钠离子的毒害效应,会尽可能将过多的钠离子排除体外,但这是一个消耗能量的过程(Apse & Blumwald,2007)。此外,盐胁迫还会抑制叶绿素的合成(Parida & Das,2005),并导致植物的光合速率降低(Yousfi et al., 2009)。在本研究中,硝态氮供应量随着盐胁迫程度的加剧而相应增加,而增加无机氮的供应又能促进叶绿素含量的增加(Guidi et al.,1997)。因此,甘蓝型油菜组培苗在遭受轻度和中度盐胁迫时仍然能保持较高的叶绿素含量,而在120 mmol·L-1硝酸钠浓度处理下获得的最小叶绿素浓度可能是加剧的盐胁迫增强了叶绿素降解酶的活力所致(Rao GG & Rao GR,1981)。
叶绿素含量通常能间接指示植物的光合能力,低浓度的叶绿素含量会直接限制植物的光合能力,从而导致初级生产力的降低(Filella et al.,1995)。然而,限制光合能力的因素除了叶绿素含量外,还有叶片气孔导度、二氧化碳浓度和光照强度等因素。在本研究中,不同硝酸钠浓度处理下的甘蓝型油菜组培苗生长条件一致,甘蓝型油菜组培苗同时进行自养生长和异养生长,甘蓝型油菜组培苗有两个明显的碳源,一个是以蔗糖为碳源的有机碳源,另一个是以空气二氧化碳为碳源的无机碳源。空气中的二氧化碳经植物光合作用后将产生20‰的分馏(O′Leary,1981),本研究测定组培室空气二氧化碳的稳定碳同位素值为-10.55‰。因此,组培苗利用空气二氧化碳后,这部分被利用的二氧化碳在植物叶片内的光合产物将有很偏负的稳定碳同位素值。培养基中蔗糖的稳定碳同位素值为-12.65‰,而本研究测定的甘蓝型油菜组培苗利用蔗糖发生的稳定碳同位素分馏值仅为2.54‰。因此,甘蓝型油菜组培苗同时利用蔗糖和空气二氧化碳得到的叶片稳定碳同位素值将是两个明显不同的稳定碳同位素值混合的结果。甘蓝型油菜组培苗利用空气二氧化碳的量越多,则叶片稳定碳同位素值就会越偏负,而叶片稳定碳同位素值越偏负,则表明甘蓝型油菜组培苗的自养能力越强,反之则越弱。甘蓝型油菜组培苗在40 mmol·L-1硝酸钠浓度处理下的叶片稳定碳同位素值最偏负意味着甘蓝型油菜组培苗虽遭受轻度盐胁迫,但仍然能获得最大的自养能力,这可能归功于相应增加的无机氮供应促进了叶片叶绿素含量的增加,从而增大了二氧化碳的同化量。然而,甘蓝型油菜组培苗在80 mmol·L-1硝酸钠浓度处理下的叶绿素含量明显高于20 mmol·L-1硝酸钠浓度处理下的叶绿素含量,但此时的叶片稳定碳同位素值却稍微大于20 mmol·L-1硝酸钠浓度处理下的叶片稳定碳同位素值;此外,甘蓝型油菜组培苗在120 mmol·L-1硝酸钠浓度处理下的叶绿素含量接近10 mmol·L-1硝酸钠浓度处理下的叶绿素含量,但120 mmol·L-1硝酸钠浓度处理下的叶片稳定碳同位素值却显著大于10 mmol·L-1硝酸钠浓度处理下的叶片稳定碳同位素值。因此,在本研究中,随着盐胁迫程度的加剧,甘蓝型油菜组培苗的叶片稳定碳同位素值逐渐增大是盐胁迫程度加强导致气孔关闭所致。盐胁迫程度的加强会导致叶片气孔关闭,从而导致叶片同化二氧化碳的量降低(Meloni et al.,2003),与对照相比,盐胁迫下植物通常有较正的δ13C 值(Amor & Cuadra-Crespo,2011),在最高硝酸钠浓度处理下的甘蓝型油菜组培苗遭受最强的盐胁迫,此时甘蓝型油菜组培苗自养能力最小应归功于气孔导度的限制。因此,随着盐胁迫程度的加剧,甘蓝型油菜组培苗同化二氧化碳的量是在逐渐降低。Zhang & Wu(2017)的研究表明,在40 mmol·L-1至120 mmol·L-1硝酸钠浓度范围内,随着硝酸钠浓度的增加,甘蓝型油菜组培苗的叶片碳含量显著下降,而叶片碳含量低意味有机碳的积累量少。因此,甘蓝型油菜组培苗在重度盐胁迫条件下利用蔗糖的量也少。相应地,甘蓝型油菜组培苗在重度盐胁迫条件下获得的能量最小。
隨着盐胁迫程度的加剧,甘蓝型油菜组培苗的自养能力逐渐减弱,而遭受的钠离子毒害效应则逐渐增强。此外,Zhang & Wu(2017)的研究发现,甘蓝型油菜组培苗的叶片氮含量在120 mmol·L-1硝酸钠浓度处理下达到最大,是无盐胁迫条件下叶片氮含量的2倍以上,而叶片最大氮含量则意味着同化无机氮所需能量也最大。然而,甘蓝型油菜组培苗在120 mmol·L-1硝酸钠浓度处理下的自养能力显著低于无盐胁迫时的自养能力,自养能力弱意味着为植物提供的能量少,而盐胁迫加强又会加剧能量的消耗,这就导致了重度盐胁迫条件下甘蓝型油菜组培苗的生长受到了显著的抑制。
综上所述,植物的生长情况与遭受的盐胁迫程度相关联。在甘蓝型油菜组培苗遭受盐胁迫时,40 mmol·L-1的硝态氮供应能消除轻度盐胁迫的不利影响,80 mmol·L-1的硝态氮供应能有效缓减中度盐胁迫的不利影响,但在重度盐胁迫条件下,即使供应过量的无机氮,甘蓝型油菜组培苗的生长也还是受到显著抑制。因此,在植物遭受轻度或中度盐胁迫时,增加无机氮的供应量能提高植物对盐胁迫的耐受能力,从而显著降低盐胁迫的不利影响。然而,之所以在重度盐胁迫条件下,即使供应过量的无机氮也不能降低重度盐胁迫对植物生长的抑制,是因为过量的无机氮供应并不能为遭受重度盐胁迫的植物提供充足的能量,相反,大量的氮同化还会加剧植物的能量消耗。
参考文献:
ALSAADAWI IS, AL-HADITHY SM, ARIF MB, 1986. Effects of three phenolic acids on chlorophyll content and ions uptake in cowpea seedlings [J]. J Chem Ecol, 12(1): 221-227.
AMONKAR DV, KARMARKAR SM, 1995. Nitrogen uptake and assimilation in halophytes[M]//SRIVASTAVA HS, SINGH
RP. Nitrogen nutrition in higher plants. New Delhi: Associated Publ Co: 431-445.
AMOR FM, CUADRA-CRESPO P, 2011. Alleviation of salinity stress in broccoli using foliar urea or methyl-jasmonate: analysis of growth, gas exchange, and isotope composition [J]. Plant Growth Regul, 63(1): 55-62.
APSE MP, BLUMWALD E, 2007. Na+ transport in plants[J]. Febs Lett, 581(12): 2247-2254.
BLACK BL, FUCHIGAMI LH, COLEMAN GD,2002. Partitioning of nitrate assimilation among leaves, stems and roots of poplar [J]. Tree Physiol, 22(10): 717-724.
CARILLOA P, MASTROLONARDOA G, NACCAA F,et al., 2005. Nitrate reductase in durum wheat seedlings as affected by nitrate nutrition and salinity[J]. Funct Plant Biol, 32(3): 209-219.
CRUZ C, BIO AFM, DOMGUEZ-VALDIVIA MD, et al., 2006. How does glutamine synthetase activity determine plant tolerance to ammonium?[J]. Planta, 223: 1068-1080.
FILELLA I, SERRANO L, SERRA J, et al., 1995. Evaluating wheat nitrogen status with canopy reflectance indices and discriminant analysis [J]. Crop Sci, 35(5): 1400-1405.
GUIDI L, LOREFICE G, PARDOSSI A, et al., 1997. Growth and photosynthesis of Lycopersicon esculentum (L.) plants as affected by nitrogen deficiency [J]. Biol Plantarum, 40(2): 235-244.
HARO R, BAUELOS MA, QUINTERO FJ, et al., 1993. Genetic basis of sodium exclusion and sodium tolerance in yeast. A model for plants [J]. Physiol Plant, 89: 868-874.
HESSINI K, ISSAOUI K, FERCHICHI S, et al., 2019. Interactive effects of salinity and nitrogen forms on plant growth, photosynthesis and osmotic adjustment in maize [J]. Plant Physiol Bioch, 139: 171-178.
HESSINI K, LACHAAL M, CRUZ C, et al., 2009. Role of ammonium to limit nitrate accumulation and to increase water economy in Wild Swiss chard [J]. J Plant Nutr,32: 821-836.
KAISER WM, HUBER SC, 2001. Post-translational regulation of nitrate reductase: mechanism, physiological relevance and environmental triggers [J]. J Exp Bot, 52(363): 1981-1989.
LIANG WJ, MA XL, WAN P, et al., 2018. Plant salt-tolerance mechanism: A review [J]. Biochem Biophy Res Comm, 495(1): 286-291.
LIU XP, FAN YY, LONG JX, et al., 2013. Effects of soil water and nitrogen availability on photosynthesis and water use efficiency of Robinia pseudoacacia seedlings [J]. J Environ Sci-Chin, 25(3): 585-595.
MELONI DA, OLIVA MA, MARTINEZ CA, et al., 2003. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress [J]. Environ Exp Bot, 49(1): 69-76.
MUCHATE NS, NIKALJE GC, RAJURKAR NS, et al., 2016. Plant salt stress: adaptive responses, tolerance mechanism and bioengineering for salt tolerance [J]. Bot Rev, 82(4): 371-406.
MUNNS R, JAMES RA, LUCHLI A, 2006. Approaches to increasing the salt tolerance of wheat and other cereals [J], J Exp Bot, 57: 1025-1043.
MUNNS R, TESTER M, 2008. Mechanisms of salinity tolerance [J]. Ann Rev Plant Biol, 59: 651-681.
NEGRO S, SCHMCKEL SM, TESTER M, 2017. Evaluating physiological responses of plants to salinity stress [J]. Ann Bot, 119(1):1-11.
O′LEARY MH, 1981. Carbon isotope fractionation in plants [J]. Phytochemistry, 20(4): 553-567.
PARIDA AK, DAS AB, 2005. Salt tolerance and salinity effects on plants: a review [J]. Ecotoxicol Environ Saf, 60: 324-349.
RAO GG, RAO GR, 1981. Pigment composition chlorophyllase activity in pigeon pea (Cajanus indicus Spreng) and Gingelley (Sesamum indicum L.) under NaCl salinity [J]. Indian J Exp Biol, 19: 768-770.
SCHJOERRING J K, HUSTED S, MCK G, et al., 2002. The regulation of ammonium translocation in plants [J]. J Exp Bot, 53: 883-890.
SERRET MD, TRILLAS MI, MATAS J, et al., 1997. The effect of different closure types, light, and sucrose concentrations on carbon isotope composition and growth of Gardenia jasminoides plantlets during micropropagation and subsequent acclimation ex vitro[J]. Plant Cell Tiss Org, 47(3): 217-230.
SIDDIQUI MH, MOHAMMAD F, KHAN MN, et al., 2010. Nitrogen in relation to photosynthetic capacity and accumulation of osmoprotectant and nutrients in Brassica genotypes grown under salt stress[J]. Agric Sci Chin, 9(5): 671-680.
TAVAKKOLI E, RENGASAMY P, MCDONALD GK, 2010. High concentrations of Na+ and Cl– ions in soil solution have simultaneous detrimental effects on growth of faba bean under salinity stress [J], J Exp Bot, 61: 4449-4459.
WANG YY, HSU PK, TSAY YF, 2012. Uptake, allocation and signaling of nitrate [J]. Trends Plant Sci, 17: 458-467.
WU HH, 2018. Plant salt tolerance and Na+ sensing and transport [J]. The Crop J, 6(3): 215-225.
YOUSFI S, SERRET MD, ARAUS JL, 2013. Comparative response of δ13C, δ18O and δ15N in durum wheat exposed to salinity at the vegetative and reproductive stages [J]. Plant Cell Environ, 36(6): 1214-1227.
YOUSFI S, SERRET MD, ARAUS JL, 2009. Shoot δ15N gives a better indication than ion concentration or Δ13C of genotypic differences in the response of durum wheat to salinity[J]. Funct Plant Biol, 36(2): 144-155.
ZHANG KY, WU YY, 2017. The δ15N response and nitrate assimilation of Orychophragmus violaceus and Brassica napus plantlets in vitro during the multiplication stage cultured under different nitrate concentrations [J]. Acta Geochim, 36(2): 190-197.
ZHAO GM, HAN Y, SUN X, et al., 2015. Salinity stress increases secondary metabolites and enzyme activity in safflower [J]. Ind Crop Prod, 64: 175-181.
ZHOU Y, TANG NY, HUANG LJ, et al., 2018. Effects of salt stress on plant growth, antioxidant capacity, glandular trichome density, and volatile exudates of Schizonepeta tenuifolia Briq. [J]. Int J Mol Sci, 19: 252.
(責任编辑 蒋巧媛)
收稿日期:2020-12-15
基金项目:国家“十三五”重点研发计划课题(2016YFC0502607);贵州省科学技术基金(黔科合基础[2020]1Y172);国家自然科学基金重点项目(U1612441-2);贵州师范大学2018年博士科研启动项目(GZNUD[2018]30号)[Supported by National Key Research and Development Program of China in the 13th Five-Year Plan(2016YFC0502607); Guizhou Provincial Science and Technology Foundation ([2020]1Y172); National Natural Science Foundation of China (U1612441-2); Doctor Foundation Program of Guizhou Normal University in 2018(GZNUD[2018]30)]。
第一作者: 张开艳(1989-),博士,讲师,主要从事植物的无机氮利用机制研究,(E-mail)kaiyanzhang@126.com。
通信作者:吴沿友,博士,研究员,博士研究生导师,主要从事生态环境和环境地球化学研究,(E-mail)wuyanyou@mail.gyig.ac.cn。
