红球菌来源QsdA型N-酰基高丝氨酸内酯酶水产养殖饲用潜力分析
2015-02-27张美超杨雅麟宋水山徐俐姚斌周志刚
张美超杨雅麟宋水山徐 俐姚 斌周志刚
(1. 中国农业科学院饲料研究所, 农业部饲料生物技术重点试验室, 北京 100081; 2. 河北省科学院生物研究所,石家庄 050081)
红球菌来源QsdA型N-酰基高丝氨酸内酯酶水产养殖饲用潜力分析
张美超1杨雅麟1宋水山2徐 俐1姚 斌1周志刚1
(1. 中国农业科学院饲料研究所, 农业部饲料生物技术重点试验室, 北京 100081; 2. 河北省科学院生物研究所,石家庄 050081)
通过研究 QsdA型 N-酰基高丝氨酸内酯酶酶学性质来评估其饲用潜力。研究通过提取红球菌(Rhodococcus erythropolis)BLJF-1的基因组, 利用 PCR 技术克隆得到 N-酰基高丝氨酸内酯酶基因 qsdA-rh5。构建重组表达载体pET28a/qsdA-rh5转化大肠杆菌BL21(DE3), 筛选得到具有N-酰基高丝氨酸内酯酶活性的转化子即为重组菌株, 随后经Ni-NTA柱纯化得到的重组蛋白QsdA-RH5进行补充酶学性质的研究。结果表明, 克隆得到972 bp的目的基因。构建重组载体, 筛选得到重组菌株经诱导表达后得到具有N-酰基高丝氨酸内酯酶活性的目的蛋白即 QsdA-RH5, 经分析表明, 该蛋白的理论分子量为 36 kD, 属于金属依赖性水解酶PET超家族。酶学性质研究表明: 其最适作用 pH 为 8.0, 作用温度为 35℃, 在 pH 6—11内能够稳定的存在, 在10—40℃, 酶活性能够维持在 80% 以上, 且该酶对多种金属离子、化合物具有很好的抗性。该融合蛋白具有较为专一的底物特异性, 只对没有取代基团的底物具有水解作用, 以 C7-HSL 为底物时的Km值为0. 0125 mmol/L。实验经酶学性质研究表明, 该酶具有较为专一的底物特异性, 因此可具有针对性的控制外源性病原菌毒性效应对维护畜禽 ( 水产) 消化道健康方面具有一定的应用前景。
红球菌; N-酰基高丝氨酸内酯酶; 重组表达; 酶学性质
细菌根据特定信号分子的浓度可以检测周围环境中自身或其他细菌的数量变化: 当信号达到一定的浓度阈值时, 能启动菌体中相关基因的表达来适应环境中的变化, 这一调控系统被称为细菌的群体感应系统(Quorum sensing, 简称QS)[1,2]。在革兰氏阴性细菌中群体感应的种内信号分子是 N-酰基高丝氨酸内酯(AHLs), 当 AHLs浓度达到一个阈值即可调控下游靶基因的表达, 并产生表型效应, 包括生物荧光、Ti质粒转移、涌(泳)动现象、抗生素和色素的生物合成及生物膜形成[3—7]。在众多的表型效应中, 我们最关注的是群体感应与调控病原菌的致病性有着密切的联系。现已证实包括嗜水气单胞菌 (Aeromonashydrophila)、 迟 缓 爱 德 华 氏 菌(Edwardsiellatarda)、创伤弧菌(Vibrio vulnificus)、鳗弧菌(Vibrio anguillarum)、副溶血弧菌(Vibrio parahaemolyticus)、溶藻弧菌(Vibrio alginolyticus)及霍乱弧菌(Vibrio cholera)等多种水产养殖主要细菌性病原菌的致病性与群体感应的调控有关, 其中包括调控诱导蛋白酶、裂解酶、毒素、铁载体、黏附因子等多种毒力因子的表达[2,8—13]。在过去的十几年中研究发现一些方法可以阻断群体感应的发生,这一阻断途径统称为群体淬灭, 在众多的阻断过程中, 利用N-酰基高丝氨酸降解酶淬灭病原菌群体感应通路中的信号分子[14], 具有既可以通过阻断策略达到防治水产养殖细菌性病害的目的, 又可以使毒性淬灭后的病原细菌成为天然的减毒活疫苗的双重功效。
N-酰基高丝氨酸降解酶广泛存在于自然界, 目前已在来源于细菌、真菌、哺乳动物细胞及环境土壤样品的宏基因组中克隆得到编码 N-酰基高丝氨酸降解酶的基因[7]。N-酰基高丝氨酸降解酶按照降解AHLs位点的不同分为两大类, 一类是N-酰基高丝氨酸酰基转移酶(AHL acylase), 如AiiD、AhlM、QuiP、PvdQ、HacB、Aac 和AiiO等[15—21]。另一类是N-酰基高丝氨酸内酯酶(AHLase)[22]。如QsdH[2]、AidC[7]、AhlD、AhlK[8]、AiiA[23]、AiiB、AttM[24,25]、QlcA[26]、AiiM[27]、AidH[28]和QsdA[29]等。
Uroz等[30]筛选得到一株具有AHLs降解活性的红球菌(Rhodococcus erythropolis)W2, 经研究表明,该红球菌具有广谱的底物特异性及快速降解 AHLs的能力, 并发现其可以通过降解 AHLs来干扰色杆菌属(Chromobacterium)中紫色杆菌素的产生, 农杆菌属(Agrobacterium)中致病因子的调控及明显的降低果胶杆菌(Pectobacterium carotovorum)的致病性,这表明该红球菌是一个潜在的生物防控制剂。2008年Uroz等[29]经过进一步研究从红球菌(Rhodococcus erythropolis W2)中克隆得到N-酰基高丝氨酸内酯酶基因 qsdA并将其表达的目的蛋白命名为 QsdA, QsdA 属于Phosphotriesterase (PTE)超家族, 是一个金属依赖性的水解酶, 其中含有两个 Zn2+离子参与催化作用, 随后Uroz等又从其他的红球菌及其亲缘关系相近的菌种中筛选得到15株具有N-酰基高丝氨酸内酯酶活性的菌株。然而与其他的N-酰基高丝氨酸内酯酶相比[2,7,27,31—34], 还没有见到系统深入的评估QsdA型N-酰基高丝氨酸内酯酶是否适合作为饲用酶制剂的文献报道。因此本研究的目的是确定QsdA型N-酰基高丝氨酸内酯酶酶学性质并进一步评估其作为水产养殖饲用酶制剂的应用潜力。我们从红球菌(R. erythropolis)BFXJ-1中克隆得到一个具有 N-酰基高丝氨酸内酯酶活性的基因命名为qsdA-rh5, 并将其在大肠杆菌中表达, 经纯化后得到重组蛋白QsdA-RH5并通过酶学性质的研究对其应用前景进行全面评估。
1 材料与方法
1.1 实验材料
菌种、质粒、载体 红平红球菌(R. erythropolis)BFXJ-1(ACCC02579)来源于中国农业微生物菌种保藏管理中心, 用于克隆N-酰基高丝氨酸内酯酶。报告菌株 Agrobacterium tumefaciens KYC55 (pJZ372) (pJZ384) (pJZ410)由南京农业大学朱军教授馈赠[35], 大肠杆菌感受态细胞 Trans-Ⅰ和克隆载体 pEASY-T3购自北京全式金生物公司, 大肠杆菌感受态细胞 BL21 (DE3)和表达载体pET-28a(+)购自德国Novagen公司。
主要的培养基 LB培养基用于活化菌株, ATmm培养基用于N-酰基高丝氨酸内酯酶活性测定。
主要的化学试剂及仪器 C4-HSL、C6-HSL、C7-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL、3-oxo-C6-HSL、3-oxo-C8-HSL、3-oxo-C10-HSL、3-oxo-C12-HSL、3-oxo-C14-HSL、3-hydroxy-C12- HSL和3-hydroxy-C14-HSL购自美国Sigma公司, IPTG和X-gal购自美国Promega公司, 内切酶都购自日本TaKaRa公司, 连接酶购自 Invitrogen公司, 其他试剂均系进口分装或国产分析纯。本研究使用的主要仪器有: PCR仪(Techne公司)、SDS-PAG系统( Aamersham Pharmacia Biotech)。
1.2 N-酰基高丝氨酸内酯酶活性测定方法
N-酰基高丝氨酸内酯酶活性测定方法参考文献[36]的方法。反应体系: 包括179 μL PBS (pH 8.0), 20 μL QsdA-RH5及1 μL C7-HSL (10 mmol/L)混合,在35℃下抚育45min后用终浓度2% SDS终止反应。制备 1.5% (w/v)琼脂条: 将 ATmm混合 20 μg/mL X-gal的培养基倒入平板内, 用小刀将凝固的琼脂培养基割成0.8 cm × 6.0 cm的测试条, 在琼脂条的一端打一个小孔, 在小孔后用牙签每隔 4 mm接种一个指示菌KYC55。将上述反应液10 μL 加到打好的小孔内, 30℃培养24h观察指示菌颜色变化。根据指示菌颜色变化推算 C7-HSL扩散的距离。根据C7-HSL扩散的距离与已知标品浓度的关系制作标准曲线[y (nmol) =0.0005×e0.2984x, R2= 0.980], 酶活的定义为1 nmol/min C7-HSL所用到的酶量为一个酶活单位(U)。其他AHLs信号分子依照此方法做标准曲线, 用来测定AHLs的浓度。
1.3 N-酰基高丝氨酸内酯酶基因克隆及序列分析
设计引物: QsdA-F (5′-AGTTCAGTACAAACC GTTCGTG-3′)和QsdA-R (5′- TCAGCTCTCGAAGT ACCG-3′), 从红球菌BFXJ-1基因组中扩增N-酰基高丝氨酸内酯酶基因qsdA-rh5。PCR 采用50 μL反应体系, 扩增条件: 95℃5min; 94℃30s, 55℃ 30s, 72℃ 1min, 30 个循环; 72℃ 10min。 PCR产物经纯化后连接pEASY-T3载体转化大肠杆菌Transe-Ⅰ感受态细胞。挑取阳性克隆送测序, 将测序得到的结果用Vector NTI 7软件和NCBI分析。用SignalP (http://www.cbs.dtu.dk/services/SignalP/) 软件分析信号肽序列。
1.4 QsdA-RH5的表达与纯化
设计引物 QsdA-EF: 5′-CGGAATTCAGTTC AGTACAAACCGTTCGTG-3′ (上游引入EcoRⅠ酶切位点)和QsdA-ER 5′-AAGCGGCCGCTCAGCTCTC GAAGTACCG-3′ (下游引入NotⅠ酶切位点)。95℃5min; 94℃ 30s, 55℃ 30s, 72℃ 1min, 30个循环; 72℃ 10min。 PCR产物及pET-28a(+)空载体经纯化后分别用EcoRⅠ 和NotⅠ双酶切, 随后用T连接酶进行连接得到重组载体pET-qsdA-rh5转化大肠杆菌BL21 (DE3)感受态细胞, 筛选得到阳性克隆即为重组菌株。将重组菌按2%接种到LB液体培养基中, 37℃培养, 当菌液的OD值为0.6—0.8时加入终浓度1 mmol/L的IPTG于20℃诱导12h收集菌体。将经诱导后收集得到的菌体超声破碎后离心收集上清液即为目的蛋白液QsdA-RH5。
QsdA-RH5目的蛋白的纯化 将细胞破碎后收集的上清液过Ni-NTA柱纯化蛋白, Ni-NTA柱洗脱 液 分 别 为 [20 mmol/L Tris-HCl (pH 7.6), 500 mmol/L NaCl, 10% (w/v) 甘油]缓冲液中添加终浓度为20—200 mmol/L的咪唑。经梯度洗脱后分别收集洗脱液, 用12% SDS-PAGE验证后将得到的纯蛋白进行质谱(LC-ESI-MS/MS)测序。用考马斯亮蓝的方法检测蛋白的浓度[37]。
1.5 QsdA-RH5的酶学性质测定
除底物特异性外, 其他的酶学性质都是以信号分子 C7-HSL为底物进行测定的。
最适pH 在30℃, 抚育45min条件下分别将酶液混合在 pH 4.0—11的缓冲液中测定 QsdARH5在不同pH条件下的稳定性。所用的pH缓冲液分别为: pH 4.0—5. 0、0.1 mol/L的柠檬酸缓冲液; pH 6.0—8.0、0.1 mol/L的 PBS缓冲液; pH 8.0—9.0、0.1 mol/L 的 Tris-HCl缓冲液; pH 9.0—11.0、0.1 mol/L的 Gly-NaOH 缓冲液。以最高酶活力为100%, 各个 pH下的酶活力与最高活力的比值作为相对酶活力。
最适温度 在最适pH、抚育 45min条件下,分别在0℃、10℃、20℃、25℃、30℃、35℃、40℃、50℃、60℃和65℃下测定QsdA-RH5酶活。以最高酶活力为 100%, 各个温度下的酶活力与最高活力的比值作为相对酶活力。
pH稳定性 将QsdA-RH5酶液与不同pH的缓冲液(pH 4.0—12.0)按1∶9的比例混合后在30℃保温1h后作为待测液, 以在最适pH条件下保温1h为对照。在最适条件下, 抚育45min测定QsdA-RH5的酶活。以对照测定的酶活为100% , 各个pH下的酶活力与对照酶活力的比值作为相对酶活力。
温度稳定性 在 70℃下, 在最适 pH缓冲液中将酶液分别保温 2min、5min、10min、15min、20min、30min、60min后, 以在最适温度条件下保温1h为对照, 再将保温后的溶液作为待测溶液, 在最适条件下抚育45min测定QsdA-RH5的酶活。以对照测定的酶活为 100%, 不同时间抚育后溶液的酶活力与对照酶活力的比值作为相对酶活。
金属离子抗性 在最适的反应体系中, 分别加入不同的金属离子或化学试剂 (K+、Na+、Ca2+、Li+、Co2+、Cr3+、Ni2+、Cu2+、Mg2+、Fe2+、Mn2+、Zn2+、Ag+、Hg2+、Pb+、EDTA、β-mercaptoethanol和SDS, 终浓度为1 mmol/L或10 mmol/L) 。以未加金属离子或化学试剂的反应体系为对照, 在最适条件下抚育45min测定QsdA-RH5的酶活。以对照测定的酶活为 100%, 其他各个处理的酶活力与对照酶活力的比值作为该体系的相对酶活力。
动力学测定 在最适条件下, 依次在酶促反应1min、2min、3min、5min、10min、15min、20min、30min时终止反应, 测定QsdA-RH5的酶活, 计算出酶促反应的一级反应时间。再根据测定的一级反应时间, 确定测定Km值及 Vmax的反应时间为 15min。用不同浓度的信号分子C7-HSL (10、5、1、0.5、0.1、0.05、0.01、0.005、0.001、0.0005 mg/mL)为底物, 在最适条件下测定酶活力, 计算相应的反应速度, 利用米氏方程双倒数法求得 Km值及 Vmax。
底物特异性 在最适条件下, 分别以0.25 mmol/mL的C4-HSL、C6-HSL、C7-HSL、C10-HSL、C12-HSL、C14-HSL、3-oxo-C12-HSL、3-oxo-C14-HSL、3-hydroxy-C14-HSL、0.05 mmol/mL 的C8-HSL、3-oxo-C6-HSL、3-oxo-C8-HSL、3-oxo-C10-HSL、3-hydroxy-C12-HSL作为底物, 测定 QsdARH5的酶活。
比活力测定 比活力单位为(U/mg)。通过考马斯亮蓝法G-250试剂测定样品酶液中的蛋白含量, 同时在最适温度下测得重组酶的酶活, 由此得到酶的比活。
2 结果
2.1 QsdA-RH5目的基因的获得及序列分析
从红球菌BFXJ-1中克隆得到一个小于1000 bp的目的条带, 经过Vector NTI 7和NCBI软件分析,该目的基因全长972 bp, 编码一个由323氨基酸残基及一个终止密码子组成的蛋白质, 其理论分子量为35.73 kD, 推测的等电点为4.71, 用SignalP软件预测该蛋白没有信号肽序列。序列分析表明, QsdA-RH5属于 PTE 超家族, 并与红球菌(R. erythropolis) SK121 (ZP_04385486.1)的同源性最高,序列相似性为 100%, 与其他来源于红球菌的 N-酰基高丝氨酸内酯酶相比同源性在80%以上。
2.2 QsdA-RH5的表达与纯化
QsdA-RH5经诱导表达后测定的酶活力8.50 U/mL, 略高于红球菌活化后经超声破碎液测定的酶活力6.43 U/mL。由图1所示, 经过Ni-NTA柱纯化后在SDS-PAGE中可以看到在35 kD (其中包括重组的His标签)处得到一条纯度大于90%的目的蛋白, 与预测的理论分子量一致。将目的条带进行质谱(LC-ESI-MS/MS)分析后得到与推测蛋白序列一致的10个肽段(VLMHEHVFVLGEELRQNYPDY PEPWDEEVR, GISTIVDPTVIGLGR, EGIAGTGVR, CAIEEPGLTPGVER, FGLEPFLSFEDRVNTVVEMAR, MVLAHDASCFIDYFPSAARE, VALPNWNYTHISD DVIPALLER和 AMLVDNPR)。以C7-HSL为信号分子测定纯化后的QsdA-RH5的比活力为292.83 U/mg。

图1 SDS-PAGE验证QsdA-RH5在大肠杆菌中的表达Fig. 1 SDS-PAGE gel of recombinant QsdA-RH5 from E. coli BL21 (DE3)
2.3 QsdA-RH5的酶学性质研究
pH及温度的测定 QsdA-RH5的最适pH为8.0, 在 pH 7.0—8.0内保持 80%以上的酶活力(图2A)。QsdA-RH5在pH 4.0—12.0间都很稳定, 可以保持80%以上的酶活(图2B); QsdA-RH5的最适温度为35℃, 在20—35℃内酶活力保持80%以上(图2C); QsdA-RH5在70℃保温20min后剩余酶活力为60%左右。(图2D)。
金属离子及相关化学试剂的抗性 在添加1 mmol/L的金属离子时 Co2+、Mg2+、Ni2+、Zn2+和Mn2+可增强QsdA-RH5酶的活力, 在添加10 mmol/L的金属离子时 Mg2+、Ni2+、Na+和 Mn2+可增强QsdA-RH5酶的活力, 而 Cr3+、Cu2+、Zn2+、Fe3+可抑制酶的活力, 其中 Ag+、β-巯基乙醇和SDS在添加不同的金属离子浓度下都对酶活力具有抑制作用(表1) 。
QsdA-RH5的动力学测定 QsdA-RH5动力学的测定结果为 Vmax= 0.25 nmol/(mg·min), Km= 0.0125 mnom/L。
QsdA-RH5的底物特异性测定 QsdA-RH5底物特异性测定结果(表 2)。QsdA-RH5能够降解C4-HSL、C6-HSL、C7-HSL、C8-HSL、C10-HSL和C12-HSL。而对C14-HSL、3-oxo-C6-HSL、3-oxo-C8-HSL、3-oxo-C10-HSL、3-oxo-C12-HSL、3-oxo-C14-HSL、3-H-C12-HSL和3-H-C14-HSL的降解效果不明显。与红球菌(R. erythropolis)W2具有广谱的底物特异性不同[29], QsdA-RH5 具有较为专一的降解底物谱, 只对没有取代基团的底物具有水解作用, 这与文献报道的另一株红球菌PI33相似[38]。
3 讨论
水产养殖细菌性病害(G–细菌病原占致病病因90%以上, 其中嗜水气单胞菌Aeromonas hydrophila占 60%以上)严重制约着我国水产养殖可持续化发展与无公害水产品输出。针对水产养殖细菌性病害无抗防治的技术瓶颈, 立足于饲用阻断策略, 挖掘具有饲用潜力的N-酰基高丝氨酸内酯酶制剂, 对于构建基于群体感应调控机制的水产养殖细菌性病害无抗防治体系具有重要意义。

图2 QsdA-RH5温度与pH的测定Fig. 2 Physical parameters that affected QsdA-RH5 activity
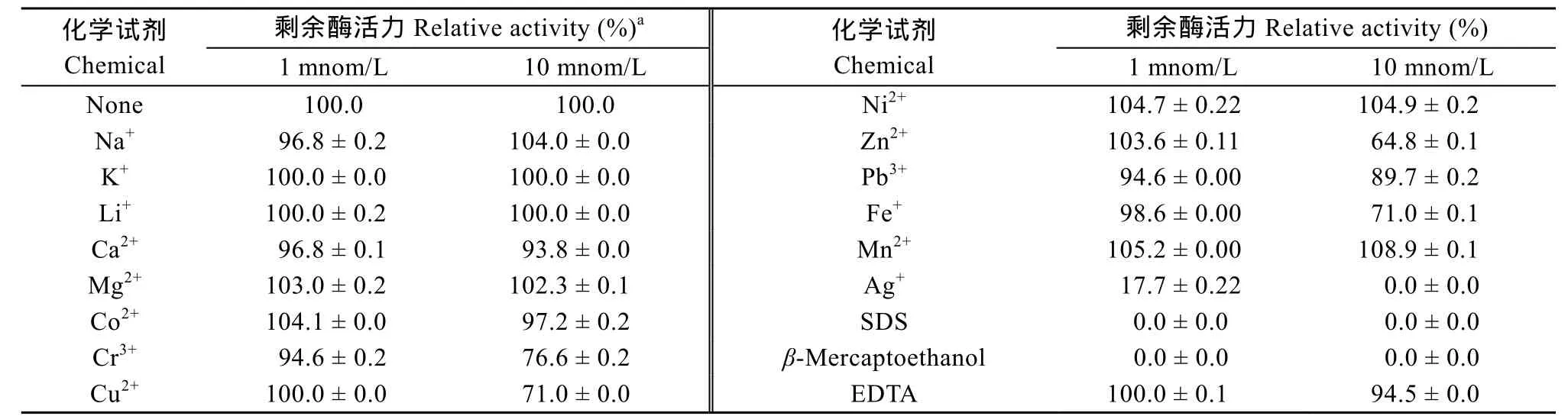
表1 金属离子及相关化学试剂的抗性Tab. 1 Effects of metal ions and chemicals on QsdA-RH5 activity

表2 QsdA-RH5降解AHLs的活力Tab. 2 The hydrolytic ability of QsdA-RH5 to AHLs

本研究报道的QsdA-RH5经氨基酸序列比对结果表明与Livnat Afriat等[39]报道的红球菌来源的磷脂酶AhlA氨基酸序列一致, 都属于PTE超家族, 该超家族最早被认为是对各种有机磷化合物具有催化水解作用的一类酶[29,40], 近年来越来越多的文献报道 PTE超家族的酶具有酰基水解酶或者是 N-酰基高丝氨酸内酯酶活性[29,41]。文本报道的QsdA-RH5在Livnat Afriat等报道的AhlA基础上, 完善了酶学性质的研究。例如Livnat Afriat等只对Mn2+、Zn2+、Co2+三种金属离子进行了研究, 而本文分析了17种饲料及养殖环境中存在的金属离子; 在底物特异性分析中本文重点分析了14种AHLs类信号分子, 而Livnat Afriat等只是选取了其中4种AHL类信号分子; 本文还分析了QsdA-RH5的pH、温度、比活力等相关的酶学性质, 这些在 Livnat Afriat报道的文章中未作深入的研究。因此本文更全面的研究了该酶的酶学性质, 为深入、全面评估该酶作为水产饲用酶制剂的应用奠定理论基础。同时 Livnat Afriat等[39]报道, AhlA在添加二价金属离子的时可以促进其内酯酶活力, 尤其添加 Zn2+后效果尤为显著。但本文报道的N-酰基高丝氨酸内酯酶QsdA-RH5却是添加Mn2+后对酶活力具有最明显的促进效果。以及Livnat Afriat等[39]报道对oxo-C8-HSL具有降解效果,而本文报道的QsdA-RH5却对oxo-C8-HSL降解效果不明显。对此研究结果存在的差异, 我们推测是因为采用的表达载体不同或者测定时样品的处理方法不同造成的差异, 需进一步深入研究。
此外本研究报道的QsdA-RH5与其他来源于PTE超家族的N-酰基高丝氨酸内酯酶相比具有相似的最适温度及最适pH, 同时二价阳离子是决定酶活力的关键因素。但与其他来源于PTE超家族的N-酰基高丝氨酸内酯酶相比 QsdA-RH5表现出了更为专一的底物降解能力, 其专一的水解在3位碳原子上没有取代基团的信号分子。
近年来随着群体感应研究的深入, N-酰基高丝氨酸内酯酶的研究也越来越多, 越来越细致。这其中也有许多文献报道了来源不同细菌的 N-酰基高丝氨酸内酯酶酶学性质评估情况, 其中包括AidC、AiiM、QsdH、AiiA-AI96、AiiA SS10、AiiAB546与AiiA 240B1等[31—34,2,7,27]。
不同细菌来源的 N-酰基高丝氨酸内酯酶其酶学性质上也存在一些异同。我们将本研究中报道的QsdA-RH5与其他的N-酰基高丝氨酸内酯酶的酶学性质对比发现, 这些N-酰基高丝氨酸内酯酶的最适温度一般在20—40℃内。最适pH为8.0, QsdA-RH5的热稳定性好于AidC、AiiA SS10及AiiA 240B1[7,41,31],但与AiiA-AI96在80°C保温30min后酶活力70%以上相比要较差一些[33]。此外QsdA-RH5对金属离子 Mg2+、Mn2+、Ni2+与Zn2+的抗性要好于AidC和AiiA-AI96[7,33], 添加Mn2+可以显著的提高酶活力。与其他的所有 N-酰基高丝氨酸内酯酶相比QsdA-RH5最大的特点是具有较为专一的降解底物谱。综上所述, QsdA-RH5具有适宜水产养殖环境作用的 pH (pH7.0—8.0)及温度(20—40℃); 具有良好的 pH稳定性及温度稳定性, 可减少其在饲料生产中对酶活力效价的损失; 对多种水产养殖环境及饲料中存在的金属离子具有良好的抗性, 尤其是对Cu2+等环境中存在较多的金属离子具有较强的抗性,即为其作为潜在的水产饲用酶制剂提供基础保障;对底物具有较为专一的降解谱, 可用于预防特定的细菌性病原菌的致病性而不会对微生态环境造成太大的影响; 综合以上酶学性质评估表明, QsdA-RH5具有饲用酶制剂的应用潜力, 是一个极具潜力的生防制剂。
[1] Fuqua W C, Winans S C, Greenberg E P. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators [J]. Journal of Bacteriology, 1994, 176(2): 269—275
[2] Huang W, Lin Y J, Yi S Y, et al. QsdH, a novel AHL lactonase in the RND-type inner membrane of marine Pseudoalteromonas byunsanensisstrain 1A01261 [J]. PLoS ONE, 2012, 7(10): e46587
[3] Miller M B, Bassler B L. Quorum sensing in bacteria [J]. Annual Review of Microbiology, 2001, 55: 165—199
[4] Morohoshi T, Nakazawa S, Ebata A et al. Identification and characterization of N-acylhomoserine lactone-acylase from the fish intestinal Shewanella sp. strain MIB015 [J]. Bioscience Biotechnology and Biochemistry, 2008, 72(7): 1887—1893.
[5] Bainton N J, Stead P, Chhabra S R, et al. N-(3-oxohexanoyl)-L-homoserine lactone regulates carbapenem antibiotic production in Erwinia carotovora [J]. Biochemical Journal, 1992, 288: 997—1004
[6] Davies D G, Parsek M R, Pearson J P, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm [J]. Science, 1998, 280(5361): 295—298
[7] Wang W Z, Morohoshi T, Someya N, et al. A novel N-acylhomoserine lactonase from the potato root-associated Cytophaga-Flavobacteria-Bacteroides (CFB) group bacterium, Chryseobacterium sp. StRB126 [J]. Applied and Environ-mental Microbiology, 2012, 78(22): 7985—7992
[8] Park S Y, Lee S J, Oh T K, et al. AhlD, an N-acyl homoserine lactonase in Arthrobacter sp., and predicted homologues in other bacteria [J]. Microbiology, 2003, 149(6):1541—1550
[9] Asad S, Opal S M. Bench-to-bedside review: Quorum sensing and the role of cell-to-cell communication during invasive bacterial infection [J]. Critical Care, 2008, 12(6): 236
[10] Choudhary S, Schmidt-Dannert C. Applications of quorum sensing in biotechnology [J]. Applied and Environmental Microbiology, 2010, 86(5): 1267—1279
[11] De Kievit T R, Iglewski B H. Bacterial quorum sensing in pathogenic relationships [J]. Infection and Immunity, 2000, 68(9): 4839—4849
[12] Parker C T, Sperandio V. Cell-to-cell signaling during pathogenesis [J]. Cellular Microbiology, 2009, 11: 363—369
[13] Williams P, Camara M, Hardman A, et al. Quorum sensing and the population-dependent control of virulence. Philosophical [J]. Transactions of the Royal Society B: Biological Sciences, 2000, 355(1397): 667—680
[14] Schipper C, Hornung C, Bijtenhoorn P, et al. Metagenomederived clones encoding two novel lactonase family proteins involved in biofilm inhibition in Pseudomonas aeruginosa [J]. Applied and Environmental Microbiology, 2009, 75(1): 224—233
[15] Dong Y H, Wang L H, Xu J L, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase [J]. Nature, 2001, 411: 813—817
[16] Lin Y H, Xu J L, Hu J Y, et al. Acyl-homoserine lactone acylase from Ralstonia strain XJ12B represents a novel and potent class of quorum-quenching enzymes [J]. Molecular Microbiology, 2003, 47(3): 849—860
[17] Park S Y, Kang H O, Jang H S, et al. Identification of extracellular n-acylhomoserine lactone acylase from a Streptomyces sp. and its application to quorum quenching [J]. Applied and Environmental Microbiology, 2005, 71(5): 2632—2641
[18] Wong C S, Yin W F, Sam C K, et al. Characterization of wetland quorum quenching Pseudomonas aeruginosa strain 2SW8 and its 2-heptyl-3-hydroxy-4-quinolone production [J]. New Microbiologica, 2012, 35: 43—51
[19] Ryan W S, Steven E L. Two dissimilar N-Acyl-Homoserine lactone acylases of pseudomonas syringae influence colony and biofilm morphology [J]. Applied and Environmental Microbiology, 2009, 71(1): 45—53
[20] Chen C N, Chen C J, Liao C T, et al. A probable aculeacin A acylase from the Ralstonia solanacearum GMI1000 is N-acyl-homoserine lactone acylase with quorum-quenching activity [J]. BMC Microbiology, 2009, 9(89): 1—11
[21] Czajkowski R, Krzyz˙anowska D, Karczewska J, et al. Inactivation of AHLs by Ochrobactrum sp. A44 depends on the activity of a novel class of AHL acylase [J]. Environmental Microbiology Reports, 2011, 3(1): 59—68
[22] Kim M H, Choi W C, Kang H O, et al. The molecular structure and catalytic mechanism of a quorum-quenching N-acyl-L-homoserine lactone hydrolase [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(49):17606—17611
[23] Dong Y H, Xu J L, Li X Z, et al. AiiA, an enzyme that inactivates the acyl homoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora [J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(7): 3526—3531
[24] Carlier A, Uroz S, Smadja B, et al. The Ti plasmid of Agrobacterium tumefaciens harbors an attM-paralogous gene, aiiB, also encoding N-acylhomoserine lactonase activity [J]. Applied and Environmental Microbiology, 2003, 69: 4989—4993
[25] Zhang H B, Wang L H, Zhang L H. Genetic control of quorum-sensing signal turnover in Agrobacterium tumefaciens [J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99: 4638—4643
[26] Riaz K, Elmerich C, Moreira D, et al. A metagenomic analysis of soil bacteria extends the diversity of quorumquenching lactonases [J]. Environmental Microbiology, 2008, 10: 560—570
[27] Wang W Z, Morohoshi T, Ikenoya M, et al. AiiM, a novel class of N-acylhomoserine lactonase from the leaf-associated bacterium Microbacterium testaceum [J]. Applied and Environmental Microbiology, 2010, 76: 2524—2530
[28] Mei G Y, Yan X X, Turak A, et al. AidH, an alpha/beta hydrolase fold family member from an Ochrobactrum sp. strain, is a novel N-acylhomoserine lactonase [J]. Applied and Environmental Microbiology, 2010, 76: 4933—4942
[29] Uroz S, Oger P M, Chapelle E, et al. A Rhodococcus qsdA-encoded enzyme defines a novel class of large-spectrum quorum quenching lactonases [J]. Applied and Environmental Microbiology, 2008, 74: 1357—1366
[30] Uroz S, D’Angelo-Picard C, Carlier A, et al. Novel bacteria degrading N-acylhomoserine lactones and their use as quenchers of quorum-sensing-regulated functions of plant-pathogenic bacteria [J]. Microbiology, 2003, 149: 1981—1989
[31] Qiu J, Li C G, Jia Z H, et al. Enzymatic characterization and function of N-acylhomoserine lactonase SS10 [J]. Acta Phytopathologica Sinica, 2007, 37(6): 629—636 [邱健, 李承光, 贾振华, 等. 酰基高丝氨酸内酯酶SS10的酶学特性及其抗软腐病功能的初探. 植物病理学报, 2007, 37(6): 629—636].
[32] Wang L H, Weng L X, Dong Y H, et al. Specificity and enzyme kinetics of the quorum-quenching N-acyl homoserine lactone lactonase (AHL lactonase) [J]. The Journal of Biological Chemistry, 2004, 279: 13645—13651
[33] Chen R D, Zhou Z G, Cao Y N, et al. High yield expression of an AHL-lactonase from Bacillus sp. B546 in Pichia pastoris and its application to reduce mortality in aquaculture [J]. Microbial Cell Factories, 2010, 9(39): 1—10
[34] Cao Y N, He S X, Zhou Z G, et al. Orally administered thermostable N-acyl homoserine lactonase from Bacillus sp. strain AI96 attenuates Aeromonas hydrophila infection in zebrafish [J]. Applied and Environmental Microbiology, 2012, 78(6): 1899—1908
[35] Zhu J, Chai Y R, Zhong Z T, et al. Agrobacterium bioassay strain for ultrasensitive detection of N-acylhomoserine lactone-type quorum-sensing molecules: detection of autoinducers in Mesorhizobium huakuii [J]. Applied and Environmental Microbiology, 2003, 69: 6949—6953
[36] Ravn L, Christensen A B, Molin S, et al. Methods for detecting acylated homoserine lactones produced by Gram-negative bacteria and their application in studies of AHL-production kinetics [J]. Journal of Microbiological Methods, 2001, 44: 239—251
[37] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72: 248—254
[38] Park S Y, Hwang B J, Shin M H, et al. N -acylhomoserine lactonase-producing Rhodococcus spp. With different AHL-degrading activities [J]. FEMS Microbiology Letters, 2006, 261: 102—108
[39] Afriat L, Roodveldt C, Manco G, et al. The latent promiscuity of newly identified microbial lactonases is linked to a recently diverged phosphotriesterase [J]. Biochemistry, 2006, 45(46): 13677—13686
[40] Hong S B, Raushel F M. Metal-substrate interactions facilitate the catalytic activity of the bacterial phosphotriesterase [J]. Biochemistry, 1996, 35: 10904—10912
[41] Roodveldt C, Tawfik D S. Shared promiscuous activities and evolutionary features in various members of the amidohydrolase superfamily [J]. Biochemistry, 2005, 44(38): 12728—12736
AN ANALYSIS OF THE POTENTIAL FOR AQUACULTURE OF N-ACYL HOMOSERINE LACTONASE FROM RHODOCOCCUS ERYTHROPOLIS BFXJ-1
ZHANG Mei-Chao1, YANG Ya-Lin1, SONG Shui-Shan2, XU Li1, YAO Bin1and ZHOU Zhi-Gang1
(1. Key Laboratory for Feed Biotechnology of the Ministry of Agriculture, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China; 2. Institute of Biology, Hehei Academy of Sciences, Shijiazhuan 050081, China)
The objective of this study was supplement to determine the enzymatic properties of QsdA-like AHLases and evaluate their application potentials. The gene qsda-rh5 was amplified from the Rhodococcus erythropolis BLJF-1genomevia PCR technique. After the recombinant vector pET28a/qsda-rh5 was transformed into E. coli BL21 (DE3), transformants with N-acyl-homoserine lactonase activity were screened. The purified QsdA-RH5 was obtained with Ni-NTA column. Both N-acyl-homoserine lactonase activities of QsdA-RH5 were additional characterized. The results showed that an AHL lactonase gene, qsda-rh5, of 972 base pairs, was identified from Rhodococcus erythropolis BFXJ-1. Deduced QsdA-RH5 was a metallo dependent hydrolase belonging to Phosphotriesterase (PTE) superfamily. Recombinant QsdA-RH5 was successfully expressed in Escherichia coli BL21 and purified to electrophoretic homogeneity. The enzyme maintained≥80% of its activity at 10–40℃, pH 8.0. QsdA-RH5 had significant resistance toproteolytic digestion. Interestingly the enzyme conferred the ability to inactivate AHLs with an acyl chain lengths ranging from six to twelve carbon atoms, without substitution at carbon three. We were the expression and characteristics of the QsdA-RH5, indicate the QsdA-RH5 has specificity of substrate. These properties make QsdA-RH5 an outstanding quorum-quenching tool for environment.
Rhodococcus erythropolis; N-acyl homoserine lactonase; Recombinant expression; Enzymatic characteristics
S963.7
A
1000-3207(2015)03-0540-09
10.7541/2015.71
2014-02-28;
2014-12-01
“十二五”国家科技支撑计划项目 (2012 BAD2 5 B02、2013BAD10B01-2); 现代农业产业技术体系北京市鲟鱼鳟鱼创新团队(SCGWZJ 20141104-4)资助
张美超(1985—), 女, 吉林德惠人; 硕士; 研究方向为水产生物安全酶制剂。E-mail: mei_chao_zhang@163.com
周志刚(1974—), 男, 研究员, 博士生导师; 研究方向为鱼类消化微生物。Fax: +86-010-82106073; E-mail: zhou_zg@msn.com
