陶粒浮床对草鱼养殖池塘水质和浮游植物的影响
2015-02-27李晓莉陶玲张世羊赵晓杰陆光全李
李晓莉陶 玲张世羊赵晓杰陆光全李 谷
(1. 中国水产科学研究院长江水产研究所, 武汉 430223; 2. 湖北清碧水水处理科技有限公司, 宜昌 443002)
陶粒浮床对草鱼养殖池塘水质和浮游植物的影响
李晓莉1陶 玲1张世羊1赵晓杰1陆光全2李 谷1
(1. 中国水产科学研究院长江水产研究所, 武汉 430223; 2. 湖北清碧水水处理科技有限公司, 宜昌 443002)
为了探讨陶粒浮床对草鱼养殖池塘浮游植物群落结构的影响, 将6个池塘随机分为两组, 分别为浮床组和对照组, 2013年5—10月对养殖池塘的藻类群落结构和水质因子进行定期采样分析。结果表明: 浮床组池塘水体透明度显著高于对照组(P<0.05), 养殖后期, 浮床组主要营养盐指标显著低于对照组(P<0.05), 微生物总数显著高于对照组(P<0.05)。水质理化指标波动范围小, 系统稳定性较强。试验期间共检出浮游藻类8门111属179种, 其中绿藻93种, 蓝藻25种, 硅藻23种, 裸藻17种, 黄藻6种, 甲藻5种, 金藻5种, 隐藻5种。在养殖中后期, 陶粒浮床对藻类的种类组成有显著影响, 藻类种数明显高于对照组, 浮床组和对照组浮游植物数量范围分别为101. 95×106—614.95 ×106ind./L和151.43×106—612.60 ×106ind./L, 生物量范围分别为90.79—402.85 mg/L和116.33—831.55 mg/L, 到养殖中后期(8月份以后), 对照组浮游植物的生物量显著高于浮床组(P<0.05)。绿藻门和蓝藻门的贡献率一直占总密度的90%以上。浮游植物群落呈明显的季节变化, 绿藻门呈先降低后升高的趋势, 蓝藻门相反。试验初期浮游植物的优势种为栅藻; 在试验开始30d后,浮床组栅藻继续保持优势藻的地位, 对照组的优势种则变为平裂藻和微囊藻; 7—8月份, 浮床组和对照组的优势种均为蓝藻门的平裂藻, 9月份后优势藻逐渐由栅藻和绿球藻取代。浮床组和对照组藻类多样性指数无显著差异, 物种丰富度均呈逐渐下降的趋势, 范围为3.16—5.59, Shannon指数和Simpson指数均呈先降低后升高的趋势, 范围分别为1.50—2.46和0.54—0.87。陶粒浮床对改善池塘水质、丰富藻类种类组成、降低过高生物量和微囊藻爆发的风险有一定作用。
草鱼养殖池塘; 新型陶粒浮床; 浮游植物; 水质
浮床作为一种原位水处理技术因其水质净化效果好、价格低廉、操作简便等特点在富营养化水处理中得到广泛研究和应用[1,2], 但大多数生态浮床对水质净化及水体生态修复的研究视点主要集中在对水体氮磷及有机物质去除上[3,4], 而较少涉及水生态系统的生物环节。
浮游藻类是水生生物的重要组分, 其组成和多样性的变化直接影响到生态系统的结构与功能, 对维持其平衡起到至关重要的作用[5—8]。浮游藻类的种类、密度、生物量与水体营养程度和渔产潜力有密切关系[9,10], 在水产养殖生态系统中, 浮游藻类不仅可以作为适口饵料, 而且对改良改善水质、抑制有害菌群、减少病害也起到至关重要的作用[11]。因此, 研究生态浮床对养殖水体浮游植物的影响重要且必要。
陶粒是一种采用天然矿物或工业废弃物等作为主要原料, 经直接破碎或加工成粒再烧胀而成的人造轻骨料。因其表面和内部多微孔和中孔, 易于微生物附着, 具有较高的生物、化学稳定性, 使其在污水处理技术研究中得到应用。在多年的研究与实践的基础上, 作者研发了一种以陶粒为骨料的新型生态浮床, 通过在水产养殖中的应用, 拟探讨陶粒生态浮床对草鱼精养池塘水质及浮游植物的影响并探索可能的机理, 以期为该浮床的深入研究与应用及水产养殖新模式的发展提供理论参考。
1 材料与方法
1.1 试验设施
试验在位于湖北荆州的中国水产科学研究院池塘生态工程研究中心的试验池塘内进行。试验共涉及 6个池塘, 规格均为 20 m×20 m, 养殖期水深1.5 m。所有池塘均为泥质底、水泥护坡, 试验开始前均经过清淤处理。
1.2 陶粒浮床
陶粒浮床由陶粒浮板、浮床基质和浮床植物组成, 为避免草鱼(Ctenopharyngodon idellus)啃食植物根茎, 增加保护网箱。
陶粒浮板 陶粒浮板的主要骨料为轻质页岩陶粒, 购自湖北宜昌光大陶粒制品有限公司,其化学成分主要有SiO2、Al2O3、Fe2O3、MgO和CaO等。另外, 制作陶粒浮板的物化原料还有珍珠岩、硅酸盐水泥、粉煤灰等无机材料。参考国内外同类技术并结合本浮板材料的特点制作而成长宽各60 cm, 厚度8 cm的板块, 板块上每10 cm预留一个植物栽培孔, 栽培孔直径为10 cm。陶粒浮板栽培孔内设有活动的栽培篮用于填充基质, 栽培篮的网眼直径小于1.0 cm。陶粒浮板示意图如图1所示。
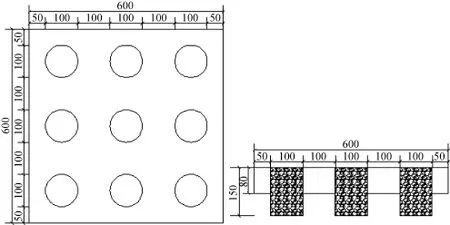
图1 陶粒浮板示意图Fig. 1 Schematic diagram of the ceramsite floating bed
浮床基质 浮床基质选择粒径在10—20 mm的轻质页岩陶粒, 并搭配下列原料混合而成: 陶土、氯化铵、碳酸氢钠、草酸钠、氯化钠等。
浮床植物 试验在前期植物筛选的基础上,选择生物量大、对水质具有较好的净化作用的陆生植物花叶芦竹(Arundo donax)为浮床植物, 花叶芦竹在陆地育苗后移入栽培孔内, 每个栽培孔栽植2株。
1.3 养殖鱼类
试验池塘主养品种为草鱼, 规格为65 g/尾, 密度为1200尾/667 m2, 配养品种为鲢(Hypophthalmichthys molitrix), 规格为200 g/尾, 密度为150 尾/ 667 m2。养殖期间各池塘投饲、管理均一致。
1.4 试验设计
将池塘分为浮床组(架设陶粒浮床)和对照组,每组设3次重复。浮床组(试验组)浮床面积占池塘面积的5%。将20个浮床单体用铁丝相连, 形成整体,当植物进入生长盛期后移入池塘开始试验。试验期间无换水和外排水, 补给水来自降雨和地下水。
1.5 样品采集和测试
试验于2013年5—10月进行。试验期间每15天取样测试水体理化指标, 每30天测试浮游植物指标和微生物指标。
取样方法 在池塘四周各设1个采样点, 用2.5 L采水器分别取表面下25—50 cm处水样, 经搅拌混匀后取混合水样2 L, 1 L用于水质指标测定, 1 L用于浮游植物定量检测。浮游植物水样现场用15 mL鲁哥氏液固定。
水体指标测试 水质测定指标包括水温、溶解氧(DO)、pH、透明度、总氮(TN)、亚硝酸盐氮(NO2
–-N)、氨氮(NH4+-N)、总磷(TP)、高锰酸盐指数(CODMn)、细菌总数(Bacteria)等。其中水温、pH、DO等指标采用YFI水质在线分析仪在现场分析测定,透明度采用黑白透明度盘测定。其他项目水样采集后带回实验室分析。各项水质指标的测定方法均按国家环境保护总局编写的《水和废水监测分析方法》[12]进行。细菌总数采用吖啶橙染色荧光显微镜直接计数法进行。
浮游植物测定 浮游植物样品固定后带回实验室内, 在沉降器内重力沉淀48h, 弃去上清液, 浓缩液收集定容到50 mL, 加数滴福尔马林保存。定量计数在10×40倍显微镜视野下采用迅数R100软件进行, 每个样本计数两次, 每次计数在200个视野。浮游植物的鉴定主要参照胡鸿均等[13], 浮游植物生物量的估算及优势种大小测量方法参考章宗涉和黄祥飞[14]以及金相灿[15]。
1.6 统计方法
数据分析使用SPSS 11.5软件进行了方差分析(ANOVA)和Pearson系数的相关性检验。
2 结果
2.1 理化指标
从表1可以看出, 对照组和浮床组的水温、pH和DO之间未表现出明显的差异(P>0.05)。pH变化在7.5—8.1, DO变化在7—13 mg/L, 均符合渔业水质标准(GB 11607-89)。随着饵料的投喂和浮游生物的增殖, 各池塘透明度均呈逐渐下降趋势, 对照组率先在8月份时降至最低16 cm, 浮床组在9月份降至最低28 cm, 在养殖后期透明度略有增加, 试验期间浮床组的透明度显著高于对照组(P<0.05)。
随着饵料的投喂, 浮床组和对照组水质理化指标均呈上升的趋势, 变化趋势基本一致, 浮床组TN、TP、NH4+-N、NO2
–-N、CODMn的变化范围分别是2.98—5.83、0.42—1.49、0.51—2.55、0.01—0.11和 10.93—24.41 mg/L, 对照组的变化范围分别是3.09—6.85、0.44—2.10、0.45—2.80、0.01—0.18和12.93—29.87 mg/L。在养殖后期, 浮床组营养盐指标(除 NH4
+-N外)均显著低于对照组(P<0.05)。与对照组相比, 浮床组水质理化指标波动范围小, 系统稳定性较强。在养殖中后期, 浮床组细菌总数显著高于对照组(P<0.05)。
2.2 鱼类生长情况
经过5个多月的养殖, 草鱼达到商品规格。表2中数据表明, 在饵料系数显著降低的情况下, 浮床组的草鱼平均体重可以达到 1125 g, 总产量可达到989.7 kg/667 m2, 显著高于对照组(P<0.05), 同时, 试验塘成活率达到77.2%, 显著高于对照组(P<0.05)。

表1 各池塘水质指标随时间的变化Tab. 1 Time courses of the major water quality parameters in all groups
2.3 浮游植物
种类组成 在试验期间(5—10月), 从各养殖塘采集样本中, 共观察到浮游藻类 8门 111属 179种(表3)。种类组成最多的是绿藻门48属93种, 占种类总数的 52.00%; 其次是硅藻门和蓝藻门, 分别是19属23种和18属25种, 占种类总数的14.0%和12.9%; 再依次是裸藻门8属17种, 黄藻门6属6种, 甲藻门5属5种, 金藻门4属5种, 隐藻门3属5种。
另外, 从表3中可以看出, 在试验初期, 浮床组与对照组浮游植物种类组成基本一致, 种类较少,只观察到绿藻门、蓝藻门、硅藻门、裸藻门和甲藻门的物种, 随着水温升高, 两组均呈现种类增多的趋势, 在 6月份时观察到隐藻门和金藻门的种类。随着浮床组与对照组水体环境的改变, 其种类组成也出现较大差异, 在养殖中期(7—8月份)表现为浮床组浮游植物种类数量明显高于对照组, 7月份时分别为7门69种和5门62种, 8月份时分别为7门70种和7门56种。在养殖中后期(9—10月份)浮床组与对照组种类组成之间的差异逐渐减小, 9月份时浮床组与对照组种类数量差异较小, 但蓝藻门的种类数量低于对照组, 硅藻门的种类数量则高于对照组。在养殖末期, 两组之间的种类组成与数量基本一致。

表2 各试验组的养殖效果Tab. 2 Breeding effect in all groups

表3 浮游植物各门类属(种)数及占总数的百分比Tab. 3 Numbers of genera/species of each phylum and their percentages in the total
浮游植物的密度和生物量 整个养殖期间(5—10月), 浮游植物数量和生物量均呈上升趋势,养殖初期的浮床组和对照组浮游植物数量分别为101. 95×106和151.43×106ind./L, 至养殖末期数量上升为432.50×106和397.65×106ind./L, 其中峰值出现在7月份, 由于暴发了以平裂藻为主的微型藻类, 使浮游植物数量急剧上升到614.95×106(浮床组)和612.60×106ind./L(对照组), 整个养殖期间, 浮床组和对照组浮游植物数量差异不显著。随着饲料投喂量的增加, 水体中营养盐也随之增加, 浮游植物生物量在试验期间呈现增长的趋势。浮床组和对照组分别从5月份的90.79和116.33 mg/L上升到10月份的402.85和831.55 mg/L, 且到养殖中后期(8月份以后),对照组浮游植物的生物量显著高于浮床组(P<0.05) (图2)。
浮游植物的群落演替 随着密度和生物量的变化, 浮游植物的群落结构也在不断变化。从数量变化角度看, 浮床组和对照组变化趋势一致, 绿藻门和蓝藻门的贡献率一直占总密度的 90%以上, 绿藻门呈现先降低后升高的趋势, 蓝藻门相反, 在养殖前期较低, 到温度较高的养殖中期, 数量迅速增大, 在7月份时达到了85%(浮床组)和77%(对照组),而后又分别逐渐降低至33%和18%。整个养殖期间硅藻门、裸藻门、隐藻门的浮游植物密度均有波动,但变化较小, 合计贡献率最高只占8%, 不能形成优势种(图3)。

图2 浮游植物数量(×106ind./L)和生物量随时间的变化Fig. 2 Dynamics of phytoplankton quantity and biomass in different treatments during the experimental period
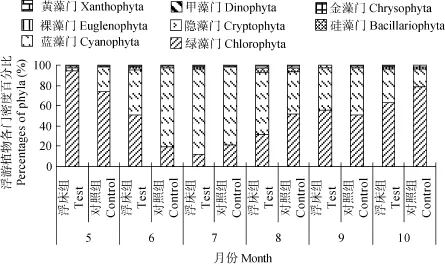
图3 试验期间各处理浮游植物群落结构的变化Fig. 3 Dynamics of the structure of the phytoplankton community
从生物量角度来看, 养殖前期(5—6月份), 浮床组绿藻门的生物量占绝对优势, 随着水温、营养盐的变化, 养殖中期(7—8月份)绿藻门的优势逐渐下降, 裸藻门、硅藻门生物量逐渐增大, 而到了养殖后期绿藻门又占据主导地位; 对照塘的趋势基本与浮床组一致, 除了 9月份, 蓝藻生物量骤然增加外,其余时间段, 绿藻门一直占据绝对优势(图4)。
浮游植物群落的变化也反映在多样性指数变化中, 物种丰富度在整个养殖期间均呈逐渐下降的趋势, 浮床组和对照组变化一致, 无显著差异。物种均匀度指数在养殖中后期(7—10月份)浮床组有高于对照组的趋势。Shannon指数H' (loge)和Simpson指数1-Lambda'均呈现先降低后升高的趋势, 在养殖期间均在1.50以上, 说明物种的多样性较高(表4)。
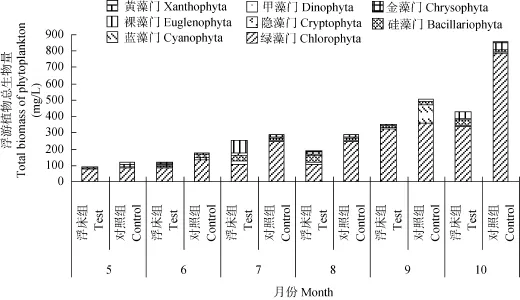
图4 试验期间各处理组中浮游植物生物量随时间的变化Fig. 4 Dynamics of the total biomass of phytoplankton during the experimental period

表4 不同处理组之间浮游植物种类多样性的变化Tab. 4 The bio-diversity of the phytoplankton community in different treatments
在浮游植物的群落结构变化的同时, 浮游植物的优势种类也有较大的变化。试验初期浮游植物的优势种为绿藻门的栅藻(浮床组47.9%、对照组39.1%)和蓝藻门的平裂藻(22.8%); 试验开始 30d后, 浮床组栅藻继续保持优势藻的地位, 而对照组的优势种则变为平裂藻和微囊藻; 随着水温的增高和营养盐的变化, 蓝藻门的平裂藻成为绝对优势藻,特别是在 7月份, 对照塘的平裂藻贡献率高达91.2%; 到了养殖后期, 水温下降, 平裂藻的优势地位逐渐被绿藻门的绿球藻取代, 10月份时绿藻门又重新占据优势藻的位置, 优势种分别是栅藻和绿球藻(表5)。
3 讨论
生态浮床主要通过植物和微生物的共同作用来达到净化水质的目的。吴伟等[16]通过研究浮床植物系统对池塘水体微生物的动态影响发现池塘水体中氮素的变化与浮床植物系统有密切关系。试验初期浮床植物处于根系的生长成型阶段, 其对微生物的吸附固着并不完善, 其净化能力主要靠植物本身的吸收; 在试验中后期, 浮床区微生物数量快速上升,水质的处理效果也明显增强。另外, 微生物的活动也影响到植物的生长[17], 因为植物只能直接吸收水中的一部分氮磷, 而反硝化菌、硝化菌、亚硝化菌可以将不可直接利用的氮变成可直接利用的, 一些真菌则可将不可利用的磷转化为可吸收的磷, 微生物的生长繁殖, 加速了氮磷不同形式的转化, 可以更好的被植物吸收利用, 从而进一步提高浮床的净水能力。陶粒表面和内部多微孔和中孔, 易于微生物附着, 常会庆等[18]发现曝气球形陶粒滤池能够很好的去除城市尾水中NH3-N 和COD, 对二者的去除率都达到了60%以上, 并发现陶粒对尾水的净化在前期主要是通过对污染物的吸附作用去除, 而后期主要靠附着在陶粒表面生物膜的作用来降解污染物。在本研究中, 浮床组营养盐指标显著低于对照组, 细菌总数显著高于对照组, 是植物吸收、微生物降解及陶粒吸附作用共同作用的结果。

表5 试验期间各处理组浮游植物优势种变化Tab. 5 Dominant species in different treatments during the experimental period
浮游植物是水生态系统的重要组成部分, 浮游植物的种类组成与环境因子关系密切, 生态系统中环境因子的改变直接影响着浮游植物群落结构特征[19,20],随水质状况不同其种群结构和数量会发生相应变化。在本研究中, 试验开始30d后, 浮床组栅藻继续保持优势藻的地位, 对照组的优势种则变为平裂藻和微囊藻; 在养殖中后期, 浮床组浮游植物的种类组成与对照组有明显差异, 浮床组藻类种数明显高于对照组, 浮床组浮游植物的生物量显著低于对照组(P<0.05)。这些充分说明陶粒浮床的构建改变了池塘水体环境, 进而影响了池塘水体中浮游植物群落结构。已有研究表明生态浮床对藻类的影响主要通过植物的遮光效应[21,22]、与藻类对营养盐的竞争抑制作用、植物根系的物理截留以及植物根系和浮床基质附着微生物的降解等。王国芳等[23]通过对组合型生态浮床中不同生物单元对污染物去除的贡献研究中发现, 人工介质对藻类的去除作用高于水生植物, 其对藻类的去除途径主要是通过细菌的降解。郭吉等[24]在人工介质上分离出具有较强的溶解铜绿微囊藻细胞作用的芽孢杆菌, 48h内溶藻率可达到96%。在本研究中陶粒浮床所用的陶粒基质粒表面和内部多微孔和中孔, 易于微生物附着, 且研究发现陶粒浮床能显著增加池塘水体中微生物总数以及氮循环细菌的数量(另文), 因此浮床微生物的作用可能是引起浮床组养殖后期浮游藻类生物量显著低于对照组(P<0.05)、6月份未大规模暴发微囊藻的重要原因(对照组6月份微囊藻成为优势种之一)。
浮游微藻普遍具有明显的季节更替现象, 在本研究中浮游藻类的群落结构出现明显的季节变化,从5—10月份, 优势藻出现绿藻-蓝藻-绿藻的变化规律。这与不同的浮游微藻对温度和光照的需求不同有关, 夏季水温高、光照强、日照时间长、水体pH高, 这些气候因素很适合一些喜高温的蓝藻生长,所以浮游微藻种群中蓝藻类比较常见。Sommer等[25]通过对大量湖泊浮游生物的观察研究得出浮游植物的季节演替规律, 大致过程是: 从冬春季以隐藻和硅藻为主转变为夏季以绿藻为主, 到夏末初秋时则以蓝藻占优势; 随着秋季的到来, 硅藻的数量再次上升。在本试验中浮游藻类群落的季节演替与Sommer等[25]的研究基本一致, 不同的是10月份绿藻门成为优势藻类, 出现该现象的原因可能与各种藻类对营养盐的需求量和获取策略不同有关[26,27],随着投饲量的增加, 水体营养盐含量逐渐升高, 绿藻门中的栅藻等属耐有机污染属[28], 且晁建颖等[29]报道栅藻的最适温度为25 ℃ ,所以绿藻门成为10月份的优势藻类。另外, 张扬宗等[30]报道平裂藻容易在夏季形成水华优势种, 其生长繁殖占据光能、营养盐, 能抑制其他有益藻类的繁殖, 这与本试验观察的结果一致, 原因可能是平裂藻具有个体小和相对较大的表面积, 具有更高的吸收效率, 因而占竞争优势[31]。
浮床植物的遮光效应[21,22]是生态浮床影响藻类的原因之一。在养殖池塘中, 藻类作为水体中溶解氧最重要的来源, 其数量和生物量的大小直接影响鱼类的生长。邴旭文和陈家长[32]在进行美人蕉浮床对池塘富营养化水质的控制研究中发现, 30%的植物覆盖率会造成池塘鱼体夜晚缺氧, 在本研究中,陶粒浮床的覆盖面积为5%, 整个养殖期间, 浮床组和对照组浮游植物数量差异不显著。在养殖后期浮床组浮游植物的生物量显著低于对照组, 但仍可达到402.85 mg/L, 浮床组的鱼类成活率、增重显著高于对照组(P<0.05)且无明显的夜间浮头现象, 说明5%的覆盖面积虽然对浮游植物的生物量和群落结构等有一定影响, 但并未达到影响池塘溶氧的程度, 这也说明对照组藻类生物量过大, 富营养化程度严重。
[1] Zhou X P, Wang J G, Xue L H, et al. N and P removal characters of eutrophic water body under planted float [J]. Chinese Journal of Applied Ecology, 2005, 16(11): 195—199 [周小平, 王建国, 薛利红, 等. 浮床植物系统对富营养化水体中氮、磷净化特征的初步研究. 应用生态学报, 2005, 16(11): 195—199]
[2] Song X F, Zou G Y, Wu W M, et al. Study on the removal effect and regulation of rice plants on floating-beds to main nutrients N and P in eutrophicated water bodies [J]. Acta Scientiae Circumstantiae, 1998, 18(5): 43—48 [宋祥甫, 邹国燕, 吴伟明, 等. 浮床水稻对富营养化水体中氮、磷的去除效果及规律研究. 环境科学学报, 1998, 18(5): 43—48]
[3] Si Y B, Bao J J, Cao D J, et al. Purification of eutrophicated water body by Vetiveria zizanioids [J]. Chinese Journal of Applied Ecology, 2003, 14(2): 277—279 [司友斌, 包军杰,曹德菊, 等. 香根草对富营养化水体净化效果研究. 应用生态学报, 2003, 14(2): 277— 279]
[4] Li Y R, Cao J S. Purification effects of floating bed plants on eutrophic water body under low temperature in winter [J]. Environmental Pollution & Control, 2005, 7: 36—39 [李欲如, 操家顺. 冬季低温条件下浮床植物对富营养化水体的净化效果. 环境污染与防治, 2005, 7: 36 —39]
[5] Polishehuk L V. Contribution analysis of disturbance-caused changes in phytoplankton diversity [J]. Ecology, 1999, 80(2): 721—725
[6] Cardinale B J, Palmer M A, Collins S L. Species diversity enhances ecosystem functioning through interspecific facilitation [J]. Nature, 2002, 415(6870): 426—429
[7] Li W. Macroecological patterns of phytoplankton in the northwestern North Atlantic Ocean [J]. Nature, 2002, 419(6903): 154—157
[8] Irigoien X, Harris R P, Verheye H M, et al. Copepod hatching success in marine ecosystems with high diatom concentrations [J]. Nature, 2002, 419(6905): 387—389
[9] Yang H J, Xie C X, He X G, et al. Studies on plankton community structure and its dynamics in recycling and non-recycling aquaculture ponds [J]. Freshwater Fisheries, 2010, 40(3): 28—35 [杨慧君, 谢从新, 何绪刚, 等. 循环水池塘与非循环水池塘中浮游生物的群落结构及其动态研究. 淡水渔业, 2010, 40(3): 28—35]
[10] Wang J G, Yu H X, Ma X C, et al. Analysis of the composition and community structure of phytoplankton in Xingkai Lake [J]. Freshwater Fisheries, 2011, 41(4): 26—31 [王建国, 于洪贤, 马成学, 等. 兴凯湖浮游植物数量特征与群落结构分析. 淡水渔业, 2011, 41(4): 26—31]
[11] Li X S, Yan B L. The impact of microalgae in industrial river-crab seedling [J]. Freshwater Fisheries, 2001, 31(4): 34—35 [李信书, 阎斌伦. 微藻在河蟹工厂化育苗中的作用. 淡水渔业, 2001, 31(4): 34—35]
[12] State EPA of China. Monitoring and Determination Methods for Water and Wastewater, 4th ed [M]. Beijing: China Environmental Science Press. 2002, 88—284 [国家环境保护局《水和废水监测分析方法》编委会. 水和废水监测分析方法(第四版). 北京: 中国环境科学出版社. 2002, 88—284]
[13] Hu H J, Li Y Y, Wei Y X, et al. Freshwater Algae in China [M]. Shanghai: Science Press. 1979, 9—511 [胡鸿钧, 李尧英,魏印心, 等. 中国淡水藻类. 上海: 科学技术出版社. 1979, 9—511]
[14] Zhang Z S, Hang X F. Research Methods of Fresh Water Plankton [M]. Beijing: Science Press. 1991, 333—356 [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社. 1991, 333—356]
[15] Jin X C, Tu Q Y. The Standard Methods in Lake Eutrophication Investigation [M]. Beijing: China Environmental Science Press. 1990, 286—302 [金相灿, 屠清英编. 湖泊富营养化调查规范. 北京: 中国环境科学出版社. 1990, 286—302]
[16] Wu W, Hu G D, Jin L X, et al. Dynamic influence on microorganisms in pond waterbody by the planted float system [J]. China Environmental Science, 2008, 28(9): 791—795 [吴伟, 胡庚东, 金兰仙, 等. 浮床植物系统对池塘水体微生物的动态影响. 中国环境科学, 2008, 28(9): 791—795]
[17] Yu Z J,Wang D Q, Chen J L, et al. Purification of eutrophic river water in artificial floating beds combined with carriers [J]. China Water & Wastewater, 2011, 27(17): 31—35 [虞中杰, 王东启, 陈振楼, 等. 人工浮床加挂填料对富营养化河水的净化效果. 中国给水排水, 2011, 27(17): 31—35]
[18] Chang H Q, Xu X F, Wang S H. Advanced treatment of city tail water by bio-ceramic filter [J]. Ecology and Environmental Sciences, 2012, 21(8): 1452—1456 [常会庆,徐晓峰, 王世华. 球形陶粒滤池对城市尾水净化效果研究.生态环境学报, 2012, 21(8): 1452—1456]
[19] Ignateades L, Vassiliou A, Karydis M A. Comparison of phytoplankton biomass parameters and their interrelation with nutrients in Saronioos Gulf (Greece) [J]. Hydrobiologia, 1985, 128: 1201—1206
[20] Proulx M, Pick F, Mazumder A, et al. Experimental evidence for interactive impacts of human activities on lake algal species richness [J]. Oikos, 1996, 76(1): 191—195
[21] Ren J C, Zhou H, Sun Y T. Vertical distribution of light intensity and light compensation depth of submerged macrophyte in Lake Dianchi [J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 1997, 33(2): 211—214 [任久长, 周红, 孙亦彤. 滇池光照强度的垂直分布与沉水植物的光补偿深度. 北京大学学报(自然科学版), 1997, 33(2): 211—214]
[22] Mulderij G, van Nesc E H, van Donk E. Macrophyte phytoplankton interactions: The relative importance of allelopathy versus other factor [J]. Ecological Modeling, 2007, 204(1/2): 85—92
[23] Wang G F, Wang X J, Wu L, et al. Contribution and purification mechanism of bio-components to pollutants removal in an integrated ecological floating bed [J]. Journal of Civil, Architectural & Environmental Engineering, 2012, 37(4): 136—141 [王国芳, 汪祥静, 吴磊, 等. 组合型生态浮床中各生物单元对污染物去除的贡献及净化机理. 土木建筑与环境工程, 2012, 37(4): 136—141]
[24] Guo J, Pu Y P, Yin L H, et al. Isolation and evaluation of algicidal bacteria from Taihu Lake [J]. Journal of Southeast University (Natural Science Edition), 2006, 36(2): 293—297 [郭吉,浦跃朴, 尹立红, 等. 太湖溶藻细菌的分离及评价.东南大学学报: 自然科学版, 2006, 36(2): 293—297]
[25] Sommer U, Gliwicz M Z, Lampert W. The PEG-model of seasonal succession of planktonic events in freshwaters [J]. Archiv Fur Hydrobiologie, 1986, 106: 422—477
[26] Reynolds C S. Vegetation Processes in the Pelagic: a Model for Ecosystem Theory [M]. California: Ecology Institute. 1997, 371
[27] Oliver R L, Ganf G G. Freshwater Blooms [A]. In: Whitton B A, Potts M (Eds.), The ecology of Cyanobacteria [C]. Dordrecht: Kluwer. 2000, 149—194
[28] Li Y F, Liu L, Chen N, et al. A new type of compound ecological floating bed system and its effect on phytoplankton community structure [J]. Water Resources Protection, 2014, 30(2): 46—51 [李艳枫, 刘凌, 陈宁, 等.一种新型的复合生态浮床及其对浮游植物群落结构的影响. 水资源保护, 2014, 30(2): 46—51]
[29] Chao J Y, Yan R R, Zhan Y M. Optimal growth of and competition between Microcystis aeruginosa and Scenedesmus obliquus related to temperature [J]. Journal of Ecology and Rural Environment, 2011, 27(2): 53—57 [晁建颖, 颜润润, 张毅敏. 不同温度下铜绿微囊藻和斜生栅藻的最佳生长率及竞争作用. 生态与农村环境学报, 2011, 27(2): 53—57]
[30] Zhang Y Z, Tan Y J, Ouyang H. China Pond Pisciculture [M]. Beijing: Science Press. 1989, 66 [张扬宗, 谭玉钧, 欧阳海主编. 中国池塘养鱼学. 北京: 科学出版社. 1989, 66]
[31] Xia S, Zhang Q, Liu G X, et al. Ecological influences of phytoplankton community in an experimental man-made lake [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 640—647 [夏爽, 张琪, 刘国祥, 等. 人工试验湖泊浮游藻类群落的生态学研究. 水生生物学报, 2013, 37(4): 640—647]
[32] Bing X W, Chen J C. The control of eutrophic water in ponds by floating-bed soilless culture of plants [J]. Journal of Zhanjiang Ocean University, 2001, 21(3): 29—33 [邴旭文, 陈家长. 浮床无土栽培植物控制池塘富营养化水质.湛江海洋大学学报, 2001, 21(3): 29— 33]
THE EFFECTS OF A NEW CERAMSITE ECOLOGICAL FLOATING BED ON THE WATER QUALITY AND PHYTOPLANKTON IN GRASS CRAP CULTURE PONDS
LI Xiao-Li1, TAO Ling1, ZHANG Shi-Yang1, ZHAO Xiao-Jie1, LU Guang-Quan2and LI Gu1
(1. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China; 2. Hubei Clear Green Water Treatment Technology Co., LTD, Yichang 443002, China)
In order to study the effects of a new ceramsite ecological floating bed on the phytoplankton community in fishponds, we conducted continuous and regular surveys on the phytoplankton community and the water quality indexes in six grass crap culture ponds from May to October in 2013. Ceramsite ecological floating beds were applied in three ponds as the test groups and the other three were the control groups. During the culture period, we identified 179 species that belonged to 8 phyla and 111 genera. Ninety-three species were Chlorophyta, 25 were Cyanophyta, 23 were Bacillariophyta, 17 were Euglenophyta, 6 were Xanthophyta, 5 were Dinophyta, 5 were Cryptophyta and 5 were Chrysophyta. In the presence of the new ceramsite ecological floating bed, the test groups exhibited higher water transparency and lower concentrations of major nutritive salts compared to the control, and there was little fluctuation in the physical-chemical indexes during the culture. There was a remarkable difference in the planktonic algae community between the test and the control groups in the middle and later culture period. In the mean while, the number of species in the test groups was higher than that in the control groups. There was a insignificant difference in the quantity of phytoplankton between the test and the control groups of which the ranges were 101.95×106—614.95×106ind./L and 151.43×106—612.60×106ind./L respectively. The ranges of biomass were 90.79—402.85 mg/L and 116.33—831.55 mg/L respectively, which were significantly different between the two groups in the middle and later culture period. The contribution of Chlorophyta and Cyanophyta was over 90%. The structure of phytoplankton community showed an obvious seasonal variation: the density and biomass of Chlorophyta first increased and then decreased, while those of Cyanophyta had an opposite trend. In the beginning, Scenedesmus was the dominant species in all ponds; a month later, Merismopedia and Microcystis were dominant in the control and Scenedesmus in the test groups; Merismopedia was the dominant species in July and August and then Scenedesmus and Chlorococcum became dominant. There was an insignificant difference between the test and the control groups in terms of the diversity index, and the ranges of species richness, Shannon-Weiner Index and Simpson’s diversity index were 3.16—5.59, 1.50—2.46 and 0.54—0.87 respectively. Ecological Floating Bed may help improve the water quality, enrich the algae species components, and reduce the risks of overly high biomass and harmful algae blooms.
Grass crap’s culture ponds; A new ceramsite ecological floating bed; Phytoplankton; Water quality
S962.9
A
1000-3207(2015)03-0507-10
10.7541/2015.67
2014-06-20;
2014-11-27
国家科技支撑计划(2012BAD25B05); 现代农业产业技术体系建设专项资金(NYCYTX-49)资助
李晓莉(1981—), 女, 山东潍坊人; 硕士; 助理研究员; 研究方向为水产养殖与池塘生态。E-mail: lxl@yfi.ac.cn
李谷, E-mail: ligu667@yahoo.com
