N-氨甲酰谷氨酸对罗非鱼幼鱼生长、血液氨基酸组成及脂肪沉积的影响
2015-02-27程炜轩张丽许国焕吴清洋熊达郭莹姿谭文俊许
程炜轩张 丽许国焕吴清洋熊 达郭莹姿谭文俊许 迪
(1. 广东省微生物研究所, 广州 510070; 2. 广东省菌种保藏与应用重点实验室, 广州 510070; 3. 广东省微生物应用新技术公共实验室, 广州 510070; 4. 省部共建华南应用微生物国家重点实验室, 广州 510070; 5. 广东碧德生物科技有限公司, 广州 510663)
N-氨甲酰谷氨酸对罗非鱼幼鱼生长、血液氨基酸组成及脂肪沉积的影响
程炜轩1,2,3,4,5张 丽1,5许国焕1,5吴清洋1,5熊 达1,5郭莹姿5谭文俊5许 迪1,5
(1. 广东省微生物研究所, 广州 510070; 2. 广东省菌种保藏与应用重点实验室, 广州 510070; 3. 广东省微生物应用新技术公共实验室, 广州 510070; 4. 省部共建华南应用微生物国家重点实验室, 广州 510070; 5. 广东碧德生物科技有限公司, 广州 510663)
为研究精氨酸对尼罗罗非鱼(Oreochromis niloticus)的生物学效应, 采用精氨酸内源合成途径的必需辅助因子N-氨甲酰谷氨酸(NCG)代替精氨酸, 研究不同剂量包被NCG制剂(实际NCG含量为80%)对尼罗罗非鱼生长及脂肪沉积的影响。实验共设 6个制剂添加组, 分别为 0.025%、0.05%、0.1%、0.2%、0.4%、0.5%及对照组。结果显示, 罗非鱼血液中所有 NCG添加组(0.025%—0.5%)和对照组相比, 赖氨酸、苏氨酸、亮氨酸、异亮氨酸、缬氨酸等必需氨基酸含量无显著性差异(P>0.05), 而当 NCG添加量为 0.4%时, 精氨酸含量显著高于其他各组(P<0.05), 且约为对照组的4倍, 继续提高NCG添加量至0.5%时, 精氨酸含量无显著提高(P>0.05); 所有 NCG添加组的末均重、特定生长率、饲料系数、内脏比和肥满度等指标与对照组相比均无显著性差异(P>0.05), 当 NCG添加量为 0.2%时, 增重率和蛋白质效率均显著高于其他组(P<0.05), 除了0.1%NCG添加组, 其他各组全鱼蛋白质含量均高于对照组; 脂肪沉积方面, 所有NCG添加组均显示肝体比显著低于对照组(P<0.05), 全鱼干物质中脂肪含量显著高于对照组 (P<0.05), 脂肪有从肝转移至肌肉的倾向。饲料中添加0.4%NCG, 对于血液中精氨酸含量的提高有较好的促进作用, 而且不影响其他氨基酸的吸收;饲料中添加 0.025%—0.5% NCG有利于减少肝脏脂肪沉积而增加了肌肉中的脂肪沉积, 研究结果为进一步开展精氨酸影响鱼体脂肪沉积的机理研究提供了科学依据。
精氨酸; N-氨甲酰谷氨酸; 脂肪; 尼罗罗非鱼; 生长指标; 内脏指标; 氨基酸
精氨酸在鱼体中参与蛋白质的合成, 促进内分泌, 并调节机体免疫。鱼类对精氨酸需求量约占饲料蛋白总量的3.3%—6.8%[1], 饲料中缺乏精氨酸时,主要表现为生长速度、饲料转化率及蛋白沉积率下降。而当饲料中精氨酸过量时对生长的影响, 不同的鱼类存在明显的种间差异。饲料中过量的精氨酸对点带石斑鱼(Epinephelus coioiaes)的生长无影响[2],同位数标记显示, 体内多余的精氨酸被用来氧化分解, 提供能量。而过量的精氨酸对黑鲷(Sparus macrocephlus)的生长有显著的抑制作用, 原因是过量的精氨酸抑制赖氨酸等其他氨基酸的吸收[3]。
在陆生动物中, 精氨酸对于动物脂肪也有良好的调节作用, 目前认为主要经过一氧化氮途径[4]。以二型糖尿病模型大鼠(Rattus norvegicus)(zdf大鼠)为研究对象, 连续10周在饮用水中添加1.51%的L-精氨酸, 可使大鼠在采食量、饮水量以及能量摄入量等方面没有明显差别的情况下, 血清中精氨酸和一氧化氮的浓度分别提高61%和70%, 10周以后, 腹部脂肪脂重量减少45%而肾周脂重量减少25%, 但是身体其他部位的重量没有受到显著影响[5]。然而,鱼类脂肪代谢途径与陆生动物差异很大, 哺乳类脂肪分解作用依赖于 cAMP传导, 而鱼类及其他低等脊椎动物(两栖类、爬行类)则并非如此[6,7], 因此,精氨酸对于鱼类脂肪的调节效应可能与陆生动物有所区别。
尼罗罗非鱼(Oreochromis niloticus)肉质鲜美,抢食力强, 生长迅速, 已被多个国家和地区广泛引入, 是联合国推荐养殖的优质水产养殖品种。然而,随着养殖集约化工艺逐步深化, 罗非鱼在养殖过程中频频出现营养性疾病, 其表现为脂肪不正常蓄积,导致罗非鱼的成活率及鱼肉品质下降。使用氨基酸等营养素解决脂肪不正常累积, 是一种新思路, 因而首先要了解精氨酸对鱼类脂肪的效应问题。然而,直接在淡水鱼类饲料中添加晶体精氨酸存在着以下问题: 精氨酸影响动物体对于其他氨基酸如赖氨酸的吸收、精氨酸容易被动物体内精氨酸酶降解、精氨酸易溶于水等[8,9]。提高精氨酸的内源合成, 是解决目前饲料中晶体精氨酸使用问题的有效途径之一。N-氨甲酰谷氨酸(NCG)是N-乙酰谷氨酸(即NAG)类似物, 在动物体内可以像 NAG一样发挥作用参与机体尿素循环。NCG可以有效激活精氨酸合成途径中关键酶氨甲酰磷酸合成酶-1(Carbamoyl phosphate synthase-I, CPS-I), 该酶是精氨酸内源合成途径的必需辅助因子和限制性因素之一[8,9]。NCG相比于直接添加精氨酸, 有成本低, 吸收率高, 在体内代谢稳定等优势。而且生物利用NCG内源合成精氨酸的效率较高, 生成的精氨酸与NCG的比值约为10∶1[9]。开展精氨酸对鱼体生长及脂肪的影响研究,将为后续研究精氨酸对脂肪、生长等生理学相关研究提供科学依据。
1 材料与方法
1.1 饲料制作
将不同浓度(0、250、500、1000、2000、4000 和5000 mg/kg)的缓控释 N-氨甲酰谷氨酸制剂作为饲料添加剂制作饲料(表 1), 饲料原料全部通过 40目筛。饲料均匀混合后, 按饲料和水1∶1.5的比例混合均匀, 通过挤压机, 粉碎成直径2 mm颗粒, 45℃以下快速风干, –20℃冰箱中保存待用。
1.2 饲料中氨基酸成分检测
按照GB/T 18246-2000饲料中氨基酸的测定方法, 将各组制作好的干燥饲料, 分别用研钵磨碎后,称取0.11 g样品, 加入10 mL 6 mol/L盐酸溶液, 充氮气保护后, 110℃水解24h, 加双蒸水定容至50 mL,稀释3倍后, 使用HITACHI L-8900高速氨基酸分析仪测定, 根据样品与标准品吸收峰面积之比, 测定样品中氨基酸含量测定饲料中各氨基酸的含量(表1)。
1.3 饲料成分测定
饲料样品在 105℃烘干至恒重, 根据烘干前后重量变化计算水含量; 采用凯氏定氮法测定样品的总氮含量, 计算粗蛋白含量; 粗脂肪含量采用索氏抽提法; 灰分含量采用高温(550 ℃)灰化法测定(表1)[10]。
1.4 实验鱼及管理
实验鱼购买于广东省罗非鱼良种场(广州市番禺区大稳村), 将购回的实验鱼进行驯化, 用基础饲料定时、定量投喂, 驯化3d, 待鱼不怕人, 并能主动游向喂食者时, 即为驯化成功。
实验鱼分组, 当鱼生长至3 cm左右时, 进行分缸处理。分缸前进行初始体重测定, 以10尾为一组,带水测定体重, 分缸尽量挑选大小相近的鱼进行分缸, 每缸分30尾。其余过大或者过小的鱼在备用缸中不参与实验。
投喂量计算, 按照鱼饱食的 80%量来计算, 饱食量则按照 20min内多次投喂, 鱼不再食额外的食物为基准, 每两周进行一次调整。
设7个组, C为对照组, A1-A6为NCG饲料投喂组, 添加量依次为每kg饲料0.25、0.5、1、2、4、5 g的 NCG, 每个组设 3个重复, 每桶养 30尾, 每天9: 00与16: 00定量投喂, 在室内养殖缸中进行循环水养殖, 养殖缸直径1.5 m, 水深1.0 m, 水温保持在(25—30)℃ ,溶解氧为(5.0—6.0) mg/L, pH 7.0—7.5,氨氮小于0.2 mg/L, 实验持续8周。
于实验开始和结束当天早晨分别空腹称量每桶鱼的总重, 记录每天每组饲料摄食量, 用来计算增重率、特定生长率、饲料系数和蛋白质效率, 从每个桶中随机抽出10尾, 测定体重和体长等指标, 计算肥满度, 计算公式如下:
增重率(Weight gain rate, WGR, %)=[(实验末鱼均重–实验初鱼均重)/实验初鱼均重]×100
特定生长率(Specific growth rate, SGR, %/d)= (Ln实验末鱼均重–Ln实验初鱼均重)/实验天数× 100
饲料系数(Feed coefficient, FCR)=摄取的饲料总重量/(实验末鱼总体重–实验初鱼总体重)
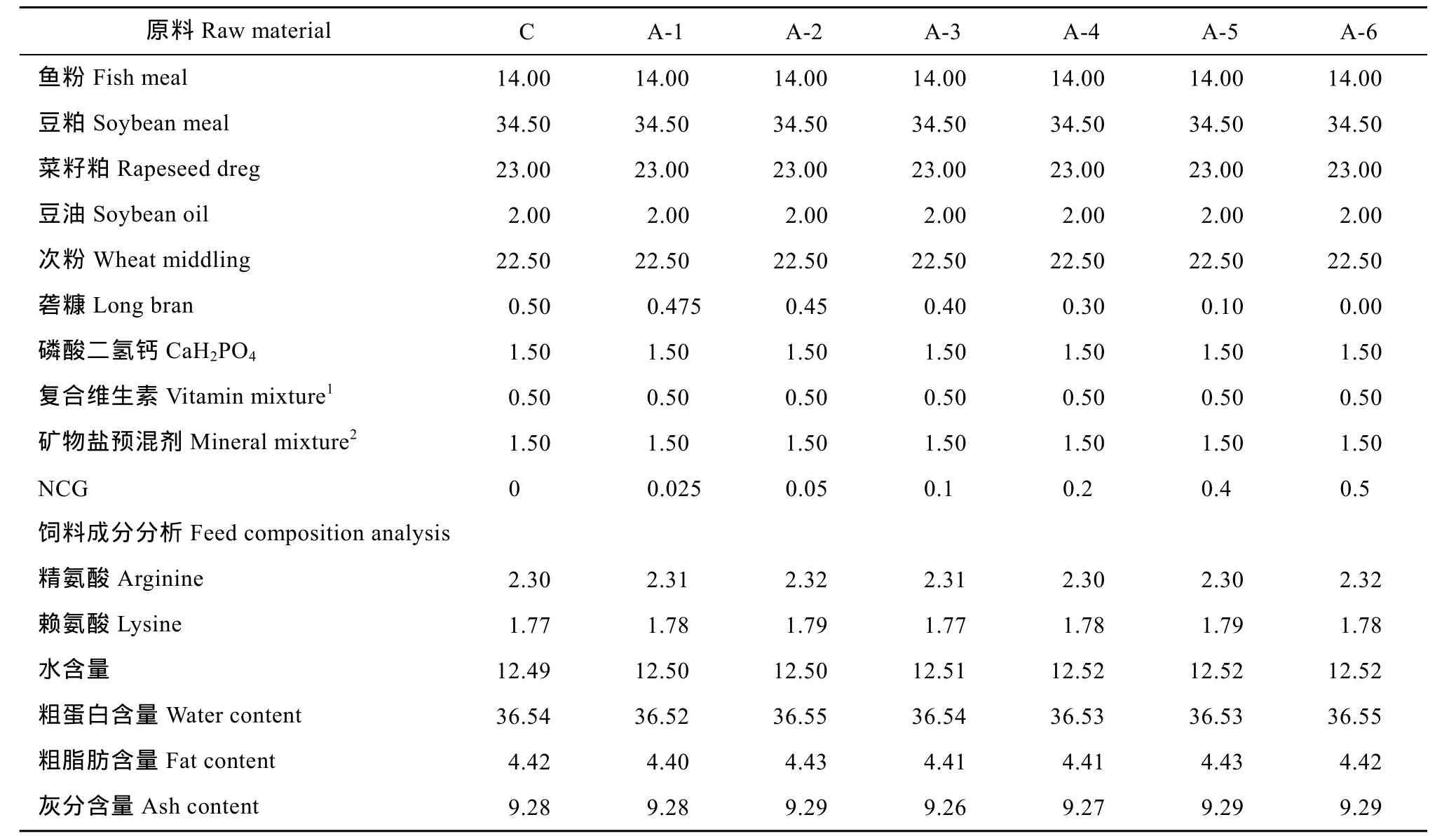
表1 实验饲料配方及成分分析Tab. 1 The formula of the test feed and the component analysis (%)
蛋白质效率(Protein efficiency ratio, PER)=(实验末鱼总体重–实验初鱼总体重)/投喂饲料总量(g)×饲料中的蛋白质质量分数(%);
肥满度(Condition factor, CF, %)=体重(g)/体长(cm)3×100
1.5 鱼体营养成分测定
每组选取 7尾鱼进行鱼体成分分析, 先称取鱼体重量, 75℃充分烘干后, 再称重, 通过鱼体烘干前后重量计算鱼体水分含量, 粗蛋白含量测定同饲料的测定方法。脂肪含量测定采用氯仿-甲醇法测定[11]。
1.6 鱼体血液中游离氨基酸水平测定
实验鱼投喂后 6h, 从尾静脉中抽取血液, 每组鱼取 6尾, 各尾鱼血各自混合均匀后, 两尾鱼血充分混合做成一支混合管, 共3管, 每管取3 mL, 加入 2倍体积无水乙醇充分混合, 4℃以 15000 r/min离心5min, 取上清液 1.2 mL在50℃减压干燥, 用0.02 mol/L盐酸定容, 过0.22 µm微孔滤膜后, 使用安捷伦 1260(德国)氨基酸分析仪进行测定[15], 根据样品与标准品吸收峰面积之比, 测定血液中各氨基酸的含量。
1.7 内脏指标测定
于实验结束当天, 每桶随机取出6尾鱼, 称量体重后, 剪断腮弓放血致死后, 解剖出内脏, 测定内脏、肝脏重量, 计算脏体比以及肝体比, 公式如下:
脏体比(Viscera-somatic index, VSI, %)=内脏重(g)/体重(g)×100;
肝体比(Hepatosomatic index, HSI, %)=肝脏重(g)/体重(g)×100。
1.8 数据统计分析
采用 SPSS 15.0对数据进行统计分析, 组间所有数据均以平均值±标准差(mean±SD)表示, 统计学显著性水平为 P<0.05, 统计学比较方法采用单因素方差分析(ANOVA), S-N-K, Duncan’s进行多重比较,区分显著性差异水平。
2 结果
2.1 生长指标
各组间末均重、特定生长率均无显著性差异,增重率方面, NCG添加组除了A-4组以外, 都与对照组无显著性差异 (P>0.05), 而 A-4组则显著高于除A3组外其他各组, 饲料系数A-2组显著高于其他组(P<0.05), 其他各组差异不显著(P>0.05)。蛋白质效率方面, A-4组最高, 显著高于除A-3、C组外其他各组(P<0.05), A-2组最低, 显著低于除A-5、A-6组外其他各组(P>0.05)。
2.2 内脏指标
各组间内脏比与肥满度均无显著性差异, 肝体比方面, NCG添加组A-1至A-4组均显著低于对照组(P<0.05), A-5、A-6组低于对照组, 但差异不显著(P>0.05)。
2.3 血液中游离氨基酸含量
在血液必需氨基酸中, 精氨酸含量A-5、A-6组约为对照组的 4倍, 且显著高于其他各组(P<0.05),而且苏氨酸、蛋氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨酸也显著高于其他组(P<0.05), 而赖氨酸与对照组无显著性差异(P>0.05), 其他NCG添加组, 赖氨酸、异亮氨酸、缬氨酸都与对照组相近,无显著性差异(P>0.05); A-1、A-3组苯丙氨酸, 显著低于对照组, 其他氨基酸组分与对照组无显著性差异(P>0.05); A-2组, 苏氨酸、蛋氨酸、缬氨酸、亮氨酸、异亮氨酸均显著高于对照组(P<0.05), A-4组,蛋氨酸显著高于对照组, 其他氨基酸与对照组无显著性差异(P>0.05) (表4)。
2.4 蛋白、脂肪占干物质的百分含量
对照组鱼体脂肪占干物质的百分含量均显著低于其他NCG添加组(P<0.05), A-3、A-4组脂肪占干物质的百分含量最高, 且显著高于其他各组(P<0.05), A-5、A-6显著高于A-1、A-2组(P<0.05), A-1与A-2、A-3与A-4、A-5与A-6组间差异不显著(P>0.05)(图1)。
对照组与A-3组鱼体蛋白质占干物质的百分含量均显著低于其他NCG添加组(P<0.05), 对照组与A-3组, A-1、A-2、A-4、A-5、A-6五个组间差异不显著(P>0.05)(图2)。
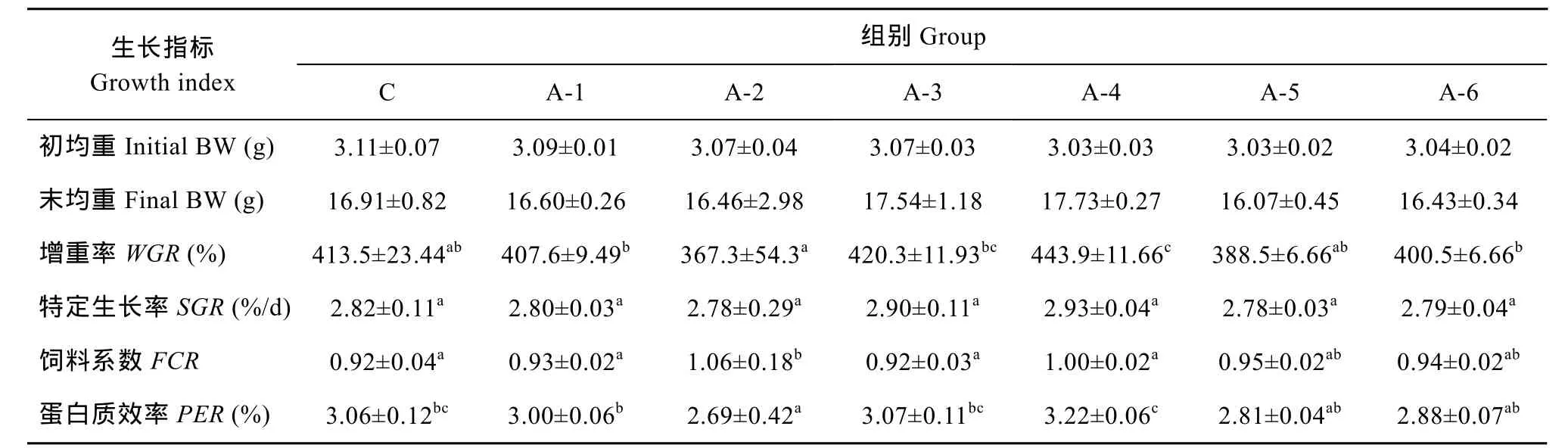
表2 实验饲料对尼罗罗非鱼生长和饲料利用的影响Tab. 2 Effect of trial diets on growth performance and feed utilization of Oreochromis niloticus
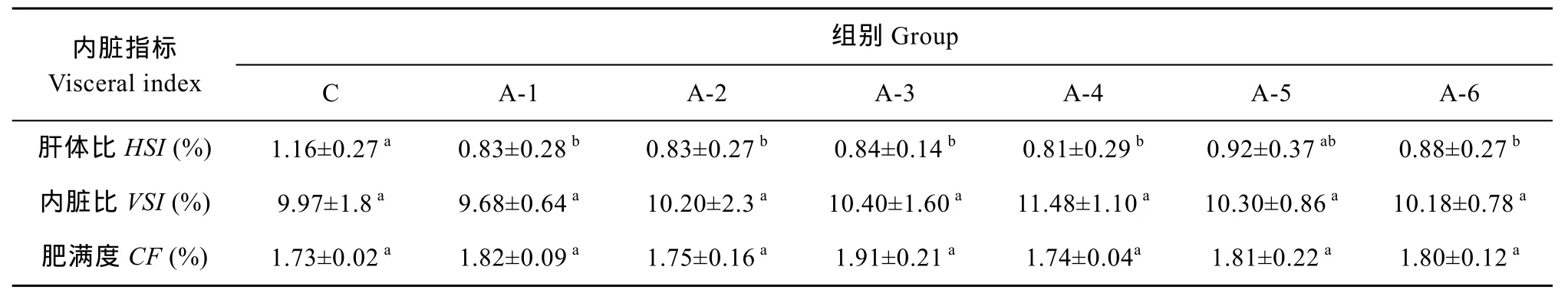
表3 实验饲料对尼罗罗非鱼内脏指标的影响Tab. 3 Effect of trial diets on visceral index of Oreochromis niloticus

表4 血液中各氨基酸组分含量Tab. 4 The levels of different amino acids in the blood
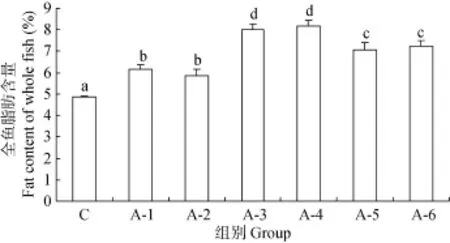
图1 全鱼脂肪含量Fig. 1 The fat content of the whole fish

图2 全鱼蛋白质含量Fig. 2 The protein content of the whole fish
3 讨论
3.1 NCG对尼罗罗非鱼血液中各组分氨基酸的影响
精氨酸在水产中的应用研究受到多种限制。首先, 晶体精氨酸易吸潮、易溶于水, 因此储存困难;然后, 在水生动物中存在精氨酸-赖氨酸拮抗, 会产生对其他必需氨基酸, 如赖氨酸的吸收障碍; 再者,精氨酸本身易被肠道内的精氨酸酶水解。但是, 多种硬骨鱼体内(主要为肝脏)具有氨基甲酰磷酸合成酶(Carbarnoyl-phosphate synthase, CPS)和鸟氨酸氨基甲酰转移酶(Ornithine carbamoyhransferase, OCT)等合成精氨酸关键酶的活性, 具有一定精氨酸合成能力[3]。而N-氨甲酰谷氨酸(NCG)是N-乙酰谷氨酸(即 NAG)类似物, 可以有效激活精氨酸合成途径中关键酶CPS-I, 从而促进内源精氨酸合成。从各组血液中氨基酸含量来看, 添加量为 0.4%, 精氨酸浓度约为对照组的4倍, 继续提高NCG添加量至0.5%,精氨酸浓度不再升高。可见, 尼罗罗非鱼具有一定的精氨酸内源合成能力, NCG能促进精氨酸内源合成, 其规律是达到 0.2%—0.4%添加量后, 提高精氨酸内源合成, 到达最大值以后, 继续添加NCG则不能继续促进精氨酸内源合成。
鱼类存在赖氨酸-精氨酸拮抗作用, 当饲料中精氨酸过量时, 会影响赖氨酸吸收, 同样, 赖氨酸过量也会影响精氨酸吸收[13,14]。而本实验结果显示, NCG添加量从 0.025%—0.5%, 血液中赖氨酸无显著性下降, 结果显示, 对于尼罗罗非鱼, NCG促进精氨酸的内源合成过程中不影响其他氨基酸的吸收。而且添加量在0.4%—0.5%时, 血液中必需氨基酸苏氨酸、蛋氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸、苯丙氨酸含量也显著提高。
3.2 NCG对尼罗罗非鱼生长的影响
精氨酸具有广泛的生物学功能, 在体内主要参与蛋白质的合成、尿素循环、肌酸(Creatine)、多胺(Polyamines)及一氧化氮(Nitric oxide, NO)的合成。饲料中缺乏精氨酸, 会导致养殖鱼类蛋白合成下降,导致蛋白沉积及体蛋白含量下降[15]。而添加过多的精氨酸, 又会造成赖氨酸等必需氨基酸的吸收障碍,对于尼罗罗非鱼幼鱼, 目前认为饲料中合适的精氨酸与赖氨酸比例约为 1.3∶1, 过高或过低的比值都影响鱼的生长[16]。
在本实验饲料基础配方中, 精氨酸含量为2.3%,赖氨酸含量为1.78%, 蛋白含量为36.5%, 能满足罗非鱼对精氨酸的需求量, 而且精氨酸与赖氨酸比例较为合适。而在饲料中添加0.4%—0.5%NCG时, 罗非鱼血液中精氨酸含量上升, 但未对末均重、特定生长率、饲料系数、内脏比和肥满度等指标造成显著性差异; 增重率方面, A-4组显著高于对照组; 而A-2组蛋白质效率最低, 饲料系数最高。结果显示,对于罗非鱼, 内源合成精氨酸与外源吸收的精氨酸存在差别, 而内源合成过多的精氨酸对表观的生长指标影响不大, 这与点带石斑鱼的研究结果相近[1],过量的精氨酸可能被分解, 用来提供能量[1]。而当NCG添加量为0.2%时, 增重率、蛋白质效率均显著高于其他组, 显示适量添加 NCG, 也可促进罗非鱼蛋白合成。
3.3 NCG对尼罗罗非鱼脂肪沉积的影响
在陆生动物中, 精氨酸在动物体内的一氧化氮合成酶作用下产生一氧化氮, 可有效调节动物的脂肪代谢, 主要体现以下几个方面: (1)刺激AMPK的磷酸化, 抑制乙酰CoA羧化酶的活性, 激活丙二酰CoA脱羧酶的活性而降低丙二酰CoA的含量, 并且降低脂肪与糖原合成相关基因的表达; (2)增加激素敏感脂酶的磷酸化, 从而激活脂肪降解; (3)激活PPARγ共激活子α1的表达, 从而增加了线粒体的氧化磷酸化; (4)增加了胰岛素敏感组织的血流, 从而增加了底物代谢[4,5]。一氧化氮途径解释罗非鱼肝脏脂肪沉积效果, 是较为合理的。因为罗非鱼肝脏也出现脂肪沉积减少的现象, 其结果与家猪(Susscrofa domestica)、绿头鸭(Anas Platyrhynchos Linnaeus)的研究结果相近[17,18]。但是, 如果单用该途径解释肌肉的脂肪沉积增加的现象则有矛盾的地方。因为随着NCG添加量的增加, A-5和A-6组(0.4%和0.5%添加组)出现显著降低。但是全鱼体脂肪含量的沉积, A-3组和A-4组(0.1%和0.2%)就达到最大。
最近的研究发现, 大西洋鲑(Salmo salar)中存在另外一种途径, 多胺途径。在饲料中添加(28.8—37.4) g/kg体重的精氨酸, 可以上调大西洋鲑肝脏中产生多胺的关键酶, 鸟氨酸脱羧酶(ornithine decarboxylase, ODC)以及多胺调节脂肪合成与分解的酶亚精胺/精胺-N1-乙酰基转移酶以及肉碱棕榈酰转移酶-1的mRNA表达[19], 而这条途径与动物肌肉中脂肪含量增加有关, 尼罗罗非鱼肌肉脂肪沉积增加的现象可能也与该途径有关。结果显示, 精氨酸对罗非鱼脂肪代谢的调控不是单一途径调控造成的,有可能是两条或以上调节途径共同协同完成。
综上所述, 由于晶体精氨酸本身的性质及生物的利用规律, 在水生动物中研究精氨酸的生物学功能存在一定的困难, 本研究提供了研究鱼类精氨酸生物学功能的另一种途径, 利用内源合成精氨酸代替外源吸收精氨酸, 对于尼罗罗非鱼, 内源合成精氨酸对血液中其他氨基酸浓度影响较小, 而且不影响罗非鱼的生长。而精氨酸对于尼罗罗非鱼, 有减少肝脂肪沉积, 提高全鱼脂肪沉积的效果。目前, 关于精氨酸调节脂肪的途径, 陆生动物与鱼类存在一定的差异, 而主要的调节途径不是单一途径调控造成的, 有可能是两条或以上调节途径共同协同完成,而其调控途径仍需要进一步的实验验证。
[1] Luo Z, Liu Y J, Mai K S, et al. Effects of dietary arginine levels on growth performance and body composition of juvenile grouper Epinephelus coioides [J]. Journal of Applied Ichthyology, 2007, 23(2): 252—257
[2] Fan Z, Wen X, Xiao J X, et al. Optimum arginine requirement of juvenile black sea bream, Sparus macrocephalus [J]. Aquaculture Research, 2010, 41(10): 418—430
[3] Fan Z, Shao Q J, Xiao J X, et al. Effects of dietary arginine and lysine levels on growth performance, nutrient utilization and tissue biochemical profile of black sea bream, Acanthopagrus schlegelii, fingerlings [J]. Aquaculture, 2011, 319(1—2): 72—80
[4] Jobgen W S, Fried S K, Fu W J, et al. Regulatory role for the arginine-nitric oxide pathway in metabolism of energy substrates [J]. Journal of Nutritional Biochemistry, 2006, 17(9): 571—588
[5] Fu W J, Haynes T E, Kohli R, et al. Dietary L-arginine supplementation reduces fat mass in Zucker diabetic fatty rats [J]. Journal of Nutrition, 2005, 135(4): 714—721
[6] Brasaemle D L. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis [J]. Journal of Lipid Research, 2007, 48(2): 2547–2559
[7] Carol B, Christophe M R L, Paul M, et al. Nitrogen metabolism of the intestine during digestion in a teleost fish, the plainfin midshipman (Porichthys notatus) [J]. The Journal of Experimental Biology, 2013, 216(2): 2821—2832
[8] Tuchman M, Caldovic M, Daikhin Y, et al. N-Carbamyl glutamate markedly enhances ureagenesis in N-acetylglutamate deficiency and propionic acidemia as measured by isotopic incorporation and blood biomarkers [J]. Pediatr Research, 2008, 64(2): 213—217
[9] Wu X, Yin Y L, Liu Y Q, et al. Effect of dietary arginine and N-carbamoylglutamate supplementation on reproduction and gene expression of eNOS, VEGFA and PlGF1 in placenta in late pregnancy of sows [J]. Animal Reproduction Science, 2012, 132(3—4): 187—192
[10] Arlington. Official Methods of Analysis of Official Analytical Chemists International [M]. In: Association of Official Analytical Chemists (AOAC) (16th eds), Association of Official Analytical Chemists. 1995, 27—34
[11] Chen J M, Shen B Q, Pan Q, et al. Effects of dietary protein and lipid on growth performance and body composition of advanced fingerling black carp (Mylopharyngodon piceus) [J]. Acta Hydrobiologica Sinica, 2014, 38(4): 699—705 [陈建明, 沈斌乾, 潘茜, 等. 饲料蛋白和脂肪水平对青鱼大规格鱼种生长和体组成的影响. 水生生物学报, 2014, 38(4): 699—705]
[12] Jiang H, Wang H Q, Sun L, et al. Detecting free amino acids in functional drinks by AAA [J]. Chinese Journal of Health Laboratory Technology, 2010, 20(4): 763—764 [姜荷. 王红青. 孙岚, 等. 氨基酸分析仪测定功能性饮料中游离氨基酸. 中国卫生检验杂志, 2010, 20(4): 763—764]
[13] Berge G E, Lied E, Sveier H. Nutrition of Atlantic salmon (Salmo salar): the requirement and metabolism of arginine [J]. Comparative Biochemisrty and Physiology, 1997, 117(4): 501—509
[14] Berge G E, Sveier H, Lied E. Nutrition of Atlantic salmon (Salmo salar): the requirement and metabolic effect of lysine [J]. Comparative Biochemistry and Physiolology, 1998, 120(3): 447—485
[15] Alam S, Teshima S I, Koshio S, et al. Arginine requirement of juvenile Japanese flounder Paralichthys Olivaceus estimated by growth and biochemical parameters [J].Aquaculture, 2002, 205(1—2): 127—140
[16] Furuya W M, Graciano T S, Vidal L V O, et al. Digestible lysine requirement of Nile tilapia fingerlings fed arginine-tolysine-balanced diets [J]. Revista Brasileira de Zootecnia, 2012, 41(3): 485—490
[17] Tan B, Yin Y L, Liu Z Q, et al. Dietary L-arginine supplementation increases muscle gain and reduces body fat mass in growing-finishing pigs [J]. Amino Acids, 2009, 37(3): 169–175
[18] Wu L Y, Fang Y J, Guo X Y. Dietary L-arginine supplementation beneficially regulates body fat deposition of meat-type ducks [J]. British Poultry Science, 2011, 52(2): 221—226
[19] Synne M A, Elisabeth H, Anders A, et al. Dietary arginine affects energy metabolism through polyamine turnover in juvenile Atlantic salmon (Salmo salar) [J]. The British Journal of Nutriton, 2013, 110(11): 1968—1977
EFFECTS OF ARGININE ON THE REGULATION OF THE GROWTH, THE BLOOD AMINO ACID COMPOSITION AND THE FAT DEPOSITION IN NILE TILAPIA (OREOCHROMIS NILOTICUS)
CHENG Wei-Xuan1,2,3,4,5, ZHANG Li1,5, XU Guo-Huan1,5, WU Qing-Yang1,5, XIONG Da1,5, GUO Ying-Zi5, TAN Wen-Juan5and XU Di1,5
(1. Guangdong Institute of Microbiology, Guangzhou 510070, China; 2. State Key Laboratory of Applied Microbiology, South China, Guangzhou 510070, China; 3. Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application, Guangzhou 510070, China; 4. Guangdong Open Laboratory of Applied Microbiology, Guangzhou 510070, China; 5. Bide Biotechnology Co., Ltd. of Guangdong, Guangzhou 510663, China)
The direct addition of arginine into diets causes malabsorption of other amino acids in farmed fish. To study the biological effects of arginine in Nile tilapia, we replaced arginine with N-Carbamylglutamate (NCG), an essential cofactor glutamate in the endogenous arginine synthesis pathway. We examined the effects of NCG (actual content of 80%) in different doses (0.025%, 0.05%, 0.1 %, 0.2 %, 0.4 % and 0.5%) on the concentration of amino acids in the blood, the growth, and the fat deposition in Nile tilapia. The results showed that there was no significant difference between the control group and the NCG-containing groups in the levels of lysine, threonine, leucine, valine and isoleucine in the blood. The blood arginine level increased significantly in the fish fed with 0.4% NCG, which was four times as the control group, but there was no difference in the fish fed with 0.5% NGG compared to the control (P>0.05). In terms of the final weight gain rate, the specific growth rate, the feed coefficient rate, the viscera-somatic index and the condition factor, there were no differences between the NCG groups and the control group (P>0.05). The weight gain and the protein efficiency ratio were significantly elevated in the fish fed with 0.2% NCG (P<0.05). The whole fish protein content of all NCG groups, except for the group of 0.1% NCG addition, was significantly higher than that of the control group (P<0.05). The hepatosomatic index of all NCG groups was significantly lower than that of the control group (P<0.05), and the whole fish fat content of the NCG groups was higher than that of the control group, except for the group of 0.1% NCG addition, which implied the transfer of fats from the liver to the muscles. The diet containing 0.4% NCG effectively improved the arginine level in the blood but did not affect the absorption of other amino acids. The diet with 0.025%—0.5% NCG reduced the liver fat deposition and increased the muscle fat deposition. Our results should provide important information for future studies on the effects of arginine on fish fat deposition.
Arginine; N-Carbamylglutamate; Fat; Nile tilapia; Growth index; Visceral index; Amino acids
S917
A
1000-3207(2015)03-0490-08
10.7541/2015.65
2014-03-20;
2014-11-26
广东省中国科学院全面战略合作项目(2012B091100259)资助
程炜轩(1981—), 男, 广东中山人; 博士; 主要从事水生动物生理生态研究。E-mail: chan714@126.com
许国焕(1963—), 男, 硕士, 研究员; 主要从事水生动物营养学。E-mail: xghfish@163.com
