罗氟司特类似物的合成及抑酶活性
2015-02-27李红妍王国成刘文峥
李红妍,王国成,杨 慧,刘文峥
(1.内蒙古医科大学研究生学院,呼和浩特 010110; 2. 天士力控股集团研究院化学药物研究所,天津 300400)
7a:R,R,R,R=H,R=F,X=C 7b:R,R,R=H,R,R=F,X=C 7c:R,R,R,R=H,R=F,X=C7 d:R,R=F,R,R,R=H,X=C 7 e:R=CI,R,R,R=H,R=F,X=C 7 f:R,R,R=H,R,R=F,X=C7 g:R,R,R=H,R=CI,R=F,X=C 7 h:R,R,R=H,R=CF,R=F,X=C 7 I:R,R,R,R=F,X=N
实验研究
罗氟司特类似物的合成及抑酶活性
李红妍1,王国成2,杨 慧1,刘文峥2
(1.内蒙古医科大学研究生学院,呼和浩特 010110; 2. 天士力控股集团研究院化学药物研究所,天津 300400)
目的:为了寻找活性更好的磷酸二酯酶Ⅳ(PDE Ⅳ)抑制剂,对罗氟司特进行结构改造。方法:保留环丙基甲氧基和二氟甲氧基的结构,以2-氨基-5-硝基苯酚(1)为起始原料,制备关键中间体3-环丙基甲氧基-4-二氟甲氧基苯胺(4),设计合成一系列新型罗氟司特类似物。通过1H NMR、MS对化合物进行表征,并对合成的目标化合物进行了初步的抑酶活性测试。结果:9种目标化和物质谱均发现分子离子峰,目标化合物7i和7e的IC50小于1.5,显示出了一定的抑酶活性。结论:为进一步为探索新型PDE Ⅳ抑制剂提供了一定的理论依据。
磷酸二酯酶Ⅳ,罗氟司特,抑酶活性
罗氟司特(roflumilast),化学名为3-环丙基甲氧基-N-(3, 5-二氯吡啶-4-基)-4-(二氟甲氧基)苯甲酰胺(结构见图1),于1993年由Altana Pharma公司研发。欧盟已于2010年7月批准Nycomed公司,首次在德国上市,用于治疗慢性阻塞性肺病(COPD),美国FDA 于2011 年2 月28 日批准上市,该药是一种选择性PDE IV抑制剂,在哮喘和COPD的临床治疗中显示了不凡的功效,因此有人预言其将取代类皮质甾体和β2肾上腺素受体激动剂,成为新一代抗炎药物[1-3]。

图1 罗氟司特的结构
1 合成路线
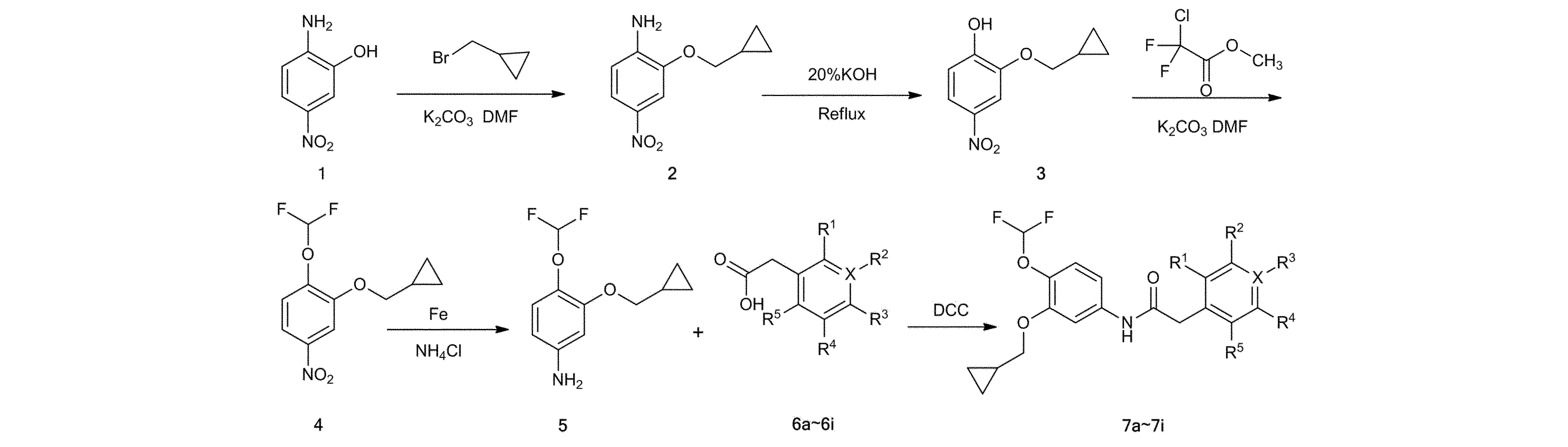
本研究对罗氟司特结构进行改造,首先合成中间体3-环丙基甲氧基-4-二氟甲氧基苯胺(4),共四步反应。以2-氨基-5-硝基苯酚(1)为起始原料与环丙基溴甲烷反应得到2-环丙基甲氧基-4-硝基苯胺(2),再用20% KOH溶液加热回流,将氨基变成羟基,得到2-环丙基甲氧基-4-硝基苯酚(3),3与1-氯-1, 1-二氟乙酸甲酯在N,N-二甲基甲酰胺(DMF)中反应得到2-环丙基甲氧基-1, 1-二氟甲氧基-4-硝基苯(4),最终4经过硝基还原成氨基得到5。罗氟司特类似物的合成,使用了9种不同的原料(6a-6i)与5反应得到终产物7a-7i[4]。合成路线见图2。
2 方法和结果
2.1 合成实验
2.1.1 仪器与试剂 YRT-3型药物熔点仪(天津天大天发科技有限公司)。Bruker AV 400 型核磁共振仪,以CDCl3或DMSO-d6为溶剂,TMS为内标。MS:采用Agilent 1100 LC-MSD-Trap-SL质谱仪。柱层析采用柱层析硅胶(200~300目)(青岛海洋化工厂)。所用试剂均为市售分析纯。
7a:R,R,R,R=H,R=F,X=C 7b:R,R,R=H,R,R=F,X=C 7c:R,R,R,R=H,R=F,X=C
7 d:R,R=F,R,R,R=H,X=C 7 e:R=CI,R,R,R=H,R=F,X=C 7 f:R,R,R=H,R,R=F,X=C
7 g:R,R,R=H,R=CI,R=F,X=C 7 h:R,R,R=H,R=CF,R=F,X=C 7 I:R,R,R,R=F,X=N
图2 目标化合物7a-7i合成路线
2.1.2 合成
2.1.2.1 2-环丙基甲氧基-4-硝基苯胺(2) 将2-氨基-5-硝基苯酚(1)18 g (0.12 mol)、碳酸钾21.6 g (0.156 mol)和N,N-二甲基甲酰胺150 ml加入反应瓶中。氮气保护下,搅拌加热至55 ℃。滴加环丙基溴甲烷14.0 ml (110 mmol)DMF溶液。TLC(展开剂:石油醚-乙酸乙酯=3∶2)监测反应进程。反应毕,将反应液冷却至室温,倒入250 ml冰水中,乙酸乙酯(130 ml×3次)萃取,合并有机层,饱和氯化钠溶液(60 ml×3次)洗涤,有机层无水Na2SO4干燥,过滤,浓缩。粗产品柱层析(洗脱剂:石油醚-乙酸乙酯=3∶2)分离纯化,得纯品约20.78 g,橙黄色结晶,产率85%。
2.1.2.2 2-环丙基甲氧基-4-硝基苯酚(3) 将(2) 15 g (0.072 mol)和20% KOH溶液250 ml加入反应瓶中,加热回流,TLC监测反应进程(展开剂:石油醚-乙酸乙酯=1∶1)。反应毕,冷却至室温,用稀硫酸将滤液的pH调至4~5,待有固体析出,过滤,干燥,得乳白色粉末14 g,产率92%。
2.1.2.3 2-环丙基甲氧基-1,1-二氟甲氧基-4-硝基苯(4) 将(3) 11.10 g (53 mmol)、碳酸钾25.7 g (10.186 mol)和DMF 200 ml加入反应瓶中,搅拌,加热至75 ℃,滴加1-氯-1,1-二氟乙酸甲酯9.66 ml (0.093 mol)的DMF溶液。TLC监测反应进程(展开剂:石油醚-乙酸乙酯=1∶2),反应毕,过滤,乙酸乙酯(150 ml×3次)萃取,饱和氯化钠溶液(50 ml×3次)洗涤,无水MgSO4干燥,浓缩。粗产品柱层析(洗脱剂:石油醚-乙酸乙酯=10∶1)分离纯化,得浅黄色粉末11.78 g,产率78%。
2.1.2.4 3-环丙基甲氧基-4-二氟甲氧基苯胺(5) 将铁粉6.5 g(0.12 mol)和NH4Cl 0.4 mol/L, 250 ml溶液加入反应瓶中,搅拌,加热至70 ℃。滴加(4) 10 g (0.39 mol)的乙醇溶液,加热,回流。TLC监测反应进程(展开剂:石油醚-乙酸乙酯=1∶1),反应完全后,滤去反应液中的不溶固体,乙酸乙酯(150 ml×3次)萃取滤液,饱和氯化钠溶液洗涤,无水Na2SO4干燥,浓缩。粗产品柱层析(洗脱剂:石油醚-乙酸乙酯=10∶1)分离纯化,得棕色油状物8 g,产率90%。
2.1.2.5 目标化合物7a的合成 将邻氟苯乙酸200 mg(1.29 mmol)、二环己基碳二亚胺(DCC)500 mg及10 ml二氯甲烷加入反应瓶中,搅拌。2 h后,加入(5) 274 mg(1.29 mmol)和50 mg的4-二甲氨基吡啶(DMAP)。反应毕,过滤,浓缩,柱层析(洗脱剂:石油醚-乙酸乙酯=7∶2)分离纯化,得纯品白色粉末约395 mg,产率为85%。7b-7i的合成过程与7a类似,只是将邻氟苯乙酸取代基进行不同的变换。
2.1.3 目标化合物7a-7i的合成结果
①N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]-2-(2-氟苯基)乙酰胺(7a): 白色粉,产率85%,mp 116.7~117.6 ℃;1H NMR (400 MHz,CDCl3) δ: 7.56 (d,J=2.4 Hz, 1H), 7.34 (td,J=10.6, 7.1, 4.6 Hz, 3H), 7.28 (, 1H), 7.22~7.11 (m, 2H), 7.07 (d,J=8.6 Hz, 1H), 6.68 (dd,J=8.6, 2.4 Hz, 1H), 5.31 (, 1H), 3.88 (d,J=7.0 Hz, 2H), 3.75 (, 2H), 1.6 (d,J=12.0 Hz, 1H), 1.37~1.19 (m, 1H), 0.7~0.56 (m, 1H), 0.41~0.27 (m, 1H); MS m/z (%): 388.1 [M+Na]+, 400.5 [M+Cl]-。
②N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]-2-(2, 5-二氟苯基)乙酰胺 (7b): 白色粉末,产率87%,mp 85.5~85.8 ℃;1H NMR (400 MHz, DMSO-d6) δ: 10.29 (, 1H), 7.53 (d,J=2.2 Hz, 1H), 7.29~7.20 (m, 2H), 7.19~7.12 (m, 1H), 7.11 (d,J=8.7 Hz, 1H), 7.06 (dd,J=8.7,2.2 Hz, 1H), 3.82 (d,J=6.9 Hz, 2H), 3.74 (, 2H), 1.23 (ddd,J=9.2, 3.9, 2.3 Hz, 1H), 0.56 (dd,J=8.1, 1.8 Hz, 2H), 0.34 (dd,J=4.7, 1.5 Hz, 2H); MS m/z (%): 382.0 [M-H]-, 418.0 [M+Cl]+。
③N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]-2-(3-氟苯基)乙酰胺(7c): 白色粉末,产率90%,mp 92.5~94.0 ℃;1H NMR (400 MHz, CDCl3) δ: 7.53 (d,J=2.2 Hz, 1H), 7.36 (dd,J=14.6, 7.6 Hz, 1H), 7.19 (, 1H), 7.10 (d,J=7.7 Hz, 1H), 7.04 (t,J=8.3 Hz, 3H), 6.64 (dd,J=8.6, 2.3 Hz, 1H), 3.84 (d,J=6.9 Hz, 2H), 3.70 (, 2H), 1.27 (d,J=8.5 Hz, 1H), 0.62 (q,J=5.8 Hz, 2H), 0.32 (q,J=4.9 Hz, 2H); MS m/z (%) 388.1 [M-Na]+, 400.4 [M+H]+。
④N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]-2-(2, 6-二氟苯基)乙酰胺(7d): 白色粉末,产率92%,mp 104.0~105.3 ℃;1H NMR (400 MHz, CDCl3) δ: 9.81 (, 1H), 7.71 (t,J=6.7 Hz, 1H), 7.25 (dt,J=15.2, 7.6 Hz, 1H), 7.07~7.00 (m, 1H), 6.96~6.86 (m, 3H), 6.80~6.35 (m, 1H), 3.83 (t,J=5.8 Hz, 2H),3.78 (, 2H), 1.32~1.21 (m, 1H), 0.68~0.53 (m, 2H), 0.38~0.26 (m, 2H), MS m/z (%): 406.1 [M+Na]+, 419.9 [M+Cl]-。
⑤2-(2-氯-6-氟苯基)-N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]乙酰胺(7e): 白色粉末, 产率91%, mp130.9~131.9 ℃;1H NMR (400 MHz, CDCl3) δ: 7.62 (d,J=2.1 Hz, 1H), 7.43 (, 1H), 7.30~7.21 (m, 2H), 7.12~7.04 (m, 2H), 6.67 (dd,J=8.6, 2.2 Hz, 1H), 4.33 (t,J=6.7 Hz, 1H), 3.92 (d,J=1.3 Hz, 2H), 3.85 (d,J=6.9 Hz, 2H), 0.99 (d,J=14.7, 7.2 Hz, 1H), 0.63 (q,J=5.8 Hz, 2H), 0.33 (q,J=4.9 Hz, 2H); MS m/z(%): 433.9 [M+Cl]-。
⑥N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]-2-(2, 4-二氟苯基)乙酰胺(7f): 白色粉末, 产率89%, mp 127.4~128.9 ℃;1H NMR (400 MHz, DMSO-d6) δ: 9.09 (, 1H), 8.49 (d,J=1.8 Hz, 1H), 7.40 (d,J=2.4 Hz, 1H), 7.12~6.99 (m, 2H), 6.87 (dd,J=8.7, 2.4 Hz, 1H),3.85(t,J=8.8 Hz, 2H), 3.34 (, 2H), 2.51 (dt,J=3.6, 1.8 Hz, 2H), 1.28~1.19 (m, 1H), 0.62~0.51 (m, 2H), 0.40~0.31 (m, 2H); MS m/z (%): 406.2 [M+Na]+,384.2 [M+H]+。
⑦2-(3-氯-2-氟苯基)-N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]乙酰胺(7g): 白色粉末,产率94%, mp 108.3~109.8 ℃;1H NMR (400 MHz,DMSO-d6) δ: 10.33 (, 1H), 7.59~7.44 (m, 2H), 7.37 (dd,J=10.4, 3.9 Hz, 1H), 7.10 (, 1H), 7.08 (dt,J=8.7, 5.4 Hz, 2H), 6.98 (, 1H), 3.86~3.76 (m, 4H), 1.27~1.18 (m, 1H), 0.59~0.51 (m, 2H), 0.38~0.30 (m, 2H); MS m/z (%): 400.1[M+H]+, 398.0[M-H]-。
⑧N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]-2-[2-氟-5-(三氟甲基)苯基]乙酰胺(7h): 白色粉末,产率90%, mp 140.2~140.9 ℃;1H NMR (400 MHz, DMSO-d6) δ: 10.35 (, 1H), 7.84 (dd,J=6.6, 2.0 Hz, 1H), 7.78~7.70 (m, 1H), 7.53 (d,J=2.2 Hz, 1H), 7.44 (t,J=9.0 Hz, 1H), 7.12~7.03 (m, 2H), 6.98 (, 1H), 3.33 (, 4H), 1.30~1.15 (m, 1H), 0.60~0.50 (m, 2H), 0.36~0.28 (m, 2H); MS m/z (%): 434.2 [M+H]+, 456.2 [M+Na]+。
⑨N-[3-(环丙基甲氧基)-4-(二氟甲氧基)苯基]-2-(四氟吡啶-4-基)乙酰胺(7i): 白色粉末,产率95%, mp 132.1~133.3 ℃;1H NMR (400 MHz, DMSO-d6) δ: 10.52 (, 1H), 7.48 (d,J=2.3 Hz, 1H), 7.13 (d,J=8.6 Hz, 1H), 7.04 (dd,J=8.7, 2.3 Hz, 1H), 4.04 (d,J=12.0 Hz, 2H), 3.83 (t,J=10.2 Hz, 2H), 1.31~1.16 (m, 1H), 0.62~0.51 (m, 2H), 0.42~0.27 (m, 2H); MS m/z (%): 418.9 [M-H]-, 454.9 [M+Cl]-。
2.2 抑酶活性测试
2.2.1 实验板的准备 将最终得到的抑制剂用DMSO稀释100倍,在96孔板中加入稀释后溶液100 μl,连续稀释化合物溶液到10个浓度梯度,记为A1~A10,并在该板中向两个空板加入只有DMSO的溶液100 μl,记为A11~A12。从该96孔板中分别吸取5 μl溶液到一个新的96空板并向其分别加缓冲液95 μl,振摇混合均匀,作为媒介板记为B1~B12。从媒介板B1分别转移5 μl到384孔板的C1、C2,B2转移到384孔板的C3、C4,以此类推,得到最终的实验板。
2.2.2 底物与PDE酶的准备 用缓冲液将酶稀释2.5倍,分别向实验板中加入4 μl(空白组只有DMSO,对照组只有酶控制不加化合物),充分振摇。同理底物也用缓冲液稀释2.5倍,分别向实验板加4 μl,充分振摇。盖住实验板室温下培育60 min[5,6]。
2.2.3 反应检测 制备抗体荧光标记溶液,分别向每个实验板中加入5 μl并培育60 min。在仪器上可以看到结果。从仪器上将RFU(相对荧光单位)曲线复制下来,将RFU曲线转变成百分浓度抑制曲线。按公式计算百分浓度抑制率:百分浓度抑制率=(样品的RFU-最小值)/(最大值-最小值),“最小值”表示没有酶控制组的RFU值,“最大值”表示空白组的RFU值。根据化合物浓度与相应抑制率用MicroSoft excel制作散点图,添加趋势线,计算斜率求出IC50值。
2.2.4 抑酶活性测试结果 对合成出来的9种化合物进行了抑酶活性测试,采用荧光标记抗体方法,测定各个实验组化合物的相对荧光单位,并转化成百分浓度抑制率,利用MicroSoft excel 计算出IC50值,见表1。从表1可以看出,7a、7c、7g的IC50值均大于10 nmol/L, 7i和7e的IC50值均小于1.5 nmol/L。

表1 目标化合物的IC50值
3 讨论
通过多步反应合成了一系列新型罗氟司特类似物物。罗氟司特的合成有6条途径,其中通过关键中间体3-环丙基甲氧基-4-二氟甲氧基苯甲酸制备罗氟司特有三条途径,本试验合成的类似物将制备关键中间体的起始原料用3-硝基-4-羟基苯甲酸甲酯替换为2-氨基-5-硝基苯酚(1),经4步反应得到3-环丙基甲氧基-4-二氟甲氧基苯胺(5),(5)分别与6a~6i反应得到目标化合物。
合成的9种化合物初步的抑酶活性测试结果表明,目标化合物7i和7e具有一定的抑酶活性,为探索新型PDE Ⅳ抑制剂提供了一定的理论依据。
1 Kodimuthali A,Jabaris L,Pal M.Recent advances on phosphodiesterase 4 inhibitors for the treatment of asthma and chronic obstructive pulmonary disease[J]. J Med Chem,2008,51(18):5471-5489
2 冯桂山,宋宁,段争,等.罗氟司特治疗慢性阻塞性肺疾病药理作用的临床前研究现状[J].临床荟萃,2011,26(4):363-366
3 Wunder F,Quednau R,Geerts A,etal.Characterization of the cellular activity of PDE 4 inhibitors using two novel PDE 4 reporter cell lines[J].Molecular Pharmaceutics,2013,10(10):3687-3705
4 杨展雄,孙焕亮,蔡开明.罗氟司特的合成路线图解[J].华西药学杂志,2014,29(2):222-223
5 Soto F J,Hanania N. A selective phosphodicsterase-4 inhibitors in chronic obstructive lung disease[J].Curr in Pulm Med,2005,11(2):129-134
6 Lipworth B J.Phosphodiesterase-4 inhibitors for asthma and chronic obstructive pulmonary disease[J].Lancet,2005,365(9454):167-175
《天津药学》杂志投稿规范
1.文稿引用他人观点、数据或材料等文献时,需在文稿中相对应位置的右上方,按先后顺序在方括号标出序号,同时按要求在文未列出。参考文献只著录最必要、最新、公开发表、作者亲自阅读的文献,内部资料和大家熟悉的陈旧资料不必罗列,本刊参考文献格式要求如下:
期刊:作者.文题[J].期刊名,出版年,卷(期):起-止页
注意:3名以内的需全部列出,超过3名的只列前3名后加“等”或“etal”,作者之间用“,”号分隔。
例1 秦永平,黄英,梁茂植,等.血清中罗红霉素的高效液相色法测定[J].药物分析杂志,1997,17(4):249-250
例2 Delatour F,Le Guludec D,Caron F,etal.Effect of a single oral dose of two erythromycin ethylsuccinate formulations on gastric emptying in healthy Volunteers:a scintigraphic study[J].Fundam Clin Pharmacol,1998,12(3):292
书籍:编著者.书名[M].版次.出版地:出版者,年:起-止页
例1 陈新谦,金有豫.新编药物学[M].第14版.北京:人民卫生出版社,1997:243-245
注意:著录参考文献除要求项目齐全外,每项后标点符号使用也应按示例进行标点。
2.表示量和单位依照GB3000~3102《量和单位》系列标准执行。法定单位用符号表示,不宜用中文书写(如用ml、mg、min分别表示毫升、毫克、分等)。
禁止使用非法定计量单位(包括临床实验室检查项目的单位),如“N”(当量浓度)、“M”(克分子浓度)、“ppm”(百万分之一),应当改写成“mol/L”和“10-6”。但血压单位恢复使用“mmHg”。
药品质量与检验
Synthesis and enzyme Inhibiting activity of roflumilast analogs
Li Hongyan1,Wang Guocheng2,Yang,Hui1,Liu Wenzheng2
(1. School of Inner Mongolia Medical University, Hohhot 010110;2. Institution of Chem-Pharm R&D of Tasly,Tianjin 300400)
Objective: To get better phosphodiesterase IV (PDE IV) inhibitors by a series of modifications of the structure of roflumilast. Method:A numberof noval roflumilast analogues were designed and synthized through the preparation of 3-cyclopropyl-methoxy-4-difluoromethoxy aniline(4),a key intermediate with 2-amino-5-nitrophenol (1) as a starting material, while the structures of cyclopropyl methoxy and difluoromethoxy groups being reserved. The resulting compounds were characterized by1H NMR and MS. The inhibiting activity of the target compounds on enzymes were preliminarily tested.Results: Molecular ion peaks were found in nine substances by MS,and compounds 7i and 7e showed a certain capability of inhibiting activity with both IC50being less than 1.5.Conclusion: The study set a theoretical basis for developing more novel PDE Ⅳ inhibitors.
phosphodiesterase Ⅳ,roflumilast,enzyme inhibitory activity
2015-07-01
TQ460
A
1006-5687(2015)05-0001-04
