消毒副产物二氯乙酰胺的去除特性及对斑马鱼的毒性
2017-04-11曹文平王国祥汪银梅东华理工大学水资源与环境工程学院江西南昌00河海大学环境学院江苏南京0000南京师范大学环境学院江苏南京00
曹文平,赵 鑫,王国祥,汪银梅(.东华理工大学水资源与环境工程学院,江西 南昌 00;.河海大学环境学院,江苏 南京 0000;.南京师范大学环境学院,江苏 南京 00)
消毒副产物二氯乙酰胺的去除特性及对斑马鱼的毒性
曹文平1*,赵 鑫2,王国祥3,汪银梅1(1.东华理工大学水资源与环境工程学院,江西 南昌 330013;2.河海大学环境学院,江苏 南京 210000;3.南京师范大学环境学院,江苏 南京 210023)
针对含氮消毒副产物二氯乙酰胺在水厂中的去除情况及对斑马鱼的发育毒性及生物累积毒性进行研究.研究发现,骆马湖水源地水厂的出厂水中二氯乙酰胺浓度最高为1.72µg/L,远低于微山湖的2.6µg/L.相比常规处理工艺,深度处理工艺中的臭氧活性炭工艺对二氯乙酰胺生成势的去除率高达64%,去除效果较好.二氯乙酰胺在10µg/L浓度下对斑马鱼胚胎产生明显致畸作用,并且对胚胎中枢神经毒性作用早于对胚胎体内循环作用.二氯乙酰胺易于在斑马鱼的肝脏发生累积作用,并且累积作用大小与脂质含量成正相关,应当被严格控制.
二氯乙酰胺;去除特性;发育毒性;生物累积毒性
为了充分应对水质标准对含碳消毒副产物限制,水厂开始采用氯胺代替氯气进行消毒,却导致水体中含氮消毒副产物增加.相比含碳消毒副产物,含氮消毒副产物有更高的基因及细胞毒性,因此受到广泛研究[1-3].在这类消毒副产物中,卤代乙酰胺是一种最近发现的含氮消毒副产物,相比三卤甲烷与卤乙酸有着更高的基因毒性与遗传毒性[4].其中二氯乙酰胺在水厂出水中浓度最高,达到了 5.6µg/L,且具有更高细胞毒性与细胞基因毒性[5].
斑马鱼因体型小,产卵量大,生长较快等特点,作为新模式动物被广泛用于毒性研究中[6],被广泛用于研究纳米材料、抗生素、重金属的毒性探究[7-9],但针对二氯乙酰胺进行斑马鱼的毒性效应未见报道.
本文对二氯乙酰胺的水厂存在、去除及基于斑马鱼的毒性机理进行研究.采用多水水源地水厂出水及相同水厂不同工艺出水的对比研究方法,探究不同水源地出厂水及相同水源地水厂不同工艺中的二氯乙酰胺浓度,旨在探究不同水源地对二氯乙酰胺的生成影响及不同工艺对二氯乙酰胺前驱物的去除效果.同时采用不同浓度二氯乙酰胺在不同时间作用下的毒性效应对比方法,研究二氯乙酰胺对斑马鱼的孵化率,死亡率,致畸率、心率及自主运动的作用,以探究二氯乙酰胺对斑马鱼的生长发育毒性及心脏循环功能毒性及神经调节功能毒性.最后试验研究了二氯乙酰胺在斑马鱼体内的生物浓缩因子,以探究二氯乙酰胺在斑马鱼体内的生物累积毒性.
1 材料与方法
1.1 材料
采用的斑马鱼为德国Tubingen品系,由南京大学模式动物研究所斑马鱼实验室提供.养殖照明条件为 14h光照/10h黑暗交替,养殖水温为(28.5±1)℃;水体每隔2.5h进行曝气充氧,保证溶解氧量大于5mg/L;pH值控制在7.02~7.25.在养殖过程中,每日定时投喂片状鱼粮与进口丰年虾,保证斑马鱼正常生长与繁殖.试验前,斑马鱼驯养1周,以降低养殖误差[10].
二氯乙酰胺购买于德国Alfa Aesar公司.其他分析纯药剂购买于南京宁试化学试剂有限公司.色谱纯级别的乙酸乙酯、正己烷及乙腈均购买于美国 Tedia公司.试验采用的超纯水由Millipore纯水仪制备.
1.2 试验方法
1.2.1 水厂出水中浓度试验 选取位于江苏苏北某2个城市的共4座水厂(A、B、C、D),在研究出厂水中的二氯乙酰胺的存在浓度.该4座水厂工艺均分别混凝、沉淀、过滤、消毒,对比 4座水厂出厂水中二氯乙酰胺浓度,探究水源地对二氯乙酰胺存在影响.4座水厂中A水厂还拥有平行的深度处理工艺与常规处理工艺,因此针对A水厂两套工艺,研究不同处理工艺对二氯乙酰胺的前驱物去除影响.江苏苏北四座给水厂其中A厂,B厂水源地取自微山湖,C厂、D厂水源地取自骆马湖.
1.2.2 二氯乙酰胺毒性试验 在预实验中,二氯乙酰胺对斑马鱼半致死浓度为 315mg/L.同时结合水厂出厂水中二氯乙酰胺浓度结果,将试验浓度设为µg/L浓度水平,并且在进行单一药品毒性试验时,取4个质量浓度梯度和一个空白对照:1, 10,50,100µg/L.在二氯乙酰胺的发育毒性研究中,将斑马鱼胚胎置于培养皿,对其进行96h的发育毒性试验.而二氯乙酰胺的生物累积毒性,将成体斑马鱼置于鱼缸中,进行20d的毒性试验.
1.2.3 二氯乙酰胺取样及检测 在7月对6座水厂出水进行取样装入预先清洗的玻璃瓶中(容量 1L),随后再加入缓冲液(0.2mol乙酸钠与0.3mol乙酸),将水样pH值调至5.0,降低二氯乙酰胺受 pH值作用转化造成的误差.随后水样冰浴保存带至实验室待测.在检测中,指每个样品均设3个平行样品,且每个平行样品均检测3次,以降低误差.
水样中二氯乙酰胺检测按照文献[11]的方法并加以改进,检测取 100mL水样进行萃取,采用液液萃取与气相色谱质谱联用的方法.为降低试验误差,采用乙酸乙酯作为萃取剂,检测仪器为气相色谱质谱联用(日本岛津),色谱柱为RTX-5MS毛细管柱(30m×0.25mm,0.25µm).检测条件如下:载气采用高纯氦气,压力控制载气流量,柱头压保持在125.2kPa,流速56.9mL/min,采用无分流进样,进样量为 1µL,进样口温度控制在 180℃,检测器温度为250℃,采用EI离子源,SM离子检测模式,电子能力为70eV,扫描质量范围m/z在20~200之间.升温模式如下:初期温度 50℃保持3min,再以50℃/min升温至140℃保持1min,二氯乙酰胺出峰时间为6.23min.
1.2.4 二氯乙酰胺的发育毒性研究 发育毒性试验根据斑马鱼的发育毒理学终点进行观测[12],主要探究二氯乙酰胺对斑马鱼卵在发育过程中的孵化数、畸形数和死亡率的作用,及二氯乙酰胺斑马鱼的自主运动及心跳的影响.试验中孵化率、畸形率及死亡率斑马鱼卵发育过程中8,24,48,96h测定.并且胚胎发育48h后,斑马鱼胚胎开始出现鞘膜,随后开始逐渐孵化,在96h胚胎孵化达到稳定,因此着重分析96h下的斑马鱼孵化率、畸形率及死亡率.斑马鱼胚胎的自主运动由发育24h时,斑马鱼胚胎连续2次自主运动的时间间隔得到.斑马鱼胚胎的心跳由发育48h时,使用秒表计数测定胚胎6s内的心跳次数得到[13].
1.2.5 二氯乙酰胺的代谢毒性研究 生物浓缩因子检测根据相关文献进行[14],生物累积试验浓度选择根据斑马鱼半致死浓度进行.本次试验条件下斑马鱼半致死浓度为 315mg/L,因此试验确定浓度为3.5mg/L与0.35mg/L.试验在每组浓度下的暴露池内放置200条斑马鱼,并且做空白组对照.试验分为 2个阶段:48h内的吸收阶段与48h~72h间的释放阶段.在0,2,6,12,24,48h对斑马鱼体内二氯乙酰胺浓度及暴露液中二氯乙酰胺浓度进行测定;随后将斑马鱼置于纯水中,在54,60,72h测定斑马鱼体内二氯乙酰胺浓度及纯中的二氯乙酰胺浓度变化.本次试验主要针对斑马鱼的肝脏,鱼鳃及肌肉组织进行研究,不同二氯乙酰胺的检测方法如下:2组暴露池中分别取出15条斑马鱼进行解剖,取出单一组织放置 20mL乙腈中均质化.随后均质液放置于预冷的离心管中超声30min,并且在5000g条件下离心10min,取上层清液置入100mL离心管中,该操作进行2次.随后萃取液置入100mL离心管中,加入20mL正己烷脱脂.弃上层正己烷混液,将剩下液体在45℃下恒温水浴加热.随后加入磷酸二氢钠缓冲液定容送检.
生物浓缩因子(BCF)的计算由K1和K22个速率常数的比值确定,这两个数据由生物累积模型计算:
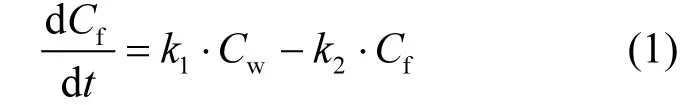
式中:Cf(ng/g)是斑马鱼各组织器官中的二氯乙酰胺浓度;K1是吸收速率常数;Cw(ng/mL)是暴露液体的二氯乙酰胺浓度,K2是释放常数.如果假设斑马鱼体内二氯乙酰胺浓度为 0且水体内的二氯乙酰胺是恒定的,因此可以对公式(1)进行简化得到式(2)
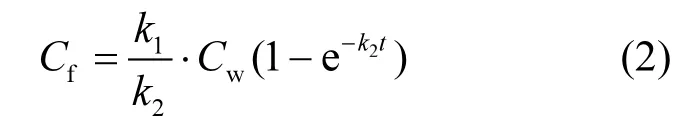
将试验得到的不同暴露节点下的组织浓度值与暴露液浓度值带入公式2中,可以得到K1,K2这2个速率常数.
1.2.6 数据分析 数据分析采用生物毒理学专用分析软件Graph pad Prism5.0进行.实验结果表示采用平均值±标准误差的形式,数据用单尾检验法进行比较,P<0.05为显著差异.
2 结果与讨论
2.1 给水厂出厂中二氯乙酰胺的浓度

图1 不同水源地水厂出水中二氯乙酰胺存在浓度Fig.1 Concentration of dichloroacetamide in effluent of different drinking water treatment plant
由图1可以看出,在4座水厂出水中,二氯乙酰胺均存在,微山湖为水源地水厂出水中二氯乙酰胺浓度明显高于以骆马湖为水源地的水厂.在微山湖水源地水厂出水中二氯乙酰胺浓度最高为2.6µg/L(B厂),而以骆马湖为水源地水厂出水中二氯乙酰胺浓度最高为 1.72µg/L(D厂).消毒副产物是由前驱物在加氯后形成,因此影响消毒副产物浓度的包括水源水中有机前驱物的浓度,消毒剂的种类、投加量及消毒接触时间,其中有机前驱物对二氯乙酰胺存在浓度影响最大[15].经现场调研对比发现,4座水厂都使用液氯作为消毒剂,并且消毒接触时间几乎相同,因此造成四座水厂出水中二氯乙酰胺浓度差异的最大可能性是由于取水点处水源水中的有机前驱物的浓度差异.
在调研的4座水厂中,C厂和D厂的原水取自骆马湖.骆马湖湖水面积 260km2,被江苏省定位水上湿地保护区,拥有极强的湖水自净能力,是南水北调的重要中转站.因此骆马湖水质明显优于微山湖水质.C厂原水处于湿地区,水质受到净化;而 D厂原水取自湖湾区,水体流动相对较小,因而C厂原水水质明显高于D厂原水水质,最终导致C厂出厂水中二氯乙酰胺浓度低于D厂出厂水.A厂和B厂的原水取自微山湖,微山湖湖水面积 660km2,是中国北方最大的淡水湖.但近年来随着微山湖的开发,生活、工业污水及人工养殖废水大量进入湖体,导致微山湖水质明显恶化.A厂、B厂原水均取自湖湾处,但A厂水源地有效开展了严查污水偷排及生态清淤措施,使得A处水源地的水质由于B厂水源地,最终导致A厂出厂水中二氯乙酰胺浓度低于B厂出厂水.
因此推断二氯乙酰胺的形成与水质相关;同时考虑到 4座水厂出厂水中二氯乙酰胺浓度均高于1µg/L,可以作为毒性实验的依据.
2.2 给水厂对二氯乙酰胺的去除
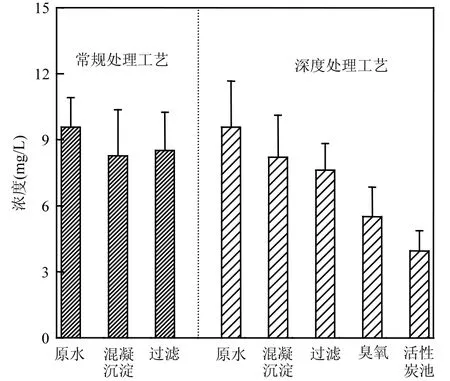
图2 不同处理工艺单元出水中二氯乙酰胺浓度Fig.2 Concentration of dichloroacetamide in effluent of different treatment units
针对A水厂2套平行工艺进行对比,常规处理工艺包括:混凝、沉淀、过滤、消毒;深度处理工艺包括:混凝、沉淀、过滤、臭氧活性炭滤池、消毒.二氯乙酰胺是消毒前驱物在加氯后产生的,因此各单元出水中并不能直接检测出二氯乙酰胺.为了实现去除效率对比,根据文献[15]引入二氯乙酰胺生成势.生成势试验过程如下:100mL水样加入500mL密封瓶,在室温下进行加氯反应,用碳酸氢钠调节 pH值至7.5.加氯量由式(3)获得:
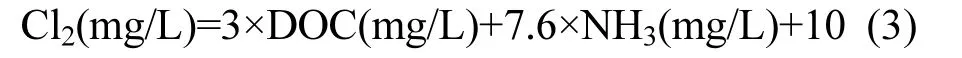
本次试验水样加氯量为19.1mg/L,各单元出水中二氯乙酰胺生成势结果见图2.
由图2可以看出,在原水中二氯乙酰胺的生成势浓度为9.57µg/L.在常规处理工艺中,混凝沉淀处理后出水中生成势浓度为 8.33µg/L,但经过滤处理后,生成势浓度出现上升,达到 9.15µg/L.在深度处理工艺中,经混凝沉淀去除后生成势浓度为 8.21µg/L,经过滤去除后生成势浓度为7.62µg/L,经臭氧去除后生成势为 5.51µg/L,最后活性炭池出水中生成势仅为 3.95µg/L.常规处理工艺对生成势总体去除率为4.3%,而深度处理工艺对生成势总体去除率达 58.7%.因此深度处理工艺出水中生成势浓度明显低于常规处理工艺出水的生成势浓度,即深度处理工艺对二氯乙酰胺前驱物有着更大的去除效率.
同时为研究不同处理工艺下各处理单元对二氯乙酰胺生成势的去除效果,试验对各单元针对二氯乙酰胺生成势去除的贡献比进行计算,挑选出对二氯乙酰胺生成势有正去除作用的工艺处理单元,根据各单元对二氯乙酰胺生成势的正去除浓度,计算对二氯乙酰胺生成势有正去除作用单元的去除贡献程度,结果见图3.
由图3可以看出,在常规处理工艺中,仅混凝沉淀工艺对生成势有正去除作用,而在深度处理工艺中,混凝沉淀去除贡献度仅为24%,过滤单元去除贡献率仅为 10%,而臭氧活性炭池联合单元对生成势去除贡献度最高,达64%.文献[16]表明,臭氧活性炭池联合单元对消毒副产物前驱物有着较强的去除效率.臭氧对蛋白质氨基酸等主要消毒副产物前驱物有着较强的氧化作用:臭氧分子可以与有机物发生直接氧化作用,臭氧被分解后会产生羟基自由基,间接的与有机物发生氧化反应.在强氧化作用下,大颗粒有机物分子受到氧化作用,直接转化为小分子有机物颗粒,一定程度上降低了二氯乙酰胺的生成势.在活性炭池阶段,活性炭池会对臭氧降解出的小分子有机物实现有效的吸附截留,活性炭附着的微生物会对这类有机物有效吸收与降解,最终降低水体中二氯乙酰胺的生成势[17].同时有文献报道二氯乙酰胺的前驱物主要为芳香类蛋白质,臭氧活性炭单元对芳香类蛋白质等类蛋白类物质有着较高的氧化及生物去除作用,因而对二氯乙酰胺的生成势可以有效去除[18].因此为实现二氯乙酰胺有效控制,深度处理工艺中的臭氧活性炭池单元可以作为优选单元.
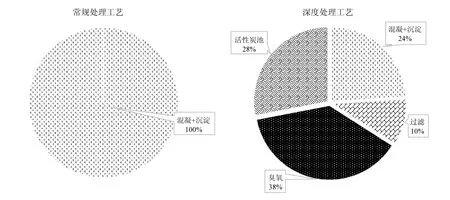
图3 不同工艺各单元去除贡献比Fig.3 Removal contribution of different treatment units
在检测过程中发现,在常规处理工艺中过滤单元对生成势产生了负去除作用,而在深度处理工艺中的却出现了正去除.经实地考察调研发现,
在取样期间深度处理工艺中滤池单元距前次反冲洗时间较短,而常规处理工艺距前次反冲洗时间较长,因而造成了常规处理工艺滤池滤层中累积的有机前驱物发生释放,最终提高了出水中的二氯乙酰胺生成势浓度.
2.3 二氯乙酰胺对斑马鱼的生长发育毒性
2.3.1 二氯乙酰胺对斑马鱼胚胎致死率、孵化率及死亡率影响 由图4可以看出,随着二氯乙酰胺暴露浓度的上升,斑马鱼胚胎孵化率呈现下降趋势.在低浓度下(1,10µg/L),二氯乙酰胺对斑马鱼胚胎孵化率无明显作用.当浓度在50µg/L、100µg/L时,斑马鱼胚胎孵化率明显下降,分别下降11%和18%.随着二氯乙酰胺暴露浓度上升,斑马鱼胚胎死亡率不断上升.在低浓度下(1,10µg/L),二氯乙酰胺对斑马鱼胚胎死亡率无明显作用,当浓度在50,100µg/L时,胚胎死亡率明显上升,分别达到68%与75%.随着二氯乙酰胺暴露浓度增加,斑马鱼胚胎致畸率不断上升,并且当浓度大于10µg/L时,二氯乙酰胺对斑马鱼胚胎产生明显的致畸作用.
在二氯乙酰胺的暴露过程中,二氯乙酰胺会随着胚胎吸收进入胚胎内,对胚胎的叶酸代谢产生一定的抑制作用,从而抑制胚胎细胞正常发育.同时二氯乙酰胺作为外源性物质也会促进胚胎体内好氧基团的产生,对胚胎内细胞造成氧化损伤,抑制了胚胎的正常代谢行为,从而抑制了斑马鱼胚胎的正常发育与生长[19].暴露实验发现,在环境浓度下(1µg/L)二氯乙酰胺对斑马鱼胚胎致畸率、死亡率及畸形率无明显毒性作用.并且由浓度和指标的对应关系发现,在10µg/L时二氯乙酰胺对斑马鱼致畸作用明显,即二氯乙酰胺对斑马鱼胚胎有着较强的致畸作用,应当被严格控制.
2.3.2 二氯乙酰胺对斑马鱼胚胎自主运动及心跳毒性 由图5可以看出,随着二氯乙酰胺浓度的上升斑马鱼的胚胎自主运动间隔不断的降低,相同时间间隔内的运动频率不断升高.当浓度在50,100µg/L时,胚胎的自主运动受到明显的作用,分别下降30%,39%.随着二氯乙酰胺浓度上升,胚胎心率呈现上升趋势,并且在100µg/L时,胚胎心率明显上升,相比对照组上涨68%.并且在环境浓度下(1µg/L),二氯乙酰胺对斑马鱼胚胎自主运动及心率无明显毒性作用.
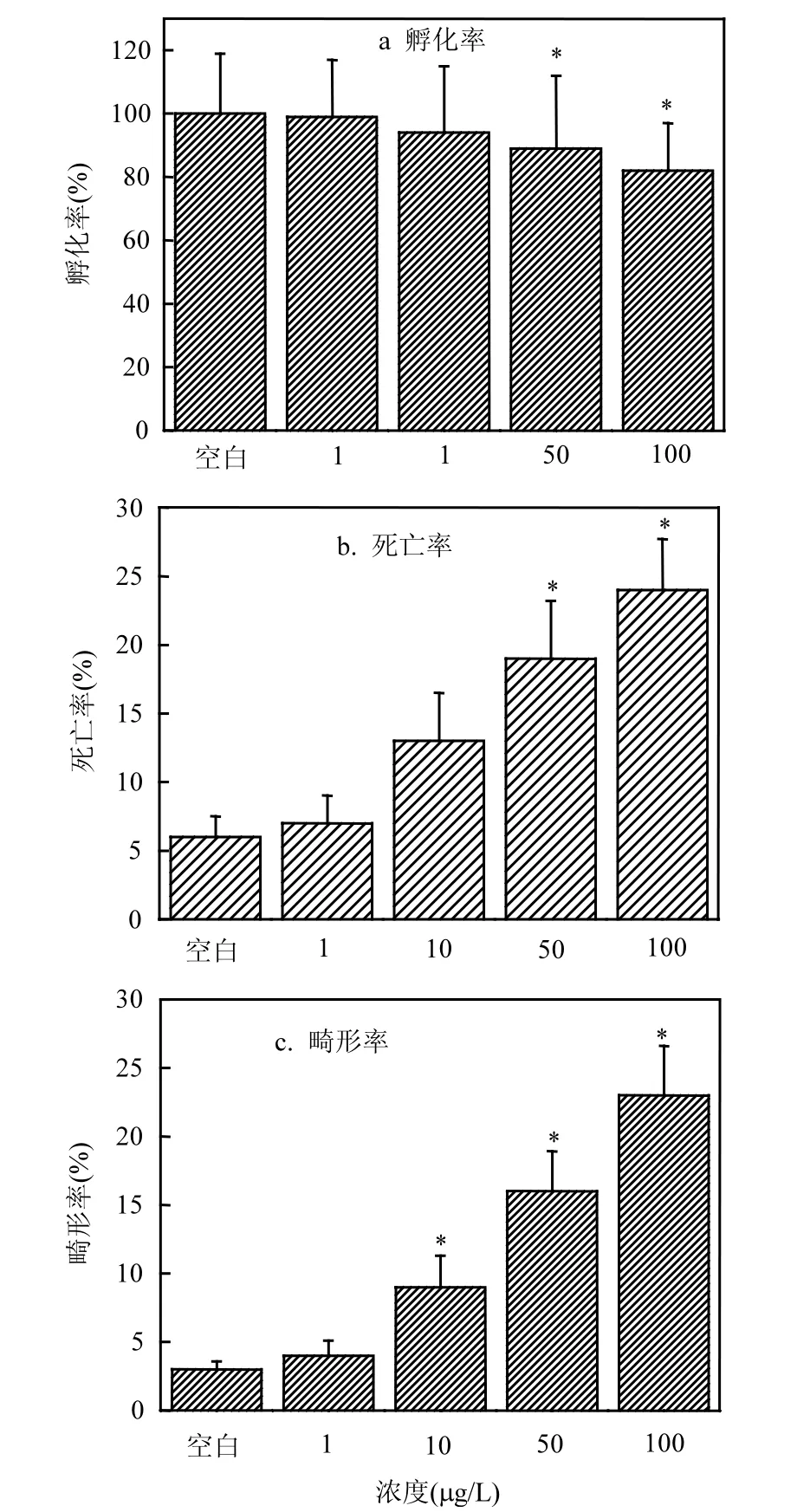
图4 二氯乙酰胺对斑马鱼胚胎的孵化率、死亡率、畸形率的作用Fig.4 Effects of dichloroacetamide on hatchability, death rate and malformation of zebrafish *显著影响, P<0.05
经研究发现,胚胎自主运动受到胚胎中枢神经控制,可以由自主运动间隔判断发育过程中的神经功能及胚胎发育过程中的协调能力[20].在暴露过程中,二氯乙酰胺会被胚胎吸收进入体内,二氯乙酰胺本体及引起的自由基会对胚胎细胞产生氧化损伤产生神经信号,这类信号会传输至胚胎中枢神经,并且对胚胎中枢神经造成损伤,从而加快相同时间的运动频次,降低运动时间间隔.心脏在胚胎发育过程中起到体内循环的作用,并且在胚胎发育过程中,心脏的发育受到细胞的迁移、增值、分化的作用,是较为复杂的过程[21].在暴露过程中,二氯乙酰胺会进入斑马鱼体内造成氧化损伤,从而一定程度上影响胚胎的正常呼吸代谢,从而诱发胚胎局部组织缺氧,从而影响胚胎体内循环,最终加快胚胎心率.
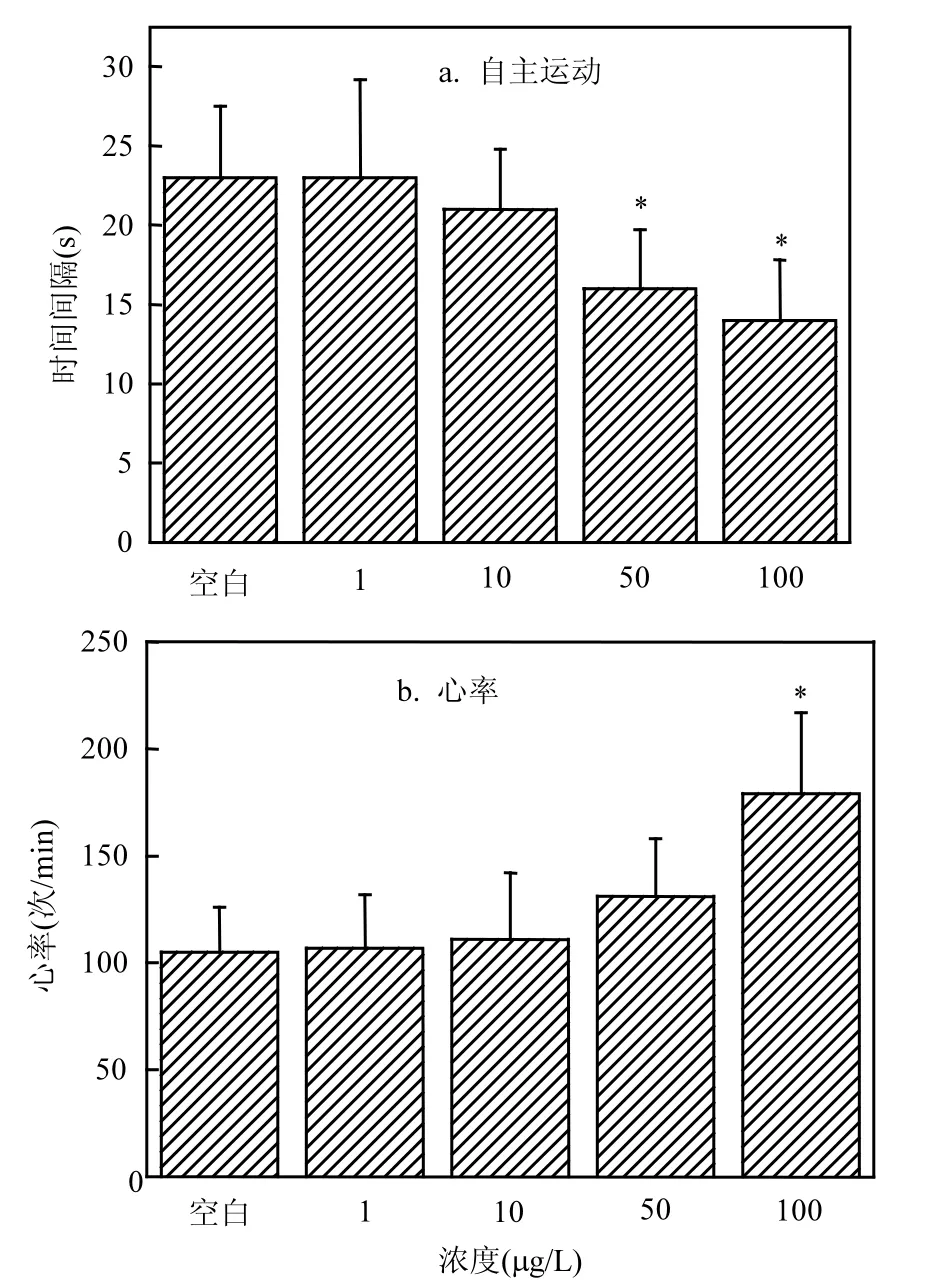
图5 二氯乙酰胺对斑马鱼胚胎的自主运动及心率的作用Fig.5 Effects of dichloroacetamide on spontaneous movement and heart beats of zebrafish*显著影响, P<0.05
同时由暴露结果可以看出,在大于等于50µg/L浓度下,胚胎自主运动受到明显作用;而在大于等于 100µg/L浓度下,胚胎心率才收到明显的作用.因此可以得出二氯乙酰胺对胚胎的自主运动作用大于对胚胎的心率作用,即二氯乙酰胺对胚胎中枢神经毒性作用早于对胚胎体内循环作用.
2.4 二氯乙酰胺对斑马鱼的生物累积毒性
2.4.1 暴露液体中二氯乙酰胺的浓度变化由图 6可见,在吸收阶段,0.35mg/L组分与3.5mg/L组分暴露液中的二氯乙酰胺浓度均呈现下降趋势,并且 3.5mg/L组分下降尤为明显.而在释放阶段,清水中的二氯乙酰胺浓度都缓慢增加.

图6 两组暴露液中二氯乙酰胺的浓度变化Fig.6 Concentration of dichloroacetamide in two exposure mixture

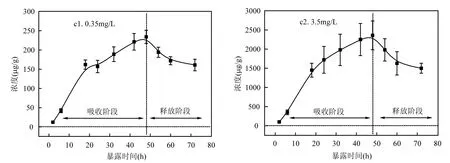
图7 不同暴露组中斑马鱼器官对二氯乙酰胺的吸收与释放Fig.7 Adsorption and desorption of dichloroacetamide in organs of zebrafisha肝脏组织;b鱼鳃组织;c肌肉组织
2.4.2 斑马鱼各器官二氯乙酰胺的浓度变化由图7可以看出,2组浓度试验下的斑马鱼肝脏、鱼鳃及肌肉均随暴露时间呈现显著变化.在暴露初期,3个器官中的二氯乙酰胺均呈现上升趋势,并在48h~56h取得最大值,其中肝脏累积二氯乙酰胺浓度最大(0.35mg/L组为 351µg/g,3.5mg/L为 3656µg/g),其次是鱼鳃组织,最后是肌肉组织.随后组织器官内的二氯乙酰胺浓度逐渐下降,反应组织器官对二氯乙酰胺的排出释放.
2.4.3 斑马鱼不同器官组织对二氯乙酰胺的生物累积因子(BCF) 由表1可以看出,两个暴露浓度测试下肝脏的生物浓缩因子分别为 1510 (0.35mg/L)和 1980(3.5mg/L);鱼鳃组织的生物浓缩因子分别为 1250(0.35mg/L)、1376(3.5mg/L);肌肉组织的生物浓缩因子分别为 678(0.35mg/ L)、821(3.5mg/L).其中肝脏生物浓缩因子最高,其次是鱼鳃,最后是肌肉组织.针对生物浓缩因子进行对数计算发现,肝脏及鱼鳃的lgBCF指数均大于 3,因此可以推断二氯乙酰胺易于在斑马鱼的肝脏及鱼鳃组织发生累积,但在肌肉组织中累积现象并不明显.肝脏作为主要代谢器官组织会易于发生污染物质的累积,并且二氯乙酰胺是脂溶性物质易于在肝脏这类高脂肪组织发生累积
[22].鱼鳃是斑马鱼主要的呼吸及进食器官,是外界物质进入斑马鱼体内的必经通道,因此易于发生二氯乙酰胺累积.而肌肉组织并不是高脂质组织,因此,累积现象发生并不明显[23].通过斑马鱼组织器官生物累积因子试验发现,生物累积因子大小与脂质含量成正相关,因此可以推断二氯乙酰胺会在人类的高脂质组织器官中发生累积.
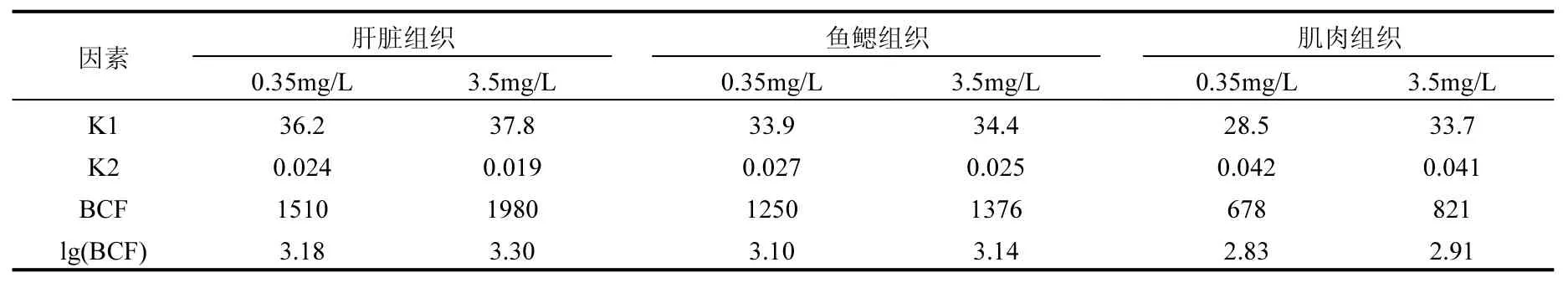
表1 不同浓度组下的生物浓缩因子计算Table 1 Bioaccumulation factors under different concentrations
3 结论
3.1 二氯乙酰胺在水厂出厂水中的浓度受水源地的影响较大,骆马湖水源地出厂水中二氯乙酰胺浓度最大为 1.72µg/L,远低于微山湖水厂出水中的2.6µg/L.
3.2 在不同处理工艺对比中发现,常规处理工艺对二氯乙酰胺生成势去除效果较差,而深度处理工艺中的臭氧活性炭工艺对二氯乙酰胺生成势的去除率高达64%,有极好的去除效果.并且制定合理的反冲洗周期也有利于提高常规处理工艺对二氯乙酰胺生成势的去除能力.
3.3 环境浓度下的二氯乙酰胺对斑马鱼胚胎发育几乎无明显毒性作用,但随着浓度升高,发育毒性开始变得明显.二氯乙酰胺对斑马鱼有着明显的致畸作用.
3.4 二氯乙酰胺对斑马鱼肝脏的累积毒性大于对鱼鳃及肌肉组织的累积毒性.因此推断二氯乙酰胺会在人类的高脂质组织器官中发生累积.
[1] Chu W, Gao N, Yin D, et al. Formation and speciation of nine haloacetamides, an emerging class of nitrogenous DBPs, during chlorination or chloramination [J]. J. Hazard. Mater., 2013,260:806-812.
[2] 曹文平.水力负荷对内环流蜂窝陶瓷生物反应器去除COD和氨氮的影响 [J]. 徐州工程学院学报(自然科学版), 2012,27(3):73-77.
[3] 张雁秋,曹文平,刘 莉,等.基质对生态浮床净化效果和大型水生植物生长的影响 [J]. 徐州工程学院学报(自然科学版), 2013,27(4):18—23.
[4] 黄 河,徐 斌,朱文倩,等.长江沿线城市水源氯(胺)化消毒副产物生成潜能研究 [J]. 中国环境科学, 2014,34(10):2497-2504.
[5] Krasner S, Weinberg H, Richardson S, et al. Occurrence of a new generation of disinfection byproducts [J]. Environ. Sci. Technol., 2006,40:7175-7185.
[6] Chen D, Yang Q, Tian M, et al. The defective expression of gtpbp3related to tRNA modification alters the mitochondrial function and development of zebrafish [J]. Int J Biochem Cell B., 2016,77:1-9.
[7] 林 琎,王红艳,王开运,等.氟吡菌胺对斑马鱼的毒性效应. [J].中国环境科学, 2014,34(12):3230-3236.
[8] 杜永光,张海军,陈吉平,等.氧化铜催化五氯苯生成二噁英的研究. [J]. 环境科学, 2010,31(11):2774-2779.
[9] Yuan J, Xie C, Zhang T, et al. Linear and nonlinear models for predicting fish bioconcentration factors for pesticides [J]. Chemosphere, 2016,156:334-340.
[10] Westerfield M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 3rd Edition [M]. Eugene: University of Oregon Press, 1995.
[11] Chu W, Gao N. Determination of nitrogenous disinfection byproducts chloroacetamides in drinking water by gas chromatography—mass spectrometry [J]. Chin. J. Anal. Chem., 2009,37:103-106.
[12] Schulte C, Nagel R. Test acute toxicity in the embryo of zebra fish, Brachydanio rerio, as an alternative to the acute fish test: preliminary results [J]. Alternatives to Laboratory Animals, 1994,22:12-19.
[13] Airhart M, Lee D, Wilson T, et al. Movement disorders and neurochemical changes in zebrafish larvae after bath exposure to fluoxetine (PROZAC) [J]. Neurotoxicol. Teratol., 2007,29:652—664.
[14] Oliver A, Sanz-Landaluze J, Muñoz-Olivas R, et al. Zebrafish larvae as a model for the evaluation of inorganic arsenic and tributyltin bioconcentration [J]. Water Res., 2011,45:6515—6524. [15] Krasner S, Sclimenti M, Guo Y, et al. Development of DBP and nitrosamine formation potential tests for treated wastewater, reclaimed water, and drinking water [C]. Proceedings of the 2004AWWA Water Quality Technology Conference; AWWA: Denver, CO, 2004.
[16] Ma D, Chen L, Wu Y, et al. Evaluation of the removal of antiestrogens and antiandrogens via ozone and granular activated carbon using bioassay and fluorescent spectroscopy [J]. Chemosphere, 2016,153:346-355.
[17] Antony A, Bassendeh M, Richardson D, et al. Diagnosis of dissolved organic matter removal by GAC treatment in biologically treated papermill effluents using advanced organic characterisation techniques [J]. Chemosphere, 2012,86:829-836.
[18] Chu W, Gao N, Deng Y, et al. Precursors of dichloroacetamide, an emerging nitrogenous DBP formed during chlorination or chloramination [J]. Environ. Sci. Technol., 2010,44:3908-3912.
[19] Nassef M, Kim S, Seki M. In ovo nanoinjection of triclosan, diclofenac and carbamazepine affects embryonic development of madaka fish (Oryzias latipes) [J]. Chemosphere, 2010,79(9):966—973.
[20] Cha H J, Kim J Y, Jeon S Y, et al. Neurotoxicity induced by alkyl nitrites: Impairment in learning/memory and motor coordination [J]. Neuroscience Letters, 2016,619:79—85.
[21] Mateos R A, Pardillos F L, Navalpotro P J M, et al. Kidney transplant function using organs from non-heart-beating donors maintained by mechanical chest compressions [J]. Resuscitation, 2010,81:904—907.
[22] 丁春生,沈嘉辰,缪 佳,等.改性活性炭吸附饮用水中三氯硝基甲烷的研究 [J]. 中国环境科学, 2013,33(5):821-826.
[23] Oliver A, Sanz-Landaluze J, Muñoz-Olivas R, et al. Zebrafish larvae as a model for the evaluation of inorganic arsenic and tributyltin bioconcentration [J]. Water Res., 2011,45:6515-6524.
Removal property and toxicity research on zebrafish of the disinfection-byproduct—dichloroacetamide.
CAO Wen-ping1*, ZHAO Xin2, WANG Guo-xiang3,WANG Yin-mei1(1.School of Water Resource and Environmental Engineering, East China University of Technology, Nanchang 330013, China;2.School of Environment, Hohai University, Nanjing 210000, China;3.School of Environment, Nanjing Normal University, Nanjing 210023, China). China Environmental Science, 2017,37(3):1073~1081
s:Dichloroacetamide is anitrous disinfection-byproduct in drinking water treatment plant, which is harmful to human health. In this work, zebrafish was used as the target organim to explore effect of dichloroacetamide on zebrafish in developmental and accumulative toxicity. Experimental results document that the highest dichloroacetamide concentration in effluent from drinking water treatment plant of Luoma Lake was 1.72µg/L, which is far lower than that from in Weishan Lake with 2.6µg/L. Comparing conventional treatment process suggests that advanced unit of ozone combined with granular-activated carbon achieved higher efficiency for dichloroacetamide removal ratio, which reached at about 64%. Dichloroacetamide could cause malformation effects on embryo zebrafish and could cause stronger toxicity effects on neuron than that on circulation system of embryo zebrafish. Dichloroacetamide also could cause accumulative toxicity on zebrafish liver and its accumulative toxicity was proportional to lipid content, which should be strictly controlled.
dichloroacetamide;removal property;developmental toxicity;bio-accumulative toxicity
X171.5,X503.225
A
1000-6923(2017)03-1073-09
曹文平(1979-),男,江西都昌人,副教授,博士,主要研究方向为水质净化和生态修复工程.发表论文90余篇.
2016-07-12
江苏省自然科学基金(BK2011201);住房与城乡建设部科技计划项目(2012-K7-14);科学技术部星火计划项目;江苏省六大高峰人才项目(JNHB-005)
* 责任作者, 副教授, caowenping5000@163.com
