多巴胺与去甲肾上腺素在休克治疗中的应用研究*
2015-02-26李长江延荣强
杨 璇,李长江,冯 磊,延荣强,李 玉
(1.山东省青岛市市立医院,山东 青岛 266000 2.山东省青岛市中心医院,山东 青岛 266000 3.山东省淄博市政府机关医院心内科,山东 淄博 255000)
长期以来,多巴胺一直是抗休克治疗的一线用药,具有维持血压、改善器官灌注的作用,ACC/AHA指南也建议多巴胺作为急性心肌梗死低血压患者的首选升压药。然而,2010年《新英格兰医学杂志》发表了一项多中心随机试验,关于多巴胺和去甲肾上腺素治疗休克的比较,结果发现,多巴胺和去甲肾上腺素抗休克的总体死亡率无显著差异,但多巴胺导致更多不良反应,尤其是房颤等心率失常[1,2]。多巴胺作为一线抗休克药物的地位因此动摇。对于此项研究,国内外专家对此持有争议,而目前,国内对于休克缩血管药物的治疗研究较少,因此本研究将休克患者随机分组,分别接受多巴胺、去甲肾上腺素及二者联合治疗,观察患者28d死亡率,以及肾功能、肝功能、心功能情况,从而为临床实践中休克治疗方案的选择提供依据。
1 对象与方法
1.1 研究对象:病例的选择:本研究为青岛市市立医院和青岛市中心医院合作研究,选择2013年5月至2014年7月间心内科和重症监护病房临床确诊为休克、需要应用缩血管药物来升高血压、维持器官灌注的患者共200例。休克入组标准:收缩压<90mmHg并具有组织器官灌注不足的临床表现,如少尿、神志改变、皮肤湿冷等。排除标准:肿瘤晚期、多脏器衰竭末期的患者。所有病人均首先进行液体复苏,补充足够的血容量。所有患者均进行治疗前、后血气分析、肾功能、心电图检查及常规的血、尿、肝功能检查等。
1.2 治疗方法与分组:对入选病人随机分组:多巴胺组(DA组)(n=65),去甲肾上腺素组(NE组)(n=65),多巴胺联合去甲肾上腺素组(DA+NE组)(n=70),治疗剂量均从小剂量开始,多巴胺3μg·kg-1·min-1,去甲肾上腺素 0.02μg·kg-1·min-1,直至收缩压≥90mmHg,症状改善,或者已用到药物的最大剂量。其中DA组男38例,女27例,平均年龄(59.23±10.34)岁,NE 组男 40 例,女 25 例,平均年龄(58.83±12.34)岁,DA+NE 组男 41例,女29例,平均年龄(59.71±10.88)岁,三组年龄、性别分布无统计学差异,显示三组具有可比性。
1.3 观察指标:观察记录患者的治疗结果,包括治疗前后的血气分析,肾功能、肝功能、心功能变化等。记录各组中28d存活率和心脏不良事件发生率等。
1.4 统计学方法:采用SPSS20.0统计软件对本研究中的所有数据进行统计分析,以“均数±标准差”的形式表示符合正态分布的计量资料,三组剂量治疗之间的比较采用单因素方差分析,其中的两组之间的比较采用SNK法,率的比较采用卡方检验,以P<0.05表示具有统计学差异。
2 结 果
2.1 三组治疗前后血压、心率、肝肾功能、心功能的比较:结果发现,治疗后三组心率、血压、血氧饱和度、心指数、血尿酸、血肌酐均较治疗前有显著差异。三组治疗后的心率、血压、血氧饱和度、心指数、血尿酸之间比较无统计学差异,但是治疗后血肌酐水平在三组中有显著差异,DA组血肌酐水平显著高于NE组和DA+NE 组,见表 1、表 2、表 3。
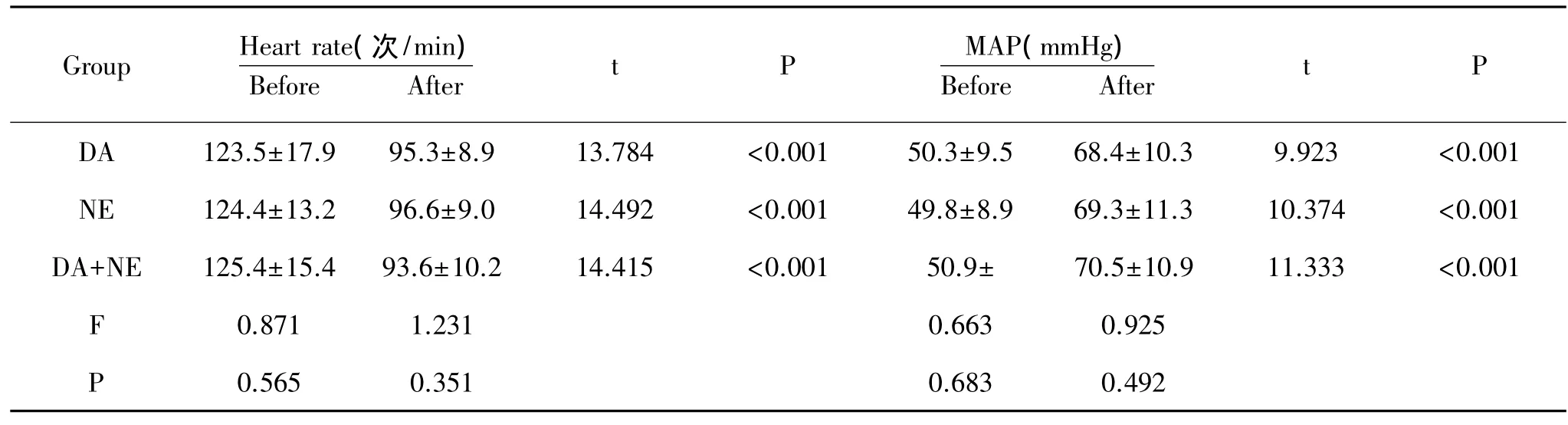
表1 各组治疗前后心率、血压变化
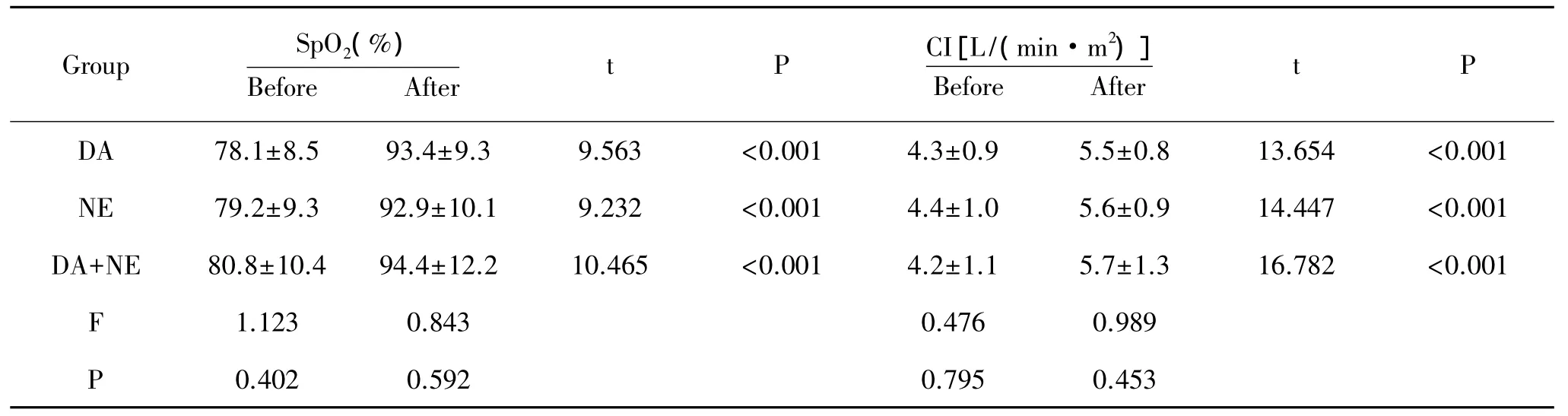
表2 各组治疗前后血氧饱和度心指数变化
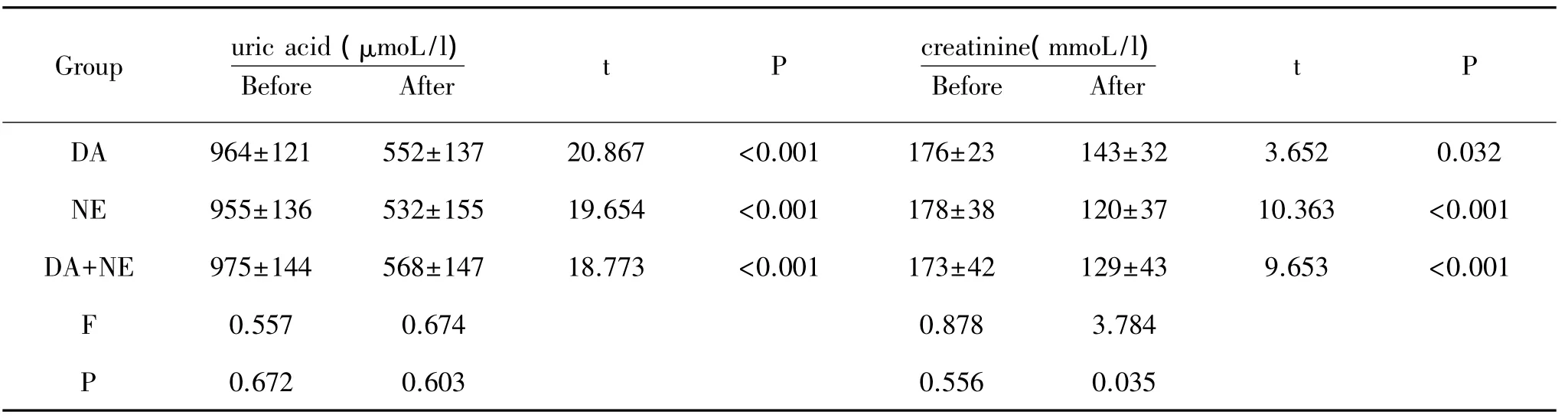
表3 各组治疗前后肾功能变化
2.2 三组随访结果比较:DA组治疗期间心律失常的发生率为30.76%(20/65)(其中包括室性心动过速4例,心室颤动8例,心房颤动8例),而NE组仅为13.85%(9/65)(室性心动过速4例,心室颤动1例,心房颤动4例),DA组心律失常的发生率显著高于NE组(χ2=5.370,P=0.021),DA+NE 组为 20.0%(14/70)(室性心动过速5例,心室颤动3例,心房颤动6例)。28d随访发现,DA组患者死亡率为24.62%,NE组死亡率为21.54%,DA+NE组为18.57%,三组无统计学差异(χ2=0.725;P=0.394)。
3 讨论
目前,临床上对血管活性药在休克治疗中的选择性应用争议很多。一直以来,多巴胺能增强心肌收缩力,收缩皮肤和肌肉的小动脉,扩张肾脏血管,是理想的抗休克药物,国内也有长时间应用超大剂量多巴胺和小剂量硝普钠抢救急性心肌梗死并发重症心源性休克,从而达到维持动脉血压,增加组织灌注,改善左室功能的成功的目的。然而,新近的研究证明多巴胺和去甲肾上腺素都可以作为治疗休克的首选药物,但在很多方面去甲肾上腺素略优于多巴胺[3],因此,多巴胺在休克治疗领域的重要地位受到挑战。
过去认为去甲肾上腺素可使体内器官局部血管收缩,在低血容量性休克中应用不当,会出现器官功能不全的不良反应[4],但近年来许多临床及实验研究表明:感染性休克在充分液体复苏基础上,相比大剂量多巴胺和肾上腺素,大剂量应用去甲肾上腺素并不会增加低灌注的发生率,还可改善微循环血流量和氧供;同时也不会造成全身血管阻力的增加和死亡率的上升[5~7],甚至去甲肾上腺素能明显提高患者生存率[8]。对感染性休克,对于血管活性药的选择,2008年严重感染和感染性休克治疗国际指南推荐将去甲肾上腺素或多巴胺作为纠正脓毒性休克低血压时首选的血管加压药物以维持平均动脉压>65mmHg(在建立中心静脉通路后应尽快给药)。但因缺乏有说服力的高质量证据而归为1C级,亦无在脓毒症治疗中选择何种儿茶酚胺类药物的最终建议[9]。
对于心源性休克血管活性药物的应用,无论是实验研究还是临床证据为数很少。心肌广泛损害导致急性泵衰竭是心源性休克发生的主要原因,急性心肌梗死,特别是ST段抬高型急性心肌梗死是引起心源性休克的最常见病因。心源性休克的发生无疑与心肌梗死的范围有关,心肌梗死的范围越大心源性休克的发生率越高。再灌注治疗特别是急诊经皮穿刺冠状动脉介入治疗(PCI)的普遍开展是降低心源性休克的发生率和死亡率的主要手段[10,11]。在心源性休克早期维持一定的动脉压对于维持冠状动脉的血液灌注是非常重要的。正性肌力作用药物可增加心肌氧耗,使心肌缺血更加严重,缩血管药物可使阻力血管收缩,使组织灌注减少,大剂量缩血管药物的使用可增加心源性休克病人的死亡率[12],因此正性肌力作用药物和缩血管药物均应使用最小的有效剂量,在增加心肌收缩力和不加重心肌氧耗及增加组织灌注压和不增加外周血管阻力之间寻求平衡点。ACC/AHA指南推荐以多巴胺作为急性心肌梗死低血压患者的首选升压药研究。推荐去甲肾上腺素用于严重的心源性休克低血压状态。心源性休克时,应用低浓度(0.03~0.15mg·kg-1·min-1)去甲肾上腺素,可通过提高心肌血流量而改善心肌供氧[13]。
因此,目前的研究对于休克治疗中缩血管药物的使用存在很大的分歧。但是,由于休克作为临床的危重症,死亡率高,发生率却并不少见,而国内对于休克缩血管药物的治疗研究更少,因此,本研究深入休克治疗中多巴胺和去甲肾上腺素的使用选择,并对其相关并发症和死亡率进行了随访。结果表明,经过治疗后,三组在治疗效果方面基本无统计学差异,28d死亡率无统计学差异,但是DA组心律失常的发生率显著高于NE组。NE组患者的血肌酐水平要显著低于DA组。由此可见,在治疗效果基本相同的情况下,NE组并发症的发生率更低,并有更好地保护肾功能的作用,可见其治疗效果优于DA。
多巴胺增加平均动脉压和每分输出量,主要是由于增加了患者的每搏输出量和心率。所以,多巴胺可能对有心脏收缩功能障碍的患者有特殊的作用,但可引起心动过速及可能进一步导致心律失常[14]。与多巴胺相比,去甲肾上腺素主要是由于其血管收缩效应提升平均动脉压,而只是稍微改变心率和每搏输出量,因而心律失常的发生率低。曾有报道显示小剂量多巴胺可促进并保持肾血流量,多巴胺被广泛应用于临床治疗休克,防止患者出现急性肾衰,但一些临床试验结果显示,去甲肾上腺素能更有效的保护肾功能,这与本研究结果一致,但其原因尚进一步研究。
[1] Daniel De Backer,Patrick Biston,Jacques Devriendt,et al.Comparison of dopamine and norepinephrine in the treatment of shock[J].N Engl Med,2010,362:779~789.
[2] Unverzagt S,Wachsmuth L,Hirsch K,et al.Inotropic agents and vasodilator strategies for acute myocardial infarction complicated by cardiogenic shock or low cardiac output syndrome[J].Cochrane Database Syst Rev,2014,2(1):CD009669.
[3] Annane D,Vignon P,Renault A,et al.Norepinephrine plus dobutamine versus epinephrine alone for management of septic shock:a randomised trial[J].Lancet,2007,370:676~684.
[4] Theil meier G,Booke M.Norepinephrine in septic patientsfriend or foe[J].Clin Anesth,2003,15(2):154~158.
[5] Jones AE.What vasopressors should be used to treat shock[J].Ann EmergMed,2007,49(3):367~368.
[6] De Backer D,Creteur J,Silva E,et al.Effects of dopamine,norepinephrine and epinephrine on the splanchnic circulationin septic shock:which is best[J].Crit Care Med,2003,31(6):1659~1667.
[7] Ibsen M,Jorgenson VL,Perner A.Norepinephrine in low tomoderate doses may not increase luminal concentrations of L2 lactate in the gut in patient swith septic shock[J].Acta Anaesthesiol Scand,2007,51(8):1079~1084.
[8] Martin C ,Viviand X,Leone M,et al.Effect of norepinephrine on the outcome of septic shock[J].Crit Care Med,2000,28:2758~2765
[9] Dellinger RP,Levy MM,Carlet JM,et al.Surving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2008[J].Intensive Care Med,2008,36(1):296~327.
[10] Jeger RV,Radovanovic D,Hunziker PR,et al.Ten-year trends in the incidence and treatment of cardiogenic shock[J].Ann Intern Med,2008,149(9):618~626.
[11] Zeymer U,Vogt A,Zahn R.Predictors of in hospital mortality in 1333 patients with acute myocardial infarction complicated by cardiogenic shock treated with primary percutaneous coronary intervention PCI results of the primary PCI registry of the Arbeitsgemeinschaft Leitende Kardiologische Krankenhausarzte ALKK[J].Eur Heart,2004,25(4)322-328.
[12] Valente S,Lazzeri C,Vecchio S.Predictors of in hospital mortality after percutaneous coronary intervention for cardiogenic shock[J].Int Cardiol,2007,114(2):176~182.
[13] Antman EM,Anbe DT,Armstrong PW.ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction executive summary a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines Writing Committee to Revise the 1999 Guidelines for the Management of Patients With A-cute Myocardial Infarction[J].Circulation,2004,110(5):588~636.
[14] Landry DW,Levin HR,Gallant EM,et al.Vasopressin deficiency contributes to the vasodilation of septic shock[J].Circulation,1997,95:1122~1125.
