人骨髓间充质干细胞TGFβ-1基因沉默对肝癌细胞的影响
2015-02-25李天然赵绍宏周军魏正茂霍天龙卢光明
李天然, 赵绍宏, 周军, 魏正茂, 霍天龙, 卢光明
(1. 南京军区福州总医院第一附属医院 放射科, 福建 莆田, 351100;
2. 北京大学人民医院 放射科, 北京, 100044;
3. 解放军总医院第一附属医院 放射科, 北京, 100048;
4. 南京总医院 放射科, 江苏 南京, 210002)
人骨髓间充质干细胞TGFβ-1基因沉默对肝癌细胞的影响
李天然1,3, 赵绍宏1, 周军1, 魏正茂2, 霍天龙2, 卢光明4
(1. 南京军区福州总医院第一附属医院 放射科, 福建 莆田, 351100;
2. 北京大学人民医院 放射科, 北京, 100044;
3. 解放军总医院第一附属医院 放射科, 北京, 100048;
4. 南京总医院 放射科, 江苏 南京, 210002)
摘要:目的探讨人骨髓间充质干细胞(hMSC)TGFβ-1基因沉默对对肝癌细胞的影响。方法构建TGFβ-1为靶向基因的mRNA和siRNA表达质粒,病毒转染。Transwell 法检测MHCC97-H侵袭能力。细胞计数法 (CCK-8)检测细胞增殖能力。PCR检测肿瘤转移相关因子OPN表达,并分析与肿瘤侵袭的关系。结果hMSC基因沉默成功, TGFβ-1表达降低。共培养实验结果显示,实验组MHCC97-H细胞的增殖能力前后比较无显著(P>0.05)。侵袭性实验结果显示,实验组具有明显的促进肝癌细胞侵袭的作用(P<0.05), 且hMSC组较TGFβ-1沉默hMSC组更能促进肝癌细胞侵袭的作用(P<0.001)。共培养后肿瘤细胞的OPN表达下降。肿瘤细胞的OPN表达与肿瘤细胞的侵袭性呈显著正相关。结论TGFβ-1基因沉默对肝癌细胞的增殖能力无明显影响,对肝癌细胞的侵袭能力具有明显促进作用,肝癌细胞OPN表达变化不是肝癌侵袭能力变化的关键因子。
关键词:人骨髓间充质干细胞; 基因沉默; 骨桥蛋白; 高转移潜能肝癌细胞
Influence of TGFβ-1 gene silencing of human bone
肿瘤细胞的生长和转移涉及多基因变化和相互作用,生长和转移抑制基因可能在抑制肿瘤转移过程中发挥重要作用。人肿瘤转化生长因子基因(TGF)其作用包括调节细胞增殖和转移。TGF家族中TGFβ-1对肿瘤细胞的生长具有促进和抑制双重生物学效应,在肿瘤发生早期, TGFβ-1通过抑制肿瘤细胞生长而抑制转移的发生,随着肿瘤的发展, TGFβ-1转变成肿瘤生长刺激因子,促进转移[1-2]。基于TGFβ-1生物学特性,本研究设计利用基因修饰技术将骨髓间充质干细胞(hMSC)中的TGFβ-1基因沉默,使hMSC低表达TGFβ-1,观察经基因修饰的hMSC对高转移潜能肝癌细胞的影响,为基于自体干细胞移植的生物治疗提供探索性研究。
1材料与方法
1.1实验用细胞株、仪器与试剂
人骨髓间充质干细胞(hMSC)由赛业(广州)生物科技有限公司提供,人高转移潜能肝癌细胞(MHCC97-H), 购自上海复旦大学肝癌研究所提供。倒置显微镜(OLYMPUS公司1X71), 二氧化碳孵箱(Nuaire公司NU4750E)。转染试剂: Lipofectamine 2000,转染细胞: 293FT, 培养液: H-DMEM+10% FBS,转染混合液: Opti-MEMI。
1.2质粒构建
构建以人TGFβ-1为靶向基因的mRNA和siRNA表达质粒, pLenti X1 Puro-shTGFβ-1-eGFP, 以绿色荧光蛋白(GFP)为报告基因。
1.3病毒包装
取细胞状态良好,处于对数生长期的293FT细胞,细胞计数后,按照每个10 cm的培养皿5×106个细胞数接种于培养皿中, 37 ℃, 5% CO2的培养箱中培养过夜; 24 h转染前去除旧的培养液,加入5 mL新鲜的含10%血清DMEM培养液;制备DNA-Lipofectamine 2000复合物。将DNA-Lipofectamine 2000复合物逐滴添加到293FT细胞中,轻轻地前后摇晃培养皿以混匀复合物。放置37 ℃、5% CO2饱和湿度培养箱中过夜培养;转染后24 h, 更换10 mL含10%血清DMEM培养液。放置37 ℃、5%CO2饱和湿度培养箱中继续培养;转染后48 h收集培养上清进行浓缩;加入10 mL新鲜的培养液继续培养,转染后72 h再次收集浓缩。
1.4结晶紫染色计算病毒滴度
去除培养液,用PBS洗涤细胞2次。加入中性甲醛,每孔0.5 mL, 固定30 min; 去除中性甲醛,用PBS洗涤细胞2次,加入结晶紫染色液(6孔板每孔0.5 mL), 并放置室温孵育10 min; 去除染色液,用PBS洗涤细胞2次;计数被染成蓝色的克隆数目,并计算病毒滴度。
1.5MHCC97-H与hMSC/shTGFβ-1转导
细胞的共培养实验方法
研究分为实验组和对照组。 实验组设2组,MHCC97-H细胞与hMSC共培养组,和MHCC97-H细胞与shTGFβ-1基因沉默hMSC共培养组,空白对照组为MHCC97-H细胞与培养基共培养。
1.5.1Transwell法MHCC97-H侵袭能力检测:取BD基质胶,用完全培养基稀释,按8.68 μg/cm2的浓度铺至Transwell六孔板的上室, 37 ℃孵育2 h, 吸去BD基质胶。复苏肝癌细胞MHCC97-H培养,常规培养48 h, 换液,备用。hMSC或hMSC/shTGFβ-1培养培养至第3代,备用。实验组将培养hMSC或hMSC/shTGFβ-1按1×106浓度接种于Transwell共培养系统下室,再将Transwell的上室置于孔中,在上室内接种MHCC97-H细胞,使上下室的培养液相互融通,建立起hMSC或hMSC/shTGFβ-1与MHCC97-H细胞的共培养体系。对照组MHCC97-H按1×106浓度接种于Transwell共培养系统的上室,Transwell下室加入单纯DMEM培养基为对照。实验组与对照组实验细胞培养48 h,分别取出共培养上室,吸去上室的培养基,并用PBS洗2次;用预冷的多聚甲醛固定上室的细胞,室温固定30 min, 吉姆萨染色30 min后,用纯净水漂洗干净,计数上室迁移至Matrigel膜下的细胞数,显微镜下随机选取5个视野进行拍摄(200倍),计数每个视野的平均细胞数量,细胞计数作为MHCC97-H细胞侵袭能力检测的指标。
1.5.2细胞计数(Cell Counting Kit-8)法MHCC97-H增殖能力检测:待下室细胞(hMSC或hMSC/shTGFβ-1)均贴壁后,96孔板上室每孔2×103的细胞量进行接种MHCC97-H细胞,共培养48 h后,取出上室板,每孔加入8 μL的CCK-8溶液, 37 ℃孵育4 h, 孵育完毕后,进行吸光度值(OD)450 nm读数。
1.6实时定量基因扩增荧光检测系统qPCR
检测
首先检测经TGFβ-1基因修饰的hMSC TGFβ-1的表达。然后,检测经基因修饰的hMSC与MHCC97-H细胞共培养前后转移相关因子OPN的表达变化。
1.6.1引物设计序列:引物序列来自GenBank数据库,由赛业(广州)生物科技公司合成。
① 以人肌动蛋白β-Actin作为内参照物(internal control)
Forward primer: 5′-GCAGAAGGAGATCACAGCCCT-3′;
Reverse primer: 5′-GCTGATCCACATCTGCTGGAA-3′。
② 人肿瘤生长因子(TGFβ-1):
Forward primer: 5- AGTGGTTGAGCCGTGGAG-3
Reverse primer: 5-TGCAGTGTGTTATCCCTGCT-3;
③ 人骨桥蛋白(OPN):
Forward primer: 5′-TCACCAGTCTGATGAGTCTCAC-3′;
Reverse primer: 5′-CAGGTCTGCGAAACTTCTTAGAT-3′
1.6.2实验方法: MHCC97-H细胞的RNA提取,细胞裂解,加入200 μL氯仿,离心; 吸取400 μL上层水相,加入500 μL的异丙醇,离心,去废液,加入1 mL无水乙醇洗涤RNA沉淀;离心,去废液;加入20 μL DEPC水溶解RNA沉淀。合成cDNA:在去除了DNA污染的RNA样品中加入oligo (dT)18 primer 1 μL, 70 ℃孵育5 min; 按照顺序加入: 5× reaction buffer 4 μL; 10 mmol/L dNTP mix 2 μL; RiboLock RNase Inhibitor (20 U/μL) 1 μL; 37 ℃孵育温浴5 min; 加入RevertAid M-MuLV Reverse Transcriptase (200 U/μL) 1 μL; 42 ℃孵育60 min, 70 ℃孵育10 min。特异性引物聚合酶链反应(PCR)扩增相应的cDNA。PCR条件: 预变性95 ℃, 5 min; 变性94 ℃, 30 s, 退火58 ℃, 30 s, 延伸72 ℃, 30 s, 共40个循环, 最后72 ℃, 10 min。PCR产物电泳并经凝胶电泳处理系统扫描半定量分析。
2结果
2.1TGFβ-1基因沉默hMSC实验结果
qPCR检测TGFβ-1沉默基因hMSC前后TGFβ-1基因表达: 以hMSC组TGFβ-1表达为100%, TGFβ-1沉默基因hMSC表达为83.83%, 差异有统计学意义(P<0.001), 表明hMSC基因沉默成功。
2.2CCK-8法检测hMSC及基因沉默hMSC
细胞对MHCC97-H细胞增殖能力的影响
以MHCC97-H细胞作为空白对照,TGFβ-1基因沉默hMSC组OD值(0.303±0.02), hMSC共培养组(0.36±0.04), 空白对照组(0.31±0.07), 组间比较无显著差异(F=2.274,P=0.137), 两实验组与对照组比较均无显著差异(见图1)。
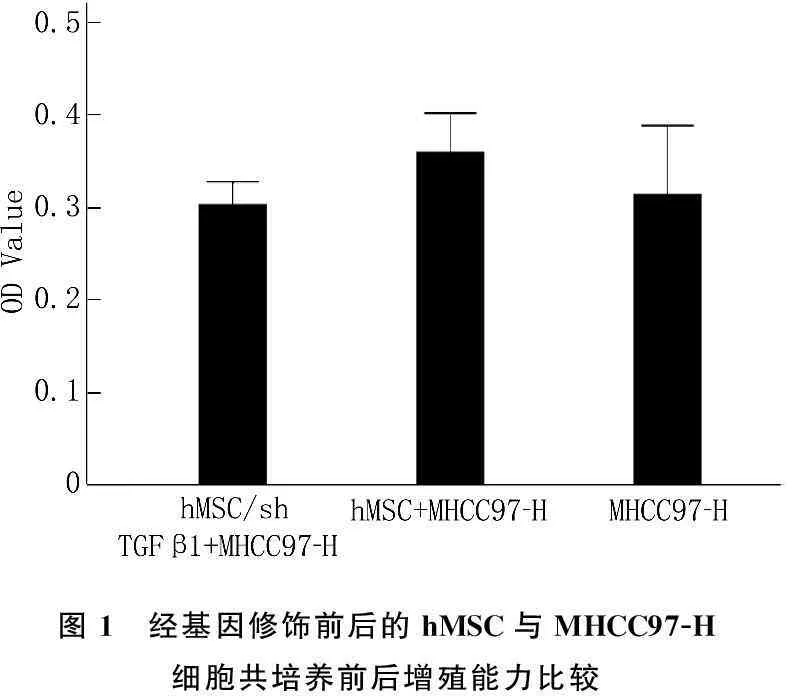
图1 经基因修饰前后的hMSC与MHCC97-H细胞共培养前后增殖能力比较
结果显示,hMSC与MHCC97-H细胞共培养后,与对照组比较无显著差异(P>0.05), TGFβ-1沉默hMSC组与MHCC97-H细胞培养后,与对照组比较无显著差异(P>0.05)。表明经基因修饰前后的hMSC对MHCC97-H细胞增殖能力无影响。
2.3Transwell法hMSC及TGFβ-1沉默hMSC
细胞对MHCC97-H细胞侵袭能力的影响
采用细胞计数法进行定量。TGFβ-1基因沉默hMSC组侵袭细胞数(52.00±12.52)个/视野,hMSC共培养组(70.33±19.11), 空白对照组(27.00±7.80), 组间比较有显著差异(F=14.617,P=0.000), 两组实验组与对照组比较均有显著差异(P< 0.05)(见图2)。
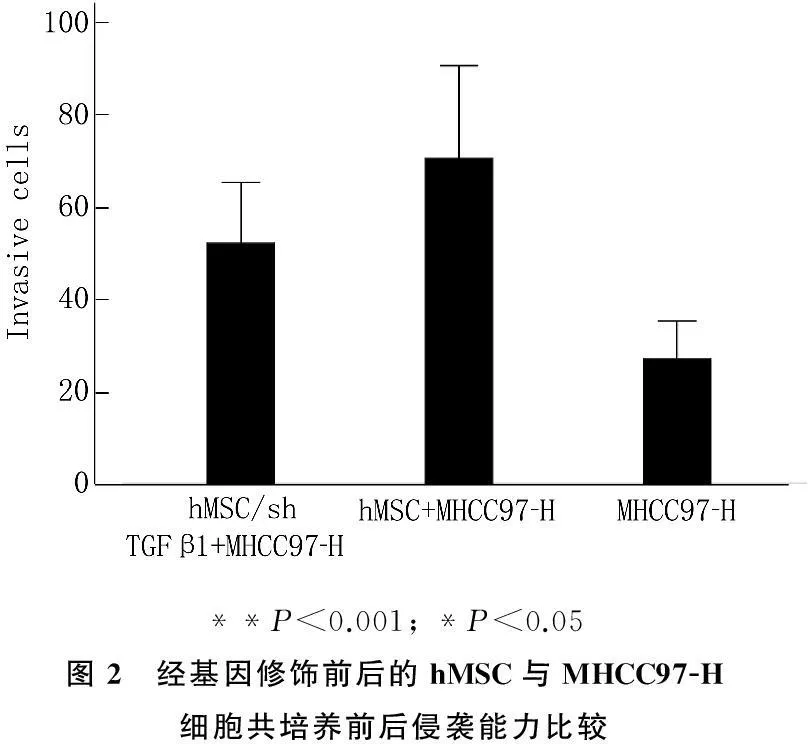
**P<0.001;*P<0.05图2 经基因修饰前后的hMSC与MHCC97-H细胞共培养前后侵袭能力比较
结果显示, hMSC与MHCC97-H细胞共培养后,与对照组比较具有明显的促进肝癌细胞侵袭的作用(P<0.001), TGFβ-1沉默hMSC组与MHCC97-H细胞培养后,与对照组比较也具有促进细胞侵袭的作用(P<0.05), 且hMSC较TGFβ-1沉默hMSC组更能促进肝癌细胞侵袭的作用(P<0.05)。
2.4TGFβ-1沉默hMSC与MHCC97-H共培养前后, MHCC97-H细胞侵袭结果与转移相关因子OPN表达间的相关性分析
PCR结果显示,共培养后MHCC97-H细胞OPN表达均有所下降,以MHCC97-H细胞表达为100%, hMSC共培养组OPN表达为63.96%, shTGFβ-1沉默hMSC组为17.10%。shTGFβ-1沉默hMSC组MHCC97-H细胞OPN表达与侵袭细胞数量呈明显的正相关性(r=0.865,P=0.026); hMSC组MHCC97-H细胞OPN表达与侵袭细胞数量呈明显的正相关性(r=0.945,P=0.004)(见图3)。
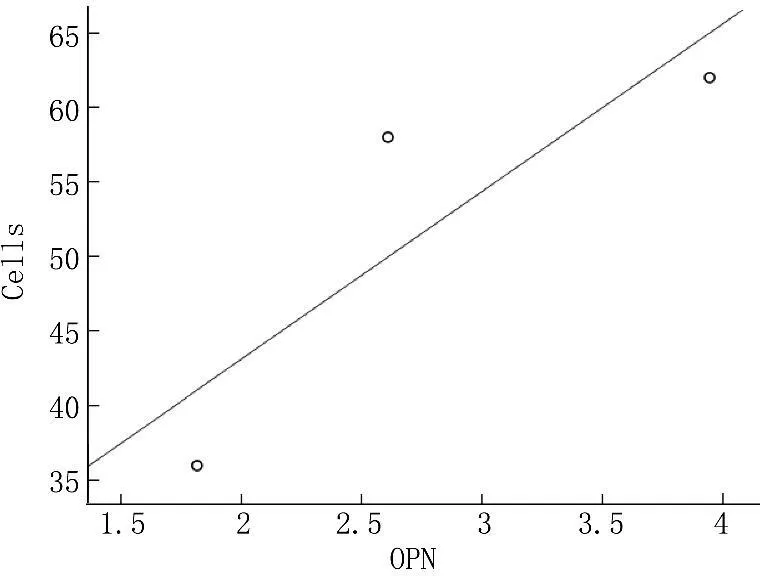
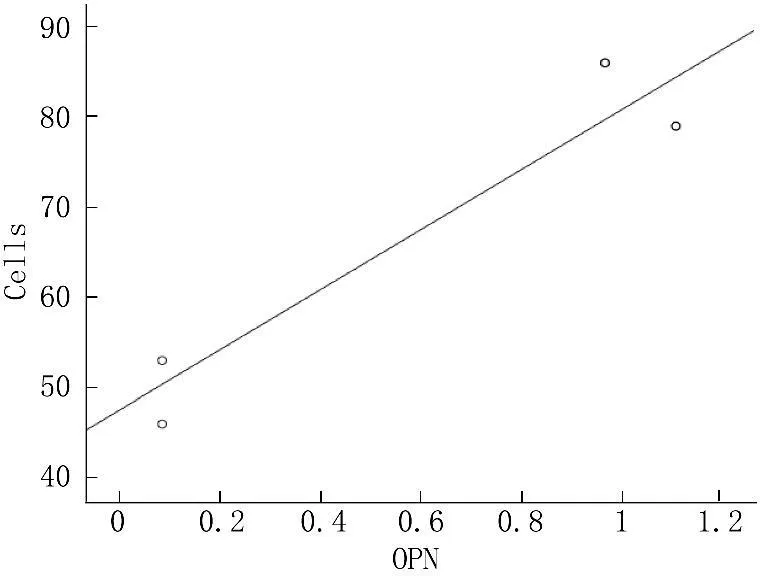
图3MHCC97-H细胞OPN表达与侵袭细胞数量的相关散点图
结果显示, hMSC在基因修饰前后共培养后影响MHCC97-H细胞OPN的表达。OPN与MHCC97-H细胞的侵袭数量呈明显的正相关性。
3讨论
siRNA干扰是从mRNA水平阻断功能基因表达的新技术,在基因功能的研究和临床靶向治疗中的应用日益广泛[3-5]。对hMSC进行基因修饰,观察经基因修饰的hMSC对肿瘤的影响,为以自体干细胞移植为重点的生物治疗提供基础实验依据[6]。转化生长因子β1(TGFβ-1)是一种具有多种功能的细胞因子。研究认为TGFβ是细胞生长抑制因子,可抑制上皮细胞的增殖,对细胞周期的调控是TGFβ细胞生长抑制作用的重要机制,对于不同类型的细胞调控的具体机制也不同,细胞逃逸TGFβ的生长抑制作用而导致细胞增殖失控、肿瘤发生[7]。然而,肿瘤发生后, TGFβ成为促进肿瘤生长的因子,TGF-β主要通过免疫抑制逃逸、增加血管生成、增加肿瘤细胞与胞外基质的相互作用来促进肿瘤的侵袭和转移[8-9]。
基于hMSC是基因良好载体这一特性,通过基因修饰技术改变hMSC细胞中TGFβ-1基因,使TGFβ-1因子表达下降,观察经基因修饰的hMSC细胞对高转移潜能肝癌细胞(MHCC97-H)的影响。实时PCR检测结果显示实验组hMSC中TGFβ-1表达下降,表明hMSC中TGFβ-1基因沉默成功。本实验结果显示,hMSC在TGFβ-1基因沉默前后对MHCC97-H细胞增殖能力无明显影响,表明外源性TGFβ-1表达(hMSC分泌)变化对肿瘤细胞(MHCC97-H)增殖无明显作用,这与文献报道的肿瘤患者主要是通过TGFβ-1的自分泌促进肿瘤细胞的生长的结论相一致[10-11], 只有MHCC97-H细胞分泌的内源性TGFβ-1因子的变化才会影响肿瘤细胞的增殖。也有研究[12]认为,肿瘤表面TGFβ受体缺失或功能异常,导致TGFβ-1正常促进或抑制肿瘤增殖的功能失调。
Transwell侵袭小室技术是利用Matrigel模拟天然基底膜结构,观察具有侵袭和迁移能力的细胞在趋化剂诱导下穿过多孔滤膜的情况[13-14]。MHCC97-H侵袭性实验结果显示,MHCC97-H与hMSC细胞共培养后,侵袭能力明显增强, TGFβ-1基因沉默hMSC对MHCC97-H侵袭能力仍然明显高于空白对照组,表明hMSC具有促进肝癌细胞侵袭的作用[15]。肿瘤细胞的侵袭能力依赖于细胞间连接的丢失和成纤维细胞特性的获得, 此过程被称为上皮间质转化(EMT)[16]。TGF-β信号通路介导的EMT被认为促进了肿瘤细胞的侵袭和转移。TGF-β通过上调细胞外基质纤溶酶激活因子(PA), 如尿激酶(uPA)降解细胞外基质,促进肿瘤细胞的转移[17-18]。因此,外源性的TGF-β可能通过上述因子,促进实验中Matrigel膜的溶解起到促进细胞侵袭的作用。
OPN检测结果提示, OPN与肿瘤的侵袭性呈正相关,这与文献报道相一致[19-20]。在本研究中,共培养后, MHCC97-H细胞OPN表达下降,而肿瘤细胞的侵袭性明显增高,说明肿瘤侵袭行为是多因素共同作用的结果,非单一因素作用结果。
参考文献
[1]Bollard C M, Rossing C, Calonge M J, et al. Adapting a transforming growth factor beta related tumor protection strategy to enhance antitumor immunity[J]. Blood, 2002, 99(9): 3179.
[2]Meulmeester E, Ten Dijke P. The dynamic roles of TGFβ in cancer[J]. The Journal of Pathology, 2011, 223(2): 205.
[3]Xiang D, Shigdar S, Qiao G, Zhou S, et al. Aptamer-Mediated Cancer Gene Therapy[J]. Curr Gene Ther, 2014, 23: Epub ahead of print.
[4]Baumann V, Winkler J. miRNA-based therapies: strategies and delivery platforms for oligonucleotide and non-oligonucleotide agents[J]. Future Med Chem, 2014, 6(17): 1967.
[5]Chou S T, Mixson A J. siRNA nanoparticles: the future of RNAi therapeutics for oncology[J]. Nanomedicine (Lond), 2014, 9(15): 2251.
[6]Vainshtein J M, Kabarriti R, Mehta K J, et al. Bone marrow-derived stromal cell therapy in cirrhosis: clinical evidence, cellular mechanisms, and implications for the treatment of hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2014, 89(4): 786.
[7]柳洋,文继舫,郑长黎. TGFβ与细胞周期调控的研究进展[J]. 国外医学·生理、病理科学与临床分册, 2003, 23(5): 541.
[8]王旭东, 战忠利. TGF-β及其受体与肿瘤的研究进展[J]. 2005, 32(17): 1016.
[9]Tuxhorn J A, M cAlhany S J, Yang F, et al. Inhibition of transforming growth factor-beta activity decreases angiogenesis in a human prostate cancer-reactive strom a xenograft model[J]. Cancer Res, 2002, 62(21): 6021.
[10]Nemunaitis J, Barve M, Orr D, et al. Summary of bi-shRNA/GM-CSF augmented autologous tumor cell immunotherapy (FANG) in advanced cancer of the liver[J]. Oncology, 2014, 87(1): 21.
[11]马云宝, 叶文华. 消化系恶性肿瘤血清转化生长因子-α水平检测的临床意义[J].苏州医学院学报, 2000, 20(3): 251.
[12]李晓燕, 刘炬, 张玲. 转化生长因子β受体与肿瘤.中国肿瘤生物治疗杂志, 1999, 6(1): 58.
[13]顾靓, 张阳德, 赵劲风. RNA干扰沉默mTOR基因对肝癌HepG2细胞增殖和凋亡的影响[J]. 海南医学院学报, 2011, 17(1): 42.
[14]林莉, 林美玲. 联合检测血清中ADA、GGT和AFU对肝癌患者诊断的临床意义[J]. 海南医学院学报, 2011, 17(3): 328.
[15]刘利英, 黄辰, 李宗芳, 等. STAT1和STAT2在磷脂酰乙醇胺诱导肝癌HepG2细胞生长抑制中的作用[J]. 南方医科大学学报, 2011, 31(2): 256.
[16]Yang M C, Wang C J, Liao P C, et al. Hepatic stellate cells secretes type I collagen to trigger epithelial mesenchymal transition of hepatoma cells[J]. Am J Cancer Res, 2014, 4(6): 751.
[17]Com ijn J, Berx G, V erm assen P, et al. The two-handed E box binding zinc finger protein SIP1 downregulates E-cadherin and induces invasion[J]. Mol Cell, 2001, 7(6): 1267.
[18]Dhanasekaran R, Nakamura I, Hu C, et al. Activation of the TGFβ/SMAD transcriptional pathway underlies a novel tumor promoting role of sulfatase1 in hepatocellular carcinoma[J]. Hepatology, 2014, 12: Epub ahead of print.
[19]Ye Q H, Qin L X, Forgues M, et al. Predicting hepatitis B virus-positive metastatic hepatocellular carcinomas using gene expression profiling and supervised machine learning[J]. Nat Med, 2003, 9(4): 416.
[20]Iqbal J, McRae S, Mai T, et al. Role of hepatitis C virus induced osteopontin in epithelial to mesenchymal transition, migration and invasion of hepatocytes[J]. PLoS One, 2014, 9(1): e87464.
marrow mesenchymal stem cells on liver cancer cells
LI Tianran1,3, ZHAO Shaohong1, ZHOU Jun1,
WEI Zhengmao2, HUO Tianlong2, LU Guangming4
(1.DepartmentofRadiology,TheFirstAffiliatedHospitalofFuzhouGeneralHospital
ofNanjingMilitaryCommand,Putian,Fujian, 351100; 2.DepartmentofRadiology,
ThePeople′sHospitalofPekingUniversity,Beijing, 100044; 3.DepartmentofRadiology,
TheFirstAffiliatedHospitalofGeneralHospitalofPeople′sLiberationArmy,Beijing,
100048; 4.DepartmentofRadiology,NanjingGeneralHospital,Nanjing,Jiangsu, 210002)
ABSTRACT:ObjectiveTo explore the influence of TGFβ-1 gene silencing of human bone marrow mesenchymal stem cells (hMSC) on liver cancer cells. MethodsExpression plasmid of mRNA and siRNA by taking TGFβ-1 for targeted gene was constructed and infected by virus. Transwell assay was used to evaluate invasive ability of MHCC97-H cells. CCK-8 assay was used to evaluate proliferative capacity of MHCC97-H. PCR assay was used to detect OPN expression of MHCC97-H cells, and its correlation with the tumor invasion was analyzed as well. ResultsThe gene silencing was successful. Down-regulation of TGFβ-1 expression was observed in experimental group. Co-culture results showed that there was no significant difference of proliferative capacity of the MHCC97-H cells before and after trial in the experimental group(P>0.05). Invasive experiment results showed that the experimental group had a significant function on promotion of MHCC97-H cell invasion
福建省自然基金资助项目(2013J01392)
(P<0.05), and hMSC group had a more significant function on promotion of MHCC97-H cell
invasion than TGFβ-1 hMSC group(P<0.001). OPN expression of MHCC97-H cells decreased after co-culture. The OPN expression of tumor cells was positively correlated with tumor cell invasion. ConclusionTGFβ-1 gene silencing has no significant effect on proliferation ability of MHCC97-H cell, but has significant effect on invasive ability of MHCC97-H cell. Change of OPN expression in liver cancer cell is not the key factor of invasion ability change of liver cancer.
KEYWORDS:human bone marrow mesenchymal stem cells; gene silencing; osteopontin; high metastatic potential of hepatocellular carcinoma cells
通信作者:卢光明, E-mail: cjr.luguangming@vip.163.com
基金项目:国家自然科学基金资助项目(81271607); 南京军区医药卫生重点项目资助(11Z035);
收稿日期:2014-11-23
中图分类号:R 735.7
文献标志码:A
文章编号:1672-2353(2015)03-010-05
DOI:10.7619/jcmp.201503003
