二甲双胍在不同葡萄糖浓度下对小鼠黑色素瘤细胞B16增殖的影响
2015-02-24李亚平夏美慧马丽伟骆伟麟于慧美
李亚平,孙 月,夏美慧,马丽伟,谢 奇,骆伟麟,于慧美*
(1.吉林省人民医院 皮肤科,吉林 长春130021;2.吉林大学基础医学院;3.吉林大学第一医院 妇产科)
二甲双胍在不同葡萄糖浓度下对小鼠黑色素瘤细胞B16增殖的影响
李亚平1,孙月2,夏美慧3,马丽伟2,谢奇2,骆伟麟2,于慧美2*
(1.吉林省人民医院 皮肤科,吉林 长春130021;2.吉林大学基础医学院;3.吉林大学第一医院 妇产科)
(ChinJLabDiagn,2015,19:0536)
黑色素瘤常见于中老年人,男性多发于女性,常见于下肢、足部、躯干、头颈部和上肢,症状主要表现为迅速增大的黑色素结节[1]。近年来,肿瘤与代谢性疾病之间的关系逐渐成为研究的热点。二甲双胍是临床广泛应用的降糖药物,用于II型糖尿病的治疗,其降血糖效果和安全性得到普遍认可[2]。近年来的研究认为,该药物在调节机体糖类代谢的同时,还具有一定程度的抑制肿瘤细胞生长的作用。研究显示,体内胰岛素水平能促进肿瘤细胞生长并影响肿瘤的预后,而二甲双胍与其他降糖药相比更能降低糖尿病患者肿瘤的发生率[3]。目前,关于二甲双胍与肿瘤的研究多针对于肺癌等,且机制尚未明确[3,4]。缺乏关于二甲双胍及葡萄糖缺乏对黑色素瘤的研究。本研究通过分析二甲双胍在不同糖条件下对小鼠黑色素瘤细胞B16形态、细胞生存率、凋亡及线粒体膜电位的影响,为今后的研究提供一定的理论基础。
1材料与方法
1.1 试剂与细胞
小鼠黑色素瘤细胞B16购自中国科学院上海细胞生物学研究所,胎牛血清购自美国Clark公司,RPMI-1640培养基购自美国Uibco公司,MTT购自美国Sigma公司,Hoechst33342染料购自碧云天生物技术研究所,Annexin V-PI细胞凋亡检测试剂盒购自南京凯基生物公司。B16细胞株用含10%新生牛血清的RPMI-1640培养液在37℃,5% CO2的孵箱内孵育培养,以0.4 %胰酶消化传代,隔2 d传代1次,取对数生长期细胞分组进行实验。
1.2 方法
1.2.1实验分组细胞随机分组,分别加入不同浓度的葡萄糖(25 mM、4 mM、3 mM、2 mM、1 mM),分别选择葡萄糖高剂量组(25 mM)合加二甲双胍(0、10 mM、20 mM、40 mM),葡萄糖低剂量组(1 mM)合加二甲双胍(0、10 mM、20 mM、40 mM)。
1.2.2MTT法检测细胞存活率B16细胞消化离心后,按1×104个/孔接种于96孔板,37℃,5% CO2培养箱中培养20-24 h,使细胞达到对数生长期。待细胞融合度达到80%左右,设立对照组以及不同浓度葡萄糖及二甲双胍组,每个浓度6个重复孔,CO2培养箱中作用24 h后每孔加入20 μl MTT,继续孵育4 h,弃掉孔板中的培养液,每孔加150 μl二甲基亚矾(DMSO),孔板振荡器振荡15 min,充分溶解结晶物。在BIO TEK酶标仪上,选择490 nm波长,测定96孔板各孔光吸收值,记录结果,计算细胞存活率。对照组细胞存活率为100%,其余各组存活率=(各浓度组A值/对照组A值)×100%。
1.2.3Annexin V-PI检测细胞凋亡率B16细胞按1×107个/孔接种于培养瓶中,置于37℃,5% CO2的恒温二氧化碳细胞培养箱中培养20-24 h。待细胞达到80%左右融合时,加入不同浓度葡萄糖及二甲双胍,继续培养24 h。弃掉培养液,PBS洗涤2-3次,按凯基Annexin V-FITC细胞凋亡检测试剂盒说明书操作,先加入Annexin V,混匀后再加入PI,混匀后,利用流式细胞仪分析各组细胞的凋亡率。
1.2.4Western blot检测Cyt C表达水平蛋白浓度按试剂盒说明书操作。酶标仪测量630 nm不同孔OD值,绘制标准曲线从而计算出各组样本蛋白浓度。利用加样器向加样孔中缓慢加入蛋白样本。转膜结束后将PVDF膜放入5%脱脂奶粉中封闭1-2 h。封闭结束后用PEST洗PVDF膜3次,每次5 min,倒掉PEST将PVDF膜放人自封袋中加入Cyt C一抗,4℃冰箱中过夜。回收一抗,PEST洗膜3次,加入二抗(1∶1 000比例),室温1 h。回收二抗,PEST洗膜3次,DAB显色液显色,当看到目标带后将膜放人蒸馏水内中止显色。拍照后封存,灰度值扫描分析。
1.3 统计学方法
本实验数据分析采用SPSS16.0版统计软件进行处理。
2结果
2.1 葡萄糖对B16细胞存活率的影响
B16细胞接种于96孔板后培养过夜,加入含有不同浓度葡萄糖的1640培养液及血清继续培养24 h,采用MTT法检测不同浓度葡萄糖对B16细胞存活率的影响。与对照组(25 mM)相比,葡萄糖浓度4 mM、3 mM、2 mM、1 mM时细胞生存率分别为(74.57±2.52)%、(63.29±4.36)%、(61.61±2.33)%和(56.54±1.56)%,均随着葡萄糖浓度的降低而降低,且呈剂量依赖性(图1)。
2.2 葡萄糖对B16细胞形态的影响
利用倒置显微镜观察不同葡萄糖浓度对B16细胞形态的影响。显微镜下可以观察到,在25 mM葡萄糖浓度下,B16细胞形态饱满,呈多角形,随着葡萄糖浓度的降低,细胞形态逐渐变的皱缩细长,尤其是在1 mM葡萄糖条件下,与25 mM葡萄糖相比,视野中细胞数量显著减少,细胞变小,形状更加细长(图2)。
2.3 二甲双胍在不同葡萄糖浓度下对B16细胞存活率的影响
分别采用25 mM和1 mM葡萄糖与不同浓度二甲双胍联合作用B16细胞24 h,比较不同葡萄糖条件下二甲双胍对B16细胞存活率的影响。MTT结果显示,不同葡萄糖条件下,二甲双胍都能抑制B16细胞的增殖率(图3)。
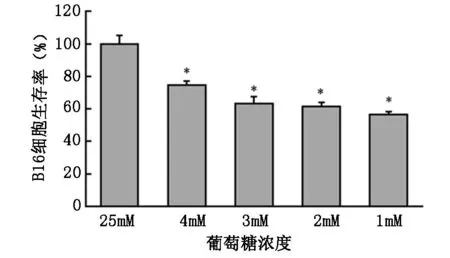
图1不同葡萄糖浓度对小鼠黑色素瘤
细胞B16生存率的影响

A:25 mM葡萄糖B:4 mM葡萄糖C:2 mM葡萄糖D:1 mM葡萄糖
图2不同葡萄糖浓度对小鼠黑色素瘤
细胞B16形态的影响

图3 不同二甲双胍浓度对小鼠黑色素瘤
2.4 二甲双胍在不同葡萄糖浓度下对B16细胞凋亡的影响
分别采用25 mM及1 mM葡萄糖联合10 mM二甲双胍作用细胞24 h,Annexin V-PI 检测B16细胞细胞凋亡率。实验结果显示,与对照组即25 mM葡萄糖组(2.62±2.89)%相比,1 mM葡萄糖组细胞凋亡率为(44.15±2.29)%,25 mM葡萄糖+10 mM二甲双胍组细胞凋亡率为(22.18±3.72)%,1 mM葡萄糖+10 mM二甲双胍凋亡率为(61.54±2.84)%,凋亡率最高(图4)。

图4 Annexin V-PI 检测观察B16细胞凋亡率
2.5 二甲双胍在不同葡萄糖浓度下对B16细胞Cyt C表达的影响
分别采用25 mM及1 mM葡萄糖联合10 mM二甲双胍作用细胞24 h,Western blot方法检测B16细胞Cyt C的表达水平。结果显示,与对照组即25 mM葡萄糖组相比,1 mM葡萄糖组Cyt C表达水平略有上调。25 mM葡萄糖+10 mM二甲双胍组Cyt C无明显变化,1 mM葡萄糖+10 mM二甲双胍组Cyt C表达水平显著上调(图5)。
3讨论
黑色素瘤是由异常黑素细胞过度增生引发的常见的皮肤肿瘤,恶性程度非常高,是皮肤肿瘤致死的主要原因之一[5]。主要多发生于皮肤或接近皮肤的黏膜,其发病率随人种、地域、种族的不同而有所差异,白种人的发病率远较黑种人高[6],我国虽属黑色素瘤的低发区,但近年来发病率却呈不断上升趋势,逐渐引起医疗工作者的关注[7]。本研究首先探讨了葡萄糖对B16细胞生存率的影响。研究结果显示葡萄糖能够抑制B16细胞的增殖,并呈现剂量依赖性,随着葡萄糖浓度的降低,B16细胞增殖率显著降低。这说明葡萄糖是B16细胞生存所必需。这为从糖饥饿角度治疗黑色素瘤提供理论基础。
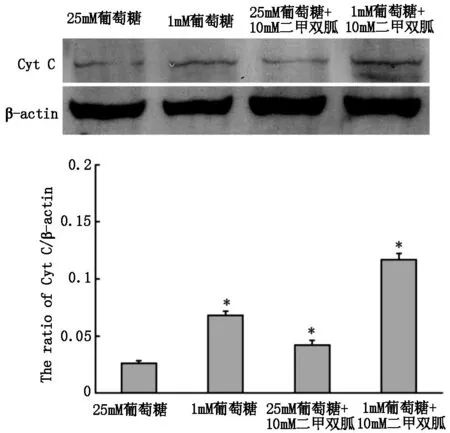
图5 Western blot检测B16细胞Cyt C表达水平
二甲双胍作为经典的治疗糖尿病的药物,其在临床上的应用价值正不断得到发掘。近年来,研究者发现,二甲双胍除了能够改善2型糖尿病患者的血糖控制外,还潜在地降低某些癌症发病风险,并有可能改善某些合并癌症2型糖尿病患者的预后。越来越多从流行病学到临床研究等方面为二甲双胍的抗肿瘤作用提供证据。其可能的抗肿瘤作用机制包括以下方面:①改善高血糖和高胰岛素血症状态[8];②抑制细胞线粒体的电子转移,抑制氧化磷酸化,导致细胞凋亡[9];③激活AMP 激活蛋白激酶(AMPK),抑制哺乳动物的雷帕霉素靶蛋白(mTOR)[10]。④通过抑制CyclinD1表达而纠正AGEs 诱导的细胞周期紊乱[11]。本研究结果显示,无论在正常葡萄糖浓度(25 mM)还是低糖(1 mM)浓度下,二甲双胍均可以显著抑制B16细胞增殖率,这可能是由于二甲双胍抑制了B16细胞对葡萄糖的摄取。
线粒体细胞色素C具有调控细胞能量代谢和凋亡的双重功能,它既通过对细胞能量代谢的调节,
调控细胞死亡方式;又能通过对凋亡信号的传导和放大作用,直接介导细胞凋亡。本实验结果显示无论是低糖条件还是联合二甲双胍均能促进Cyt C的表达,这也从另一方面提示二甲双胍可能通过抑制葡萄糖吸收在调控细胞能量代谢过程中发挥作用。
综合以上结果显示,二甲双胍在不同葡萄糖浓度下通过细胞凋亡的方式引起小鼠黑色素瘤细胞B16生存率下降,而二甲双胍可能通过抑制葡萄糖摄取,促进细胞线粒体细胞色素C释放引起细胞凋亡,这为从糖摄取及能量代谢方面治疗黑色素瘤提供实验与理论依据。
参考文献:
[1] Tronnier M,Mitteldorf C.Treating advanced melanoma:current insights and opportunities[J].Cancer Manag Res,2014,6:349.
[2]Singh AK:Deciding oral drugs after metformin in type 2 diabetes:An evidence-based approach[J].Indian J Endocrinol Metab,2014,18(5):617.
[3]Li D.Metformin as an antitumor agent in cancer prevention and treatment[J].J Diabetes,2011,3(4):320.
[4]Zhang ZJ,Bi Y,Li S,et al.Reduced risk of lung cancer with metformin therapy in diabetic patients:a systematic review and meta-analysis[J].Am J Epidemiol,2014,180(1):11.
[5]Carless MA,Griffiths LR.Cytogenetics of melanoma and nonmelanoma skin cancer[J].Adv Exp Med Biol,2008,624:227.
[6]Eggermont AM,Robert C.New drugs in melanoma:it's a whole new world[J].Eur J Cancer,2011,47(14):2150.
[7]杨华,郑勤.恶性黑色素瘤的免疫治疗现状与进展[J].现代肿瘤医学,2011,19(11):2341.
[8]Del Barco S,Vazquez-Martin A,Cufi S,et al.Metformin:multi-faceted protection against cancer[J].Oncotarget,2011,2(12):896.
[9]Fujita Y,Hosokawa M,Fujimoto S,et al.Metformin suppresses hepatic gluconeogenesis and lowers fasting blood glucose levels through reactive nitrogen species in mice[J].Diabetologia,2010,53(7):1472.
[10]Kourelis TV,Siegel RD.Metformin and cancer:new applications for an old drug[J].Med Oncol,2012,29(2):1314.
[11]二甲双胍对胃癌细胞株增生及Cyclin+D1表达的影响[J].国际外科学杂志,2010,37(3):171.
摘要:目的研究二甲双胍在不同葡萄糖浓度下对小鼠黑色素瘤细胞B16增殖的影响并初步探讨其可能机制。方法体外培养小鼠黑色素瘤细胞B16,采用不同糖浓度和二甲双胍浓度作用,光镜下观察细胞形态,MTT法检测细胞生存率, 流式细胞术检测细胞凋亡率,Western blot检测Cyt C表达。结果与对照组相比,随着糖浓度的降低,B16细胞形态变的皱缩细长,细胞生存率逐渐降低并呈浓度剂量依赖性。在正常糖浓度和低糖浓度下,二甲双胍均能抑制细胞生存率,随着二甲双胍浓度的增高,细胞凋亡率显著增加,Cyt C表达水平增高。结论葡萄糖是小鼠黑色素瘤细胞B16细胞生存所必需条件之一,二甲双胍在不同糖条件下均能显著抑制B16细胞的生长,可能通过改变线粒体稳定性促进细胞凋亡。
关键词:二甲双胍;葡萄糖;细胞增殖;细胞凋亡
Effect of Metformin and Glucose on the proliferation in mouse melanoma B16 cellsLIYa-ping,SUNYue,XIAMei-hui,etal.(People′sHospitalofJilinProvince,Changchun130021,China)
Abstract:ObjectiveTo study the effect of Metformin and Glucose on the proliferation in mouse melanoma B16 cells and discuss its functional mechanism.MethodsB16 cells were cultured with different concentration of metformin and glucose in vitro.Cells morphology,viability,apoptosis and the expression of Cyt C protein were evaluated by light microscopy,MTT assay,flow cytometry and western blot respectively.ResultsCompared with the control group,morphology of B16 cells became wrinkled elongated,and the cell viability decreased in a concentration dose-dependent manner with the decrease of sugar concentration.Under normal glucose concentration and sugar concentration,metformin inhibited cell survival,significantly increased apoptosis rate,increased expression level of Cyt C.ConclusionGlucose is necessary for cell survival conditions of mouse melanoma B16 cells,metformin could significantly inhibit the growth of B16 cells and promote apoptosis by altering mitochondria under different sugar conditions.
Key words:Metformin;Glucose;Cell proliferation;Cell apoptosis
收稿日期:(2014-06-20)
文献标识码:A
中图分类号:R739.5
文章编号:1007-4287(2015)04-0536-04
通讯作者*
基金项目:吉林省卫生厅课题(20122Z126) ;中国博士后基金(2013M540256);吉林省科技厅青年基金(20140520018JH)
