卡培他滨同步放化疗用于胃癌术后50例疗效分析
2015-02-24张晕生赵成会王艳美张学惠李艳丽刘志伟
张晕生,赵成会,王艳美,尚 华,张学惠,李艳丽,张 进,刘志伟
(河北省秦皇岛市第四医院,河北 秦皇岛 066000)
卡培他滨同步放化疗用于胃癌术后50例疗效分析
张晕生,赵成会,王艳美,尚 华,张学惠,李艳丽,张 进,刘志伟
(河北省秦皇岛市第四医院,河北 秦皇岛 066000)
目的 探讨口服卡培他滨同步放射治疗(简称放疗)、化学治疗(简称化疗)对比单纯化疗作为胃癌术后辅助治疗的疗效及安全性。方法 将100例进展期胃癌术后,术后分期为T3,T4和(或)N+的胃-食管交界处或胃腺癌患者随机分为两组。A组于放疗第1天开始口服卡培他滨825 mg/m2,2次/日化疗,连服2周后休息1周,第21天重复1次;放疗采用6MV-X直线加速器,CT模拟定位,三维适形精确放疗技术(DT45~50.4)Gy,180 cGy/次,5次/周。B组接受6周期卡培他滨+奥沙利铂方案化疗,其中卡培他滨1 000 mg/m2每日2次,第1~14天;第1天静脉注射奥沙利铂130 mg/m2,第3~4周重复1次。结果 A组1,2,3年总生存率、平均生存时间均高于B组;血液学毒性及外周神经毒性较B组发生率低。结论 胃癌患者术后口服卡培他滨同步放化疗可提高患者生存期,安全性较好,患者可耐受。
胃癌;卡培他滨;同步放化疗;疗效;不良反应
胃癌是常见的恶性肿瘤,尽管其发病率在近十几年间呈下降趋势,但在世界每年新发肿瘤中仍占10%,并占所有死亡病例的12%[1]。中国为胃癌的高发地区,发病率高于欧美,死亡率在大城市中居恶性肿瘤第2位(男性)和第3位(女性)[2]。手术是胃癌的主要治疗手段,但局部晚期胃癌根治术后5年生存率较低,局部区域复发和转移是胃癌根治术后失败的主要原因,发生率达50% ~70%。术后采用各种形式的辅助治疗尤为重要。笔者针对进展期胃癌术后患者,评估术后同步卡培他滨方案联合放射治疗(简称放疗)与单纯化学治疗(简称化疗)的临床疗效及安全性。现报道如下。
1 资料与方法
1.1 一般资料
选取我院2008年1月至2013年1月就诊的100例进展期胃癌D0/D1根治术后患者。术后病理诊断均为腺癌;术后分期T3,T4和(或)N+;肿瘤部位包括远端胃癌 52例,近端胃癌 48例;病理类型包括低分化腺癌40例,中分化腺癌17例,高分化腺癌24例,未分化腺癌19例;临床分期根据TNM分期,包括Ⅲa 42例,Ⅲb 58例。将100例患者随机分为A组和B组,各50例。两组患者的临床资料见表1,比较无统计学差异(P>0.05),具有可比性。

表1 两组患者一般资料比较(n=50)
1.2 方法
患者接受治疗的时间均为术后2~4周,治疗前均行胸、腹、盆腔CT检查以排除局部复发和远处转移者;肝肾功能、离子、血常规、肿瘤标志物均在正常范围。A组于放疗第1天开始口服卡培他滨(上海罗氏制药有限公司,国药准字H20073024,每片0.5 g)825 mg/m2,每日2次,化疗,连服2周后休息1周,第21天重复1次,治疗结束后1个月接受2~4周期的单纯化疗方案。放疗,采用6MV-X直线加速器,CT模拟定位,三维适形精确放疗技术(3D-CRT,DT45~50.4)Gy,每次180 cGy,5次/周;要求患者在胃排空状态下进行定位和治疗,照射野包括瘤床(根据术前上消化道造影、CT、影像学资料或根据术中放置银夹确定)、部分残余胃,外侵的周围组织和器官、区域淋巴结为照射野,注意保护肝、胰腺及十二指肠等危及器官。B组术后给予6周期卡培他滨 +奥沙利铂方案化疗,其中卡培他滨1 000 mg/m2,每日2次,第 1~14天奥沙利铂(江苏恒瑞医药股份有限公司,国药准字H20000337,规格为每支50 mg)130 mg/m2,第1天静脉注射,第3~4周重复1次。放疗毒副反应评估参照美国肿瘤放射治疗协作组织(RTOG)评定标准,化疗毒副反应评估按世界卫生组织(WHO)的评定标准。截至2013年6月,随访6~40个月,中位时间30个月,随访率100%。
1.3 统计学处理
用SPSS 15.0软件处理,计数资料采用 χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表4。近期毒副反应主要表现为Ⅲ级以上血液学毒性,A组较B组低。为缓解血液毒性反应,给予中药升血或重组人集落细胞刺激因子治疗,肝功能损害给予保肝治疗后均可完成治疗计划。
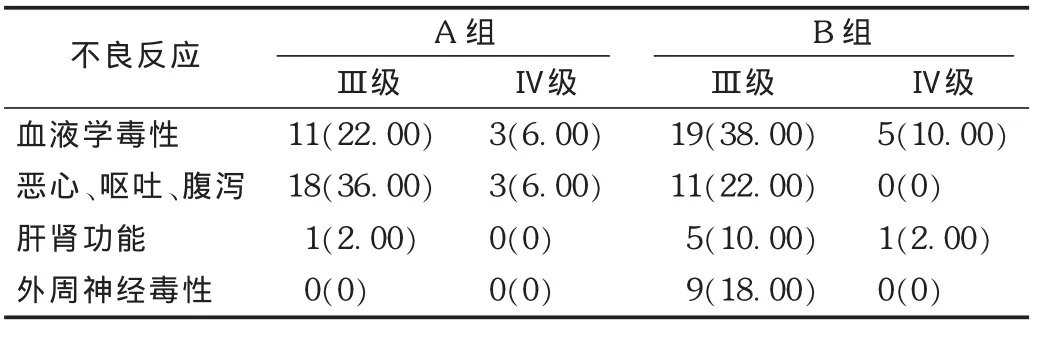
表2 两组患者不良反应发生情况比较[例(%),n=50]

表3 两组患者生存率比较(%)

表4 术后两组复发转移情况[例(%),n=50]
3 讨论
腹腔内复发是胃癌根治术失败最主要的原因,对经过临床二次手术、尸检确诊转移的病例进行分析,局部区域复发最常见(瘤床和区域淋巴结),占22% ~99%,腹腔种植转移占17% ~50%[3]。国外报道,胃癌根治术后复发率达50% ~70%,单纯术后患者5年生存率仅10% ~20%[4]。因此,中晚期胃癌术后治疗方式的选择会对患者的生存产生直接影响。
以往认为,胃癌对放疗不敏感,仅用于姑息性止痛止血治疗,这是因为胃周围毗邻多个主要器官,如肝脏、肾脏、胰腺及肠道,从而限制了胃癌的放疗的应用。目前研究认为,胃腺癌与其他上皮细胞恶性肿瘤一样,对放疗较化疗更敏感,放疗能够覆盖更多、更广的组织[5]。给予40~45 Gy的照射剂量对于控制亚临床病灶有效,而这一剂量用于上腹部是安全的[6]。计算机的发展与应用推动了放疗设备的发展与进步,精确放疗(适行、调强)的诞生使放射线治疗肿瘤发生了革命性变化。放疗新技术3D-CRT和MRT的应用,是以CT扫描为基础的多野适形照射,可以优化靶区内的剂量分布,同时降低靶区周围重要组织器官的受照射剂量;MRT显示出更多的优势,可以更好地保护重要组织器官,提高患者对放疗的耐受性,降低毒副反应的发生率及发生程度。美国INT0116号研究是胃癌术后辅助性同步放化疗的里程碑,彻底颠覆了胃癌传统的治疗模式,提出局部晚期胃癌患者接受D0/D1手术后的同步放化疗具有明显的生存优势,可以提高无复发生存率和远期生存率的结论[7]。之后,同步放化疗成为北美胃癌根治术后具有高危因素患者必须的辅助治疗手段。由本研究结果可见,术后分期为T3,T4、和(或)N+的胃-食管交界处或胃腺癌患者,3年无复发生存率、平均生存期均明显提高。Macdonald等[8]Ⅲ期随机对照临床试验证实了胃癌术后放化疗的可行性和临床疗效,2004年,ASCO会议已提出胃癌术后同步放化疗的标准方案,美国国家综合癌症网(NCCN)指南将同步放化疗作为胃癌术后标准治疗 1及推荐[9]。2005年,Kim[10]用同步放化疗治疗胃癌标准D2根治术后患者544例,同步放化疗明显提高了生存率,进一步确立了同步放化疗在胃癌根治术中的地位。临床上大部分胃癌患者就诊时已处于中晚期,手术难以彻底切除,或者有淋巴结转移和胰腺浸润,所以术后放疗非常重要。但单纯术后放疗只能提高局部的控制率,不能解决远处转移的问题,且局部控制欠佳。大量研究表明,胃癌单纯手术以及术后单放疗或单化疗对于提高生存率并未有太大帮助[11-12]。同步放化疗治疗胃癌的观点目前趋于一致,肯定了放化疗对胃癌的敏感性,目前已成为肿瘤的标准治疗模式。
奥沙利铂是继顺铂碳铂之后的第3代铂族金属抗肿瘤药物,已在全球60多个国家使用[13]。卡培他滨本身无细胞毒性,但可转化为具有细胞毒性的5-氟尿嘧啶(5-FU),其结构通过相关性血管因子胸苷磷酸化酶在肿瘤所在部位转化而成,从而最大限度地降低了5-FU对人体细胞的损害,且口服给药方便。本研究中A组的毒性反应主要是血液学毒性,较 B组发生率低,给予粒细胞集落刺激因子与治疗后均可纠正并完成治疗疗程。胃肠道反应表现为恶心、呕吐、腹泻,A组较B组无明显增加。部分患者虽有轻重不等的胃肠道不良反应,经辅助治疗及对症处理绝大部分都能缓解,无1例出现胃穿孔和肠坏死。
综上所述,胃癌术后卡培他滨同步放化疗疗效好,治疗费用相对较低,值得基层医院推荐应用。但因样本量较少,有待于临床实践进一步验证。
[1]Parkin DM,Pisani P,Ferlay J,et al.Global cancer statistics[J].Ca Cancer J Clin,1999,49(1):33-64.
[2]Nation Comprehensive Cancer Network.Clinical practice guide lines in oncology:Gastric Cancer(Chinese edition)[J].2010:27.
[3]殷蔚伯,余子豪,徐国镇,等.放射肿瘤学[M].第4版.北京:中国协和医科大学出版社,2008:808.
[4]Henning GT,Schild SE,Stafford SL,et al.Results of irradiation or chemoirradiation following resection of gastric adenocarcinoma[J].Int J Radiat Oncol Biol Phys,2000,46(3):589-598.
[5]Glimelius B.Role of adjuvant chemoradiotherapy for abdominal malingnancies[J].Dig Surg,2003,20(3):169-179.
[6]Powers BE,Gillette EL.Effects of irradiation on the supportive tissues of the gastrointestinal tract[M]//Potten CS,Hendry JH.Radiation and gut.New York:Elsevier Science,1995:221-229.
[7]王 鑫,金 晶.局部晚期胃癌术后同步放化疗研究进展[J].实用肿瘤杂志,2011,26(3):225.
[8]Macdonald JS,Smalley SR,Benedetti J,et al.Chemoradiotherapy after
surgery compared with surgery alone for adonocarcinoma of the stomach or gastroesophageal junction[J].N Engl J Med,2001,345(10):725-730.
[9]顾阳春,马力文,王俊杰.胃癌术后同步放化疗进展[J].癌症进展,2012,10(2):154.
[10]Kim S,Lim DH,Lee J,et al.An observational study suggesting clinical benefit fou adjuvant postoperative chemoradiation in a population of over 500 cases after gastric resection with D2 nodal dissection for adenocarcinoma of the stomach[J].Int J Radiat Oncol Biol Phys,2005,63(5):1 279-1 285.
[11]Hallissey MT,Dunn JA,Ward LC,et al.The second British stomach cancer group trial of adjuvant radiothcrapy or chemotherapy in resectable gatric cancer:five-years follow-up[J].Lancet,1994,343(8 909):1 309-1 312.
[12]Guzel Z,Szawlowski A,Jezioski K,et al.Postoperative radiotherapy for gastric cancer[J].Eur J Cancer,1999,35(suppl 4):S154.
[13]彭 娟,普绍平,栾春芳,等.铂类抗癌药物奥沙利铂原料药的稳定性研究[J].中国药业,2011,20(1):3-5.
R969.4;R979.1
A
1006-4931(2015)05-0065-03
2014-04-11;2次
2014-10-21)
