CLIC4在饥饿诱导神经胶质瘤细胞自噬中的作用
2015-02-24袁兆新张宏宇计国义
袁兆新,高 寒,池 明,张宏宇,计国义
(1.长春医学高等专科学校,吉林 长春130031;2.温州医科大学药学院;3.吉林大学中日联谊医院 泌尿外科)
CLIC4在饥饿诱导神经胶质瘤细胞自噬中的作用
袁兆新1,高寒1,池明1,张宏宇2,计国义3*
(1.长春医学高等专科学校,吉林 长春130031;2.温州医科大学药学院;3.吉林大学中日联谊医院 泌尿外科)
摘要:目的通过饥饿诱导人神经胶质瘤细胞发生自噬,利用siRNA技术部分沉默细胞内氯通道蛋白4(CLIC4),探讨CLIC4在细胞自噬中的作用。方法根据CLIC4的基因序列构建CLIC4 siRNA质粒,建立稳定转染CLIC4 siRNA的U251细胞株,分析CLIC4 蛋白表达;MTT法检测转染pSH1Si-CLIC4对细胞生存率的影响;利用Western Blot检测转染CLIC4 siRNA在U251细胞凋亡相关蛋白Bax、Bcl-2表达;检测饥饿条件下U251细胞LC3蛋白、Bax、Bcl-2的表达;检测抑制CLIC4表达对于饥饿条件下细胞白caspase-3和胞浆cytc以及LC3的表达。结果Western Blot显示,与空质粒对照组相比,转染CLIC4 siRNA的U251细胞CLIC4表达显著下降;与对照组相比,转染空质粒细胞组以及瞬时转染pSH1Si-CLIC4载体细胞组U251细胞生存率均无明显差异;单纯CLIC4 siRNA对于U251细胞Bax、Bcl-2表达无影响;与对照组相比,饥饿8 h能够诱导U251细胞自噬,LC3水平显著增加,而细胞Bax、Bcl-2表达无明显变化;转染CLIC4 siRNA后饥饿8 h,caspase-3、cytc以及LC3表达增加。结论单纯CLIC4 siRNA对于U251细胞自噬和凋亡均无显著影响,饥饿条件下U251细胞发生自噬的同时并没有明显细胞凋亡过程,抑制CLIC4表达促进了饥饿条件下的U251细胞自噬,同时能够启动线粒体相关途径的细胞凋亡。
(ChinJLabDiagn,2015,19:0707)
程序性细胞死亡是多细胞动物的一种重要死亡途径,包含了多种生物进程如形态的形成、保持、组织内环境稳定等,以清除机体中有害的细胞[1]。近来研究表明,凋亡并不是PCD唯一形式,另外一种细胞死亡形式被称为自噬性程序性细胞死亡也就是自噬[2]。由于细胞内氯通道家族中只有CLIC4在线粒体上表达,因此也称之线粒体细胞内氯通道[3]。此外CLIC4在细胞核、微丝等不同的细胞器或亚结构上均有表达[4]。有研究表明,CLIC4对于血管生成中的细胞酸化具有调节作用[3],而细胞酸化也是自噬过程中的一个重要指标[5]。因此我们推测,CLIC4蛋白对于维持线粒体功能和结构的稳态具有重要的意义,很可能会影响线粒体的正常生理过程,并进而影响细胞的分化、增殖或者细胞死亡。
1材料与方法
1.1材料pSilencerTM3.1-H1 neo siRNA空载体和pSilencerTM3.1-H1 neo-Scramble siRNA购自美国Ambion公司。
1.2细胞培养人神经胶质瘤细胞株U251,接种于含10%胎牛血清的DMDM培养液中培养。
1.3CLIC4 siRNA模板寡核苷酸设计根据GenBank上的人源的线粒体CLIC4基因序列,确定的RNA干涉靶位点。
1.4细胞生长抑制试验-MTT 设3个阴性对照组,酶标仪进行比色分析。
1.5Western Blot 检测不同实验组别的细胞蛋白Bax、Bcl-2、caspase-3、cytc和LC3表达。

2结果
2.1WesternBlot检测转染pSH1Si-CLIC4的U251细胞CLIC4 蛋白表达如图1所示,转染pSH1Si-CLIC4载体24h、48h的U251细胞,CLIC4表达与空质粒对照组相比明显下降(P<0.01)。
2.2MTT法检测转染pSH1Si-CLIC4对U251细胞生存率的影响如图2所示,与对照组相比,转染
空质粒细胞组以及瞬时转染pSH1Si-CLIC4载体24h和48h细胞组,U251细胞生存率均无明显差异(P>0.05)。
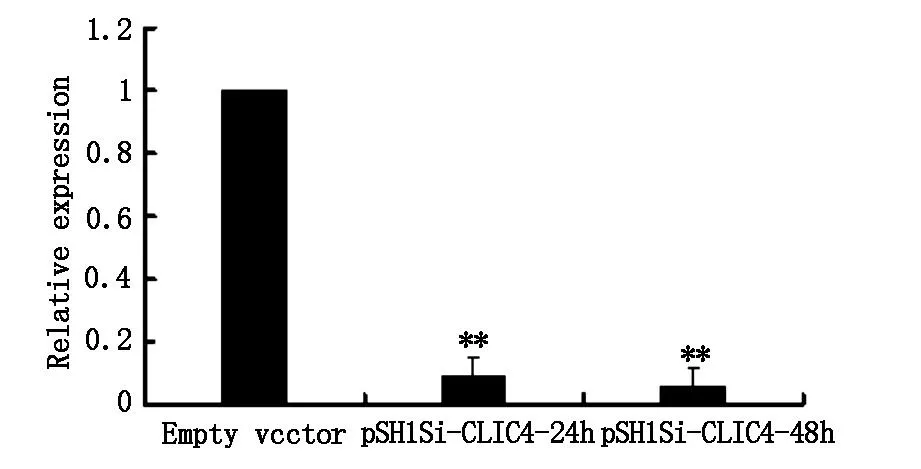
**P<0.01vsemptyvector
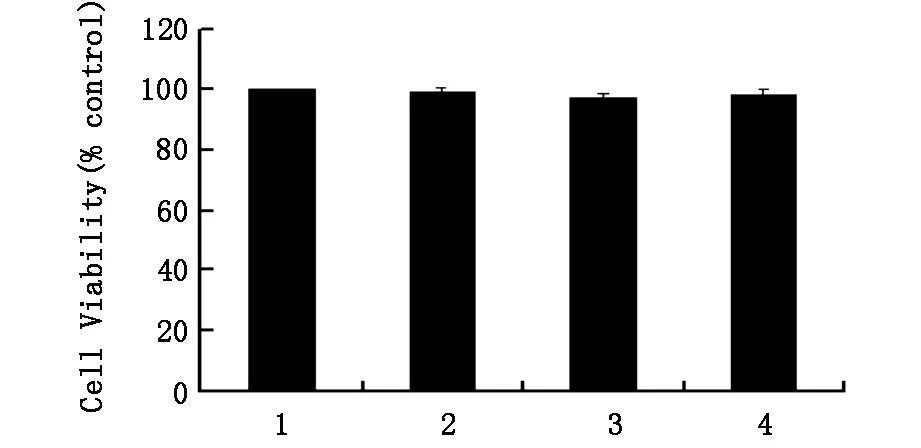
图2 转染pSH1Si-CLIC4对U251细胞生存率的影响
2.3WesternBlot检测检测饥饿条件下U251细胞自噬相关蛋白LC3表达如图3所示,与对照组相比,U251细胞饥饿后LC3-I和LC3-II表达增强(P<0.05),并且随着时间的延长(4h、8h、12h)LC3-II表达进一步增加(P<0.01)。
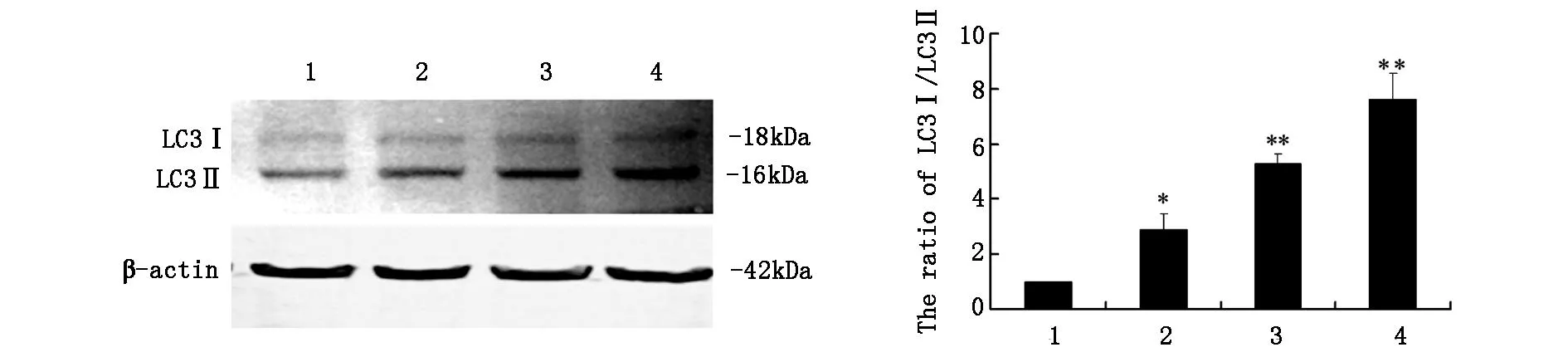
**P<0.01versuscontrol
2.4WesternBlot检测饥饿条件下U251细胞凋亡相关蛋白Bax和Bcl-2表达如图4所示与对照组相比,U251细胞饥饿4h、8h、12h后,Bax和Bcl-2变化不明显。
2.5WesternBlot检测饥饿条件下抑制CLIC4对U251细胞凋亡相关蛋白caspase-3和胞浆cytc表达如图5所示,与对照组相比,U251细胞饥饿8h后cleavedcaspase-3和cytc蛋白表达变化不明显(P>0.05)。在转染CLIC4siRNA后饥饿8h,cleavedcaspase-3和cytc表达增加。
2.6WesternBlot检测饥饿条件下抑制CLIC4表达对U251细胞自噬相关蛋白LC3表达影响如图6所示与对照组相比,U251细胞饥饿8h后LC3-II表达增强。与饥饿组相比,CLIC4siRNA细胞组,饥饿8h后,LC-II表达增强(P<0.05)。
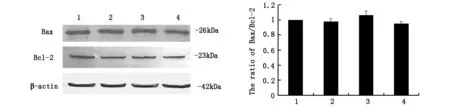
图4 饥饿条件下U251细胞Bax和Bcl-2表达
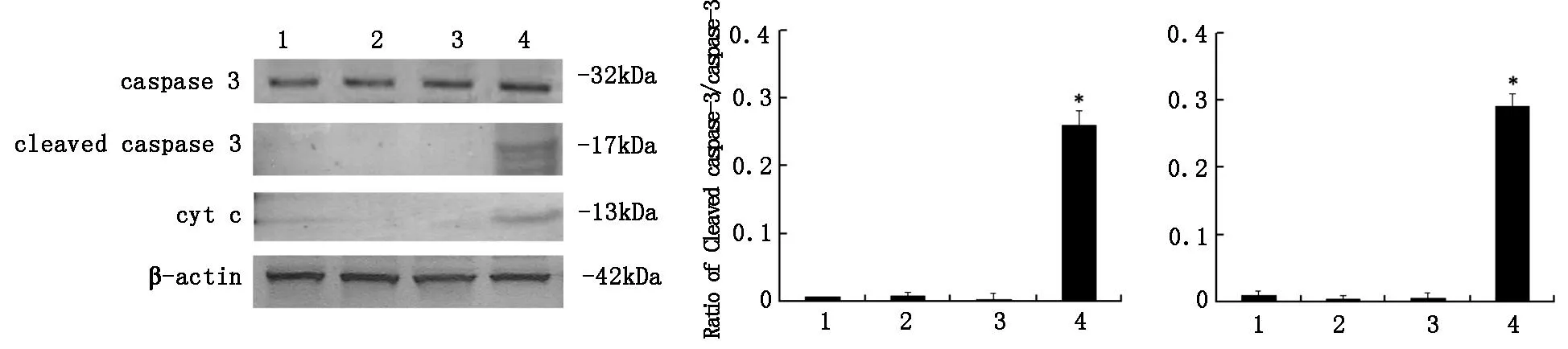
*P<0.01vsstarvationgroup
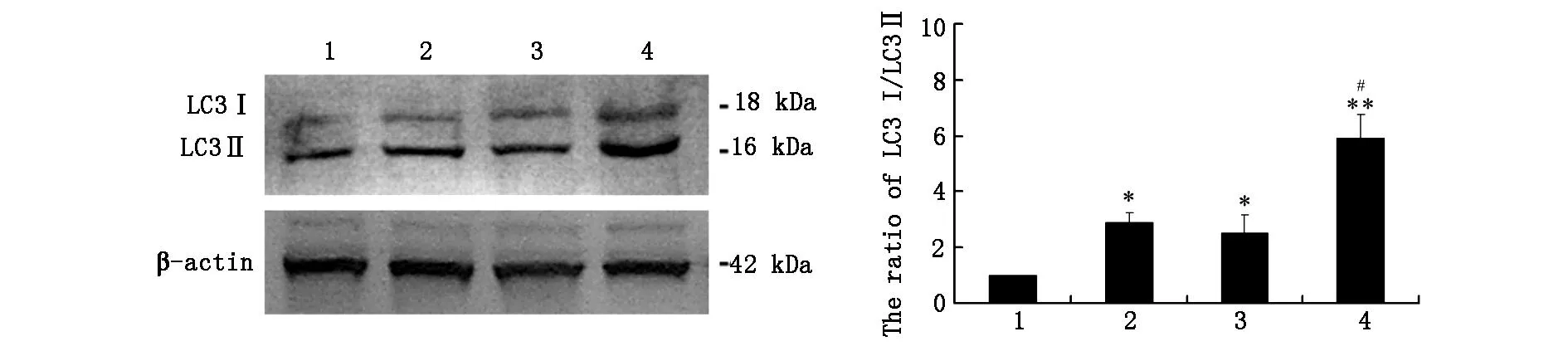
*P<0.05vscontrolgroup,**P<0.01vscontrolgroup,#P<0.05vsemptyvectorgroup
3讨论
恶性胶质瘤是颅内最常见的肿瘤之一,经典的caspase途径细胞凋亡是被广泛认可的抑制肿瘤生长的最有效的方式[6]。而胶质瘤对凋亡相关手段的治疗却十分耐受,因此对于其有效治疗急需一种凋亡之外的新策略[7]。本研究探讨了饥饿诱导的自噬中CLIC4的作用,我们通过构建pSilencerTM3.1-H1neoCLIC4siRNA载体,部分沉默线粒体氯通道CLIC4蛋白。研究结果表明,在正常培养条件下,单纯的CLIC4siRNA对于U251细胞自噬和凋亡均无显著影响。饥饿条件下,U251细胞发生自噬的同时并没有明显的细胞凋亡过程,而沉默CLIC4后促进了饥饿条件下的U251细胞自噬,同时能够启动caspase相关的线粒体途径的细胞凋亡。当沉默CLIC4后的饥饿条件下细胞迅速上调自噬水平或许会在今后神经胶质瘤研究和治疗中具有广阔的前景。
参考文献:
[1]BerrymanMA,GoldenringJR.CLIC4isenrichedatcell-celljunctionsandcolocalizeswithAKAP350atthecentrosomeandmidbodyofculturedmammaliancells[J].CellMotilCytoskeleton,2003,56(3):159.
[2]SuhKS,MutohM,NagashimaK,etal.TheorganellularchloridechannelproteinCLIC4/mtCLICtranslocatestothenucleusinresponsetocellularstressandacceleratesapoptosis[J].JBiolChem,2004,279(6):4632.
[3]XueL,BorutaiteV,TolkovskyAM.Inhibitionofmitochondrialpermeabilitytransitionandreleaseofcytochromecbyanti-apoptoticnucleosideanalogues[J].BiochemPharmacol,2002,64(3):441.
[4]LiuB,ChengY,LiuQ,etal.Autophagicpathwaysasnewtargetsforcancerdrugdevelopment[J].ActaPharmacolSin,2010,31(9):1154.
[5]PattingreS,TassaA,QuX,etal.Bcl-2antiapoptoticproteinsinhibitBeclin1-dependentautophagy[J].Cell,2005,122(6):927.
[6]HaileyDW,RamboldAS,Satpute-KrishnanP,etal.Mitochondriasupplymembranesforautophagosomebiogenesisduringstarvation[J].Cell,2010,141(4):656.
[7]LumJJ,BauerDE,KongM,etal.Growthfactorregulationofautophagyandcellsurvivalintheabsenceofapoptosis[J].Cell,2005,120(2):237.
关键词:胶质瘤细胞;自噬;凋亡;CLIC4
The role of CLIC4 protein in autophagy induced by starvation in glioma cellsYUANZhao-xin,GAOHan,CHIMing,etal.(ChangchunMedicalCollege,Changchun130031,China)
Abstract:ObjectiveTo investigate the mechanism and effects of CLIC4 protein in glioma cells autophagy induced by starvation through siRNA silencing CLIC4.MethodsBased on the gene sequence,CLIC4 siRNA plasmid and stable transfected U251 cells were constructed.The level of CLIC4 expression was analyzed.To detect cell vitality,MTT method was applied.To investigate the effect of CLIC4 siRNA on the apoptosis induced by starvation,the levels of Bax,Bcl-2 were detected.To investigate the effect of CLIC4 siRNA on the apoptosis and autophagy induced by starvation,the levels of cleaved caspase-3,cytosolic cyt c and LC3 were detected.ResultsCompared with the control group,the results indicated that there was obvious decrease of CLIC4 expression in U251 cells with CLIC4 siRNA transfected.MTT results indicated that there was no obvious effect of cell vitality with CLIC4 siRNA transfected There were no obvious changes in protein Bax and Bcl-2 with CLIC4 siRNA transfected U251 cells.Compared with control group,the level of LC3 had a significant increase under starvation in U251 cells at 8 hours.Meanwhile,protein Bax,Bcl-2 had no significant change under starvation.Western Blot indicated cleaved caspase-3,cytosolic cyt c and LC3 expression increased in CLIC4 siRNA transfected U251 cells under starvation.ConclusionThe results showed that CLIC4 siRNA had no effect on cell autophagy and apoptosis.Under starvation,autophagy was detected in U251 cells but no apoptosis.CLIC4 siRNA enhanced the autophagy under starvation,on the same time,triggered caspase-dependent mitochondrial apoptosis.
Key words:Glioma cells,autophagy,apoptosis,CLIC4
(收稿日期:2014-06-08)
文献标识码:A
中图分类号:R363.2
文章编号:1007-4287(2015)05-0707-04
*通讯作者
基金项目:吉林省教育厅“十二五”科学技术研究项目(吉教科文合字2011第363号)
