盐酸贝那普利对胃肠道肿瘤合并高血压、糖尿病患者术后胰岛素抵抗的影响
2015-02-20李国永邵峰山东省卫生教育培训中心济南5004聊城市人民医院
李国永,邵峰(山东省卫生教育培训中心,济南5004;聊城市人民医院)
盐酸贝那普利对胃肠道肿瘤合并高血压、糖尿病患者术后胰岛素抵抗的影响
李国永1,邵峰2
(1山东省卫生教育培训中心,济南250014;2聊城市人民医院)
摘要:目的探讨围术期应用盐酸贝那普利对胃肠道肿瘤合并高血压、糖尿病患者术后胰岛素抵抗的影响。方法将62例胃肠道肿瘤合并高血压、糖尿病患者采用信封法随机分成观察组32例、对照组30例。两组均行开腹手术治疗,术前口服皮下注射胰岛素、术后胰岛素泵入胰岛素控制血糖;两组术前7d均使用盐酸贝那普利(10mg/d)控制血压,观察组术后继续通过鼻肠管或空肠造口或舌下含服用相同剂量盐酸贝那普利控制血压,1次/d,共用12d,对照组不使用。两组分别于术前及术后24、72、144 h用氧化酶法检测空腹血糖(FPG),放射免疫法检测血清空腹胰岛素(FINS),计算胰岛素抵抗指数(HOMA-IR);观察手术前后胰岛素用量、肠功能恢复时间。结果术后24、72 h观察组FPG、lnHOMA-IR低于对照组(P均<0.05),术后第1、2、3天观察组胰岛素用量低于对照组(P均<0.05)。结论围手术期应用盐酸贝那普利可减轻胃肠道肿瘤合并高血压、糖尿病患者的胰岛素抵抗,减少术后胰岛素用量。
关键词:胃肠道肿瘤;盐酸贝那普利;高血压;糖尿病;胰岛素抵抗
随着人口的老龄化,越来越多的胃肠道肿瘤患者合并高血压、糖尿病等疾病,增加了手术的风险和并发症[1~3]。研究发现,高血压患者使用血管紧张素转换酶抑制剂(ACEI)在控制血压的同时可降低患者的胰岛素抵抗(IR),但ACEI对于合并高血压和糖尿病的胃肠道肿瘤患者在手术应激状态下的临床应用却少见报告。本研究进行了相关探讨
1 资料与方法
1.1临床资料2009~2014年聊城市人民医院收治胃肠道肿瘤合并高血压和2型糖尿病患者62例,术前均符合1997年美国糖尿病协会制定的糖尿病诊断标准和1999年WHO及国际高血压协会制定的高血压诊断标准。采用信封法随机分为两组。观察组32例,男18例、女14例,年龄(51±11.8)岁;高血压Ⅱ级17例,Ⅲ级15例;血糖(13.5±2.7)mmol/L,BMI(33.2±2.2)kg/m2,APACHEⅡ评分(10.1±3.5)分;原发病为胃肿瘤10例、结肠肿瘤12例、直肠肿瘤10例。对照组30例,男16例、女14例,年龄(52±12.5)岁;高血压Ⅱ级15例,Ⅲ级15例;血糖(12.8±3.2)mmol/L,BMI(32.7±2.5)kg/m2,APACHEⅡ评分(9.9±2.9)分;原发病为胃肿瘤10例、结肠肿瘤8例、直肠肿瘤12例。两组性别、年龄、APACHEⅡ评分、原发病比较差异无统计学意义。
1.2治疗方法两组均在全麻下行开腹手术治疗,术前皮下注射胰岛素控制血糖,术后使用胰岛素泵泵入胰岛素控制血糖。两组术前7d均口服盐酸贝那普利(10mg/d)控制血压,观察组术后继续通过鼻肠管或空肠造口或舌下含服用相同剂量盐酸贝那普利控制血压,1次/d,共12d,对照组未给予盐酸贝那普利。
1.3观察指标及方法两组分别于术前及术后24、72、144 h空腹抽血5mL,使用氧化酶法检测空腹血糖(FPG);采用放射免疫法检测血清空腹胰岛素(FINS),使用稳态模式评估法计算IR指数(HOMA-IR),HOMA-IR = FPG×FINS/22.5,因HOMA-IR不呈正态分布,取对数化的HOMA-IR,即lnHOMA-IR[1]。统计两组术前及术后胰岛素的用量。
1.4统计学方法采用SPSS11.0统计软件。计量资料用±s表示,比较采用t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1两组手术前后FPG、FINS、lnHOMA-IR比较见表1。
2.2两组手术前后胰岛素用量比较见表2。
表1 两组手术前后FPG、FINS、lnHOMA-IR比较()
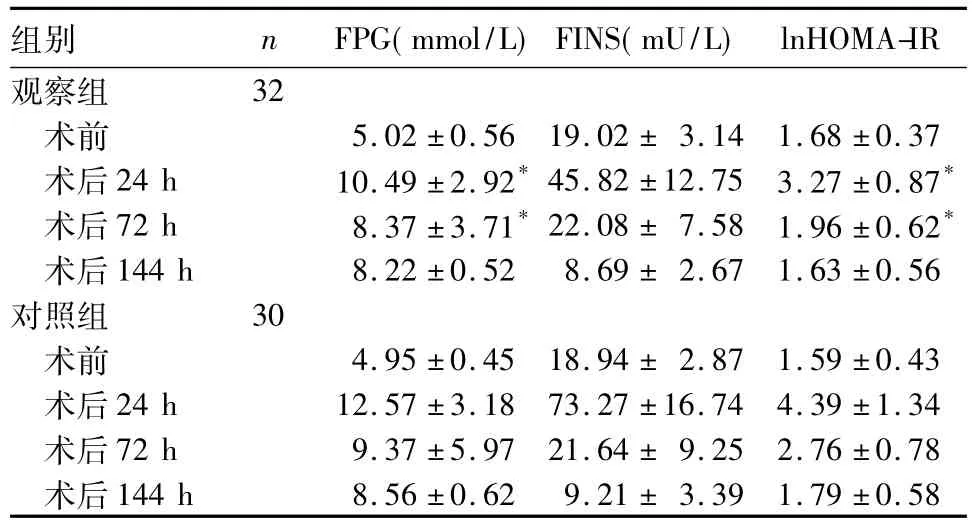
表1 两组手术前后FPG、FINS、lnHOMA-IR比较()
注:与对照组同时间比较,*P<0.05。
组别 n FPG(mmol/L)FINS(mU/L)lnHOMA-IR观察组32术前 5.02±0.56 19.02±3.14 1.68±0.37术后24 h 10.49±2.92*45.82±12.75 3.27±0.87*术后72 h 8.37±3.71*22.08±7.58 1.96±0.62*术后144 h 8.22±0.52 8.69±2.67 1.63±0.56对照组 30术前 4.95±0.45 18.94±2.87 1.59±0.43术后24 h 12.57±3.18 73.27±16.74 4.39±1.34术后72 h 9.37±5.97 21.64±9.25 2.76±0.78术后144 h 8.56±0.62 9.21±3.39 1.79±0.58
3 讨论
目前临床仍将ACEI作为糖尿病合并高血压治疗的首选药物。它不仅能安全有效降低血压,同时可降低心血管事件的发生率,改善机体对胰岛素的敏感性,减轻IR[4]。手术创伤后由于应激反应,机体产生高代谢和一系列碳水化合物的代谢改变,引起IR,即发生“应激性糖尿病”[5]。时间长、创伤大的手术患者更容易发生IR,IR是反映手术创伤程度的一个指标。Monzilly等[6]曾对术后24 h内患者的IR进行研究,发现外科大手术早期存在显著的应激性高血糖,机体利用葡萄糖能力下降。朱岭等[7]的研究证明,较大的手术创伤可能造成长时间的IR,不利于患者恢复。IR直接引起高血糖,而术后高血糖已是公认的导致术后并发症的危险因素之一[8,9]。本研究表明,术后早期患者IR明显增强,但是术后继续使用盐酸贝那普利患者IR增强程度低于对照组。这说明ACEI类药物对于胃肠道肿瘤合并糖尿病、高血压患者在应激状态下能起到降低IR的作用;同样,随着应激水平基本恢复正常,术后144 h两组FPG、lnHOMA-IR以及术后第6、12天的胰岛素用量趋于一致。
表2 两组手术前后胰岛素用量比较(U,)

表2 两组手术前后胰岛素用量比较(U,)
注:与对照组同时间比较,*P<0.05。
组别 n胰岛素用量术前 术后第1天 术后第2天 术后第3天 术后第4天 术后第5天 术后第6天 术后第12天观察组 32 30.6±2.3 75.5±8.78* 66.5±8.5* 58.1±7.9* 52.6±4.6* 48.6±4.6*42.7±5.6 32.8±5.6对照组 30 29.8±1.8 86.1±7.68 73.5±5.8 67.6±8.6 57.6±5.6 49.6±4.6 43.5±6.5 31.3±4.7
胃肠道肿瘤合并糖尿病择期手术和限期手术患者,术前随机血糖应控制在5.6~11.0mmol/L[10]。对于腹部手术糖尿病患者,应选择胰岛素微泵连续输注治疗,使血糖浓度控制在4.4~6.1mmol/L较为合适[11],但是IR加重了血糖控制的难度。杨飞等[12]认为,手术并发症与血糖水平有关,血糖水平维持在8mmol/L以上时术后并发症的发生率为15%,且并发症大多都发生在术后2周内。本研究证实,对于择期手术的糖尿病患者,即便术前使血糖控制在满意范围,手术后因IR的发生,血糖也会变的不易控制;并发现糖尿病患者术后胰岛素的用量比术前有明显升高。胰岛素用量和IR呈正相关性,即IR越重,血糖越难以控制。而使用ACEI控制血压可以减少胰岛素的使用量。
胃肠道肿瘤合并高血压﹑糖尿病患者在手术创伤情况下出现了超常应激反应的糖代谢异常,加重了患者的IR,增加了患者的血糖控制难度。我们的研究证实,ACEI类药物在控制血压的同时对于严重应激反应下的糖代谢异常和IR依然有效,并能减少术后胰岛素的使用量。尽管ACEI类药物降低患者IR的具体机制目前尚不明确,我们仍建议胃肠道肿瘤合并高血压﹑糖尿病患者围术期处理过程中,选择降压药物时优先考虑ACEI。
参考文献:
[1]Haffner SM,Kennedy E,Gonzalez C,et al.A prospective analysis of the HOMAmodel.Themexico Citydiabetes Study[J].Diabetes Care,1996,19(10): 1138-1141.
[2]Poch E,Giner V,NunezdG,et al.Association of the G protein beta3 subunit T allete with insulin resistance in essential hypertension[J].Clin Exp Hyperten,2002,24(5): 345-353.
[3]Horikawa Y,Oda N,Cox NJ,et al.Genetic variation in the gene encoding calpain-10 is associated with type 2diabetesmellitus[J].Nat Gent,2000,26(2): 163-175.
[4]Schafers RF.Diuretic therapy of hypertensives with Type 2diabetes; rational therapy ormalpractice[J].Ther Umsch,2000,57(6):368-373.
[5]Thorell A,Nygren J,HirshmanmF,et al.Surgery-induced insulin resistance in human patients: relation to glucose transport and utilization[J].Am J Physiol,1999,276(4Pt1): E754-E761.
[6]Monzillo LU,Hamdy O.Evaluation of insulin sensitivity in clinical practice and in research settings[J].Nutr Rev,2003,61(12):397-412.
[7]朱岭,彭开勤,全卓勇,等.胰岛素抵抗与手术创伤程度关系的临床研究[J].中华外科杂志,2005,15(2): 12-16.
[8]vanden Berghe G,Wouters P,Weekers F,et al.Intensive insulin therapy in the critically ill patients[J].N Engl Jmed,2001,345(19): 1359-1367.
[9]杨银芬,吴国富.79例糖尿病围手术期血糖控制临床观察[J].现代中西医结合杂志,2008,17(10): 1506-1507.
[10]盛志勇,高瀚,张肇祥.手术学全集总论卷[M].北京:人民军医出版社,1996: 162.
[11]许涛,邵永胜,彭开勤,等.腹部手术后两种不同血糖控制方案对临床结果的影响[J].临床外科杂志,2006,14(9): 552-553.
[12]杨飞,许樟荣,胡成伟,等.糖尿病对腹部外科手术的影响[J].中国糖尿病杂志,2002,10(5):268-271.
收稿日期:( 2015-08-10)
通信作者:邵峰
文章编号:1002-266X(2015)37-0064-02
文献标志码:B
中图分类号:R735.2; RT35.3
doi:10.3969/j.issn.1002-266X.2015.37.025
