氧化苦参碱对H9c2心肌细胞氧化应激损伤的保护作用及其机制
2015-02-20赵阳延安大学咸阳医院陕西咸阳712099
赵阳(延安大学咸阳医院,陕西咸阳712099)
氧化苦参碱对H9c2心肌细胞氧化应激损伤的保护作用及其机制
赵阳
(延安大学咸阳医院,陕西咸阳712099)
摘要:目的研究氧化苦参碱对于由H2O2所致的H9c2细胞氧化应激损伤的保护作用及其作用机制。方法建立H9c2心肌细胞氧化应激损伤模型,取对数生长期细胞,将细胞随机分成4组:①正常对照组,不加任何处理因素;②模型组:在细胞培养基中加入终浓度为200 μmol/L H2O2培养6 h;③苦参碱低、高剂量组:在细胞培养基中加入低、高浓度(20、60 μmol/L)的苦参碱培养12 h,再加入终浓度为200 μmol/L的氧化应激继续培养6 h。采用MTT法检测细胞存活率,收集细胞上清及培养基,采用ELISA法检测丙二醛(MDA)水平及乳酸脱氢酶(LDH)和超氧化物歧化酶(SOD)活性,流式细胞术检测细胞的凋亡率,Western blotting法检测p-AKT、AKT、p-Bad、Bad、Bcl-2、Bax蛋白。结果与正常对照组比较,模型组细胞存活率降低、调亡率升高,细胞上清液中LDH活性增强、SOD活性减弱、MDA水平升高,p-AKT、Bcl-2、p-Bad蛋白水平降低,Bax升高(P均<0.05)。与模型组比较,苦参碱低、高剂量组细胞存活率提高,凋亡率降低,细胞上清液中MDA水平降低以及LDH活性减弱,SOD活性增强,p-AKT、Bcl-2、p-Bad蛋白表达量升高,Bax的表达降低(P均<0.05)。结论苦参碱可以通过影响p-AKT及其下游蛋白Bad表达,对H9c2心肌细胞由H2O2引起的氧化应激损伤起保护作用。
关键词:氧化应激损伤;过氧化氢;氧化苦参碱;凋亡; Bad
氧化应激是造成心血管系统结构功能异常的重要原因,与心血管疾病如动脉粥样硬化、高血压等具有密切联系。H2O2是一种活性氧,具有高反应性,可以促进氧自由基的生成,并可呈浓度和时间依赖性诱导心肌凋亡。因此常被用于心血管系统氧化应激的基础医学研究。氧化苦参碱(苦参素)是从中药苦参、苦豆子、广豆根等植物中提取的生物碱。氧化苦参碱药理作用广泛,具有抗病毒、强心、降压、抗炎、杀菌、抗肿瘤以及镇静催眠、解热镇痛、抗过敏等作用[1~5]。研究表明,氧化苦参碱对大鼠急性缺血损伤的心肌具有保护作用,其机制可能与抑制脂质过氧化和增加内生性抗氧化剂活性,保护线粒体的结构和功能从而减少细胞凋亡有关[6]。2014年3~7月,本研究旨在从细胞水平探讨氧化苦参碱对于心肌细胞损伤是否具有保护作用以及其作用机制。
1 材料与方法
1.1材料H9c2心肌细胞(来自本实验室):接种于含10%胎牛血清(美国HyClone公司)的高糖DMEM(美国Gibico公司)培养基中,细胞孵箱(美国Thermo公司)培养,培养条件为5% CO2、37℃。待细胞汇合度达到80%~90%时,用0.25%胰酶进行消化,以1∶4比例进行传代培养。试剂及仪器:酶标仪、电泳仪、转膜仪(美国Biord公司);mTT溶液、化学发光试剂盒(上海,碧云天);流式细胞仪(FACS Calibur,BD公司);丙二醛(MDA)、乳酸脱氢酶(LDH)、超氧化歧化酶(SOD)检测试剂盒(南京建成)。
1.2氧化应激损伤模型的建立及分组将H9c2细胞按照5×105/mL分别接种于96孔板和6孔板。实验开始时细胞均更换新鲜无血清培养液。按随机原则分为5组:①对照组,不加任何处理因素;②模型组:在细胞培养基中加入终浓度为200 μmol/L H2O2培养6 h;③苦参碱低、高剂量组:在细胞培养基中加入低、高浓度(20、60 μmol/L)的苦参碱培养12 h,再加入终浓度为200 μmol/L的H2O2继续培养6 h。
1.3心肌细胞存活率的检测采用MTT法。将H9c2细胞制成单细胞悬液,调整细胞数为1×105/mL,按200 μL/孔接种于96孔板中,37℃、5% CO2培养6 h贴壁后,按照上述各实验分组处理细胞,然后每孔中加入20 μLmTT溶液,37℃、5% CO2培养箱中培育4 h,加入150 μLdMSO溶液,在490 nm波长测定吸光度(A)值,设置不加细胞只加培养液的空白对照组,比色时作为空白调零孔,每组重复8
孔。细胞存活率(%)=处理组A值/空白对照组A 值×100%。
1.4心肌细胞中SOD、LDH活性及MDA水平的检测采用ELISA法。将H9c2细胞按5×105/mL接种6孔板,按上述实验分组处理后,取其上清液测定LDH活性。将6孔板中的心肌细胞用胰酶消化后收集,置于-70℃、20min后37℃水浴10min,反复冻融10次,待悬液由浑浊渐变透明后,收集培养基测定SOD活性和MDA水平,实验操作按照试剂盒说明书进行。
1.5心肌细胞凋亡率的检测采用流式细胞术。将H9c2细胞按5×105/mL接种6孔板按照上述实验分组处理,用0.25%胰酶进行消化,PBS洗涤3次后,调整细胞浓度为5×105/mL,分别重悬于200 μL结合缓冲液,加入10 μL AnnexinV-FITC和5 μL PI室温避光孵育15min,再加入300 μL结合缓冲液,300目筛网过滤后用流式细胞仪检测细胞凋亡率。
1.6蛋白激酶B(AKT)相关蛋白表达的检测采用Western blotting法。上述各实验组处理过的细胞,用预冷的PBS洗涤3次,收集细胞加入裂解缓冲液4℃裂解25min,收集细胞裂解液,离心后收集上清液。BRADFORD法测定裂解液中总蛋白含量。取细胞裂解液上样于SDS-PAGE聚丙烯酰胺凝胶,每孔45 μg蛋白电泳。电转移将蛋白转移至硝酸纤维素膜上。加入封闭液封闭1h,再加入抗靶蛋白抗体溶液4℃孵育过夜,洗膜,加入二抗工作液室温孵育1 h,洗膜,用化学发光试剂盒检测靶蛋白的表达。结果用Image J软件分析,计算条带的吸光度值。采用目的蛋白与内参的比值来表示蛋白表达水平。
2 结果
2.1各组心肌细胞生存率,SOD、LDH活性及MDA水平比较见表1。
表1 各组心肌细胞生存率,SOD、LDH活性及MDA水平比较()

表1 各组心肌细胞生存率,SOD、LDH活性及MDA水平比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别 生存率(%) LDH(U/L) MDA(nmol/L) SOD(U/mL)对照组100 14.83±1.93 3.12±0.32 51.83±4.23模型组 42.72±2.87* 31.43±3.92* 5.62±0.48* 27.98±3.14*苦参碱低剂量组 54.89±3.26# 19.43±1.98# 5.08±2.82# 35.28±3.04#苦参碱高剂量组 68.32±4.83# 24.83±3.87# 4.28±2.82# 41.92±2.86#
2.2各组心肌细胞凋亡率比较对照组、模型组、苦参碱低剂量组、苦参碱高剂量组心肌细胞凋亡率分别为(2.54±0.26)%、(41.54±4.21)%、(25.15 ±2.15)%、(15.42±2.56)%。模型组高于对照组,苦参碱低、高剂量组均高于模型组(P均<0.05)。
2.3各组心肌细胞中AKT、p-AKT、Bcl-2、Bad、p-Bad、Bax水平比较见表3。
表3 各组心肌细胞中AKT、p-AKT、Bcl-2、Bad、p-Bad、Bax水平比较()
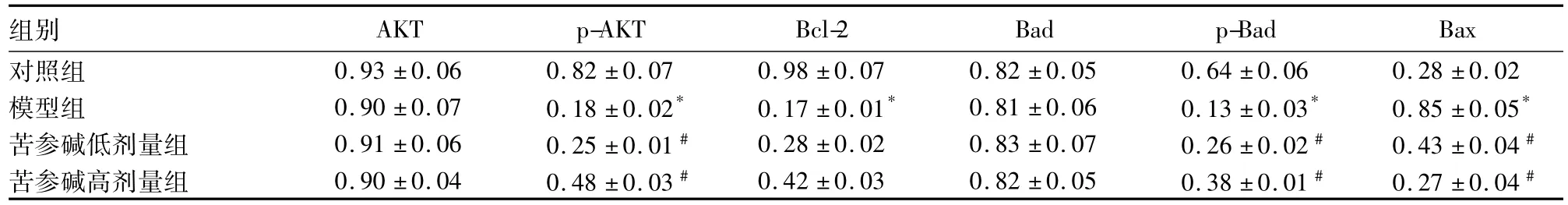
表3 各组心肌细胞中AKT、p-AKT、Bcl-2、Bad、p-Bad、Bax水平比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别AKT p-AKT Bcl-2 Bad p-Bad Bax对照组 0.93±0.06 0.82±0.07 0.98±0.07 0.82±0.05 0.64±0.06 0.28±0.02模型组 0.90±0.07 0.18±0.02* 0.17±0.01* 0.81±0.06 0.13±0.03* 0.85±0.05*苦参碱低剂量组 0.91±0.06 0.25±0.01﹟ 0.28±0.02 0.83±0.07 0.26±0.02﹟ 0.43±0.04﹟苦参碱高剂量组 0.90±0.04 0.48±0.03﹟ 0.42±0.03 0.82±0.05 0.38±0.01﹟ 0.27±0.04﹟
3 讨论
氧化应激损伤是机体在遭受各种有害刺激时,体内活性氧过多产生或代谢障碍,超过内源性抗氧化系统对其消除能力时,导致细胞脂质过氧化并引发溶酶体、线粒体损伤的现象[7]。
H2O2是一种重要的ROS来源,是体内氧化代谢的产物,具有较强的氧化能力,可以自由穿过细胞膜和细胞内的铁离子反应生成活性更强的自由基,引起细胞膜损伤。除此之外,它还能通过脂质过氧化物分解代谢产物MDA,促使蛋白质交联聚合,并通过多种途径诱导细胞凋亡[8,9]。
本实验中H2O2处理细胞后,心肌细胞存活率显著降低,培养基中LDH活性显著升高,表明H2O2有显著的心肌细胞毒性作用,模型建立成功。心肌细胞内MDA水平明显增高,而SOD活性下降,表明心肌细胞抗氧化自由基损伤的能力下降,细胞发生了氧化应激损伤。用不同浓度氧化苦参碱处理后,心肌细胞存活率较模型组明显提高,培养基中LDH活性和MDA水平较模型组明显降低,SOD活性明显升高,说明氧化苦参碱具有抗氧化应激损伤的作用。
在心肌细胞凋亡的研究中,线粒体凋亡通路是主要途径,缺血再灌注损伤会导致线粒体凋亡途径的激活,进而导致细胞色素C释放,并伴随着caspase-9的激活而引起细胞凋亡[10]。
AKT是一种丝/苏氨酸蛋白激酶。研究表明,AKT处于许多线粒体介导细胞凋亡通路的交汇点,直接或间接地调控细胞凋亡。Bad是Bcl-2家族中的促凋亡蛋白,能与Bcl-2或Bcl-XL结合形成复合
体。AKT能磷酸化Bad,使Bad从复合物分离,这样一方面抑制了Bad的促凋亡作用,另一方面有利于解离的Bcl-2和Bcl-XL发挥抗凋亡作用。因此,AKT可以通过p-Bad抑制细胞凋亡。
除此之外,Bad结合Bcl-2,可以使Bcl-2不能结合并抑制促凋亡基因Bax,Bax结合到线粒体膜上,改变线粒体内外膜之间的离子浓度,从而打开线粒体外膜,然后细胞色素C从线粒体中流到细胞质中,与凋亡蛋白水解酶激活因子Apaf-1及caspase-9共同组成凋亡体,接着激活caspase-3,最终诱发细胞凋亡。
本实验中,我们发现模型组p-AKT、Bad、Bcl-2蛋白的表达较对照组明显降低,而Bax蛋白表达显著上升。与模型组比较,苦参碱低、高剂量组p-AKT、Bad、Bcl-2蛋白表达升高,Bax蛋白表达降低。提示氧化苦参碱可以通过p-AKT进而磷酸化下游Bad蛋白,使Bad-Bcl-2-BCL-XL复合物解离,抑制Bax的作用,从而达到抗凋亡的目的,对心肌细胞具有抗氧化应激损伤作用。
参考文献:
[1]Liu Y,Xu Y,Ji W,et al.Anti-tumor activities ofmatrine and oxymatrine: literature review[J].Tumour Biol,2014,35(6):5111-5119.
[2]Hu YY.Pay attention to the study on active antiliver fibrosis components of Chinese herbalmedicine[J].Chin J Integrmed, 2012,18(8): 563-564.
[3]Wang CY,Bai XY,Wang CH.Traditional Chinesemedicine: a treasured natural resource of anticancerdrug research anddevelopment[J].Am J Chinmed,2014,42(3): 543-559.
[4]Jiang G,Liu X,Wangm,et al.Oxymatrine ameliorates renal ischemia-reperfusion injury from oxidative stress through Nrf2/HO-1 pathway[J].Acta Cir Bras,2015,30(6): 422-429.
[5]Wang W,Pei X,Xum,et al.The protective effect of sodium ferulate and oxymatrine combination on paraquat-induced lung injury [J].Iran J Pharm Res,2015,14(2): 573-583.
[6]Hong-Li S,Lei L,Lei S,et al.Cardioprotective effects and underlyingmechanisms of oxymat rine against Ischemicmyocardial injuries of rats[J].Phytother Res,2008,22(7): 985-989.
[7]Xu J,Tian W,Ma X,et al.Themolecularmechanism underlyingmorphine-induced Akt activation: roles of protein phosphatases and reactiveoxygen species[J].Cell Biochem Biophy,2011,61(2):303.
[8]Scott FL,Stec B,Pop C,et al.The Fas-FADDdeathdomain complex structure unravels signalling by receptor clustering[J].Nature,2009,457(7232): 1019-1022.
[9]SternmM,Myers RL,Hammam N,et al.The influence of extracellularmatrixderived from skeletalmuscle tissue on the proliferation anddifferentiation ofmyogenic progenitor cells ex vivo[J].Biomaterials,2009,30(12): 2393-2399.
[10]Ilmarinen P,Moilanen E,Kankaanranta H.Mitochondria in the center of human eosinophil apoptosis and survival[J].Int Jmol Sci,2014,15(3): 3952-3969.
收稿日期:( 2015-06-16)
文章编号:1002-266X(2015)37-0029-03
文献标志码:A
中图分类号:R542.2
doi:10.3969/j.issn.1002-266X.2015.37.009
