AG490对大鼠脑缺血损伤的保护作用及其机制
2015-02-20高延才杜爱玲张林朋张合鹏曹少鹏王振刚季泰令潍坊医学院山东潍坊6053潍坊医学院附属医院
高延才,杜爱玲,张林朋,张合鹏,曹少鹏,王振刚,季泰令(潍坊医学院,山东潍坊6053;潍坊医学院附属医院)
AG490对大鼠脑缺血损伤的保护作用及其机制
高延才1,杜爱玲2,张林朋1,张合鹏1,曹少鹏1,王振刚2,季泰令2(1潍坊医学院,山东潍坊261053;2潍坊医学院附属医院)
摘要:目的研究JAK激酶/信号转导和转录激活因子(JAK/STAT)信号通路的阻断剂AG490对大鼠脑缺血损伤的保护作用,并探讨其作用机制。方法用健康SD大鼠制作大脑中动脉栓塞(MCAO)模型,随机分为四组:mCAO组、假手术组、高剂量AG490干预组和低剂量AG490干预组。MCAO组采用左侧颈外动脉插栓法造模;假手术组不插栓,结扎并剪断左侧颈外动脉,夹闭左侧颈总动脉1 h后撤动脉夹,缝皮;高剂量AG490干预组和低剂量AG490干预组在造模成功后1 h分别给予腹腔注射6、3mg/kg AG490,MCAO组和假手术组给予等量生理盐水。动物麻醉清醒后6、12、24 h,应用神经功能行为学评分评价脑缺血损伤程度;动物麻醉清醒后24 h用2,3,5-氯化三苯基四氮唑染色技术检测脑组织梗死范围,ELISA法检测脑组织内肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)水平。结果大鼠麻醉清醒后24 h,与假手术组比较,MCAO组、高剂量AG490干预组和低剂量AG490干预组神经功能行为学评分、TNF-α和IL-1β水平高,脑组织梗死范围大(P<0.05或<0.01);与MGAO组比较,高剂量AG490干预组、低剂量AG490干预组神经功能行为学评分低,TNF-α、IL-1β水平低,脑组织梗死范围小(P均<0.01)。结论AG490对大鼠脑缺血损伤具有保护作用,其作用是通过抑制JAK/STAT信号传导通路、减轻炎症反应实现的。
关键词:脑缺血; AG490; JAK激酶;信号转导和转录激活因子;大鼠
脑血管病在人类各种疾病死因中一直位于前3位,成为人类死亡的主要原因。其中缺血性脑血管病(ICVD)临床较多见,约占全部脑血管病患者的85%,最为常见的是大脑中动脉栓塞(MCAO)引起的。由于大鼠的脑血管分布与人脑部血管类似,而且愈合能力强、易于饲养、便于操作,因此本实验采用了目前常见的大鼠MCAO模型。AG490是一种人工合成的苯亚甲基丙二腈的脂类衍生物,是JAK激酶/信号转导和转录激活因子(JAK/STAT)信号通路的阻断剂[1]。目前研究表明,JAK/STAT信号转导途径参与中枢神经系统的多个生物学分化过程,与脑外伤、脑肿瘤、免疫反应机制等相关[2]。2014年10月~2015年6月,我们就AG490对脑缺血损伤的作用及其作用机制进行了相关探讨。现报告如下。
1 材料与方法
1.1材料雄性SD大鼠,体质量250~280 g(北京斯贝福实验动物科技有限公司),洁净动物房饲喂,大鼠自由饮水进食,饲喂3d,适应环境后进行试验; AG490(美国BioLegend公司); 2,3,5-氯化三苯基四氮唑(TTC)(北京化学试剂公司); TNF-α和IL-1β ELISA试剂盒(北京环亚泰克生物医学技术有限公司)。
1.2动物分组与MCAO模型建立依据随机数字表将大鼠分为4组:假手术组、MCAO组、低剂量AG490(3mg/kg)干预组和高剂量AG490(6mg/kg)干预组。大鼠均采用腹腔注射麻醉(10%水合氯醛0.3mL/100 g),MCAO组采用颈外动脉插栓法,做颈正中切口,暴露颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉,将0.26mm单丝尼龙鱼线头端0.5 cm用石蜡包被,并于20mm处标记,大鼠均通过左侧ECA切口处插入,栓线长度自CCA分叉处18~20mm,根据动物体质量而定,栓塞左侧大脑中动脉,然后缝合皮肤,栓线尾端部分固定于皮肤上。缺血达到2 h后小心抽出栓线,即形成再灌注。假手术组只是不插入尼龙鱼线,其余步骤同MCAO组。低剂量AG490干预组和高剂量AG490干预组分别于术前24 h给予3mg/kg和6mg/kg的AG490腹腔注射,其余步骤同MCAO组。在缺血期间及再灌注后2 h保持体温在(37±0.5)℃。以大鼠手术麻醉清醒后出现右侧肢体瘫痪,站立不稳,提尾时向一侧转圈为模型成功的判断标准。
1.3脑缺血损伤程度的评价采用神经行为学评分。参考Ergul等[3]的5分制法,在动物麻醉清醒后6、12、24 h进行评分。0分:无神经损伤症状; 1 分:不能完全伸展对侧前爪; 2分:向对侧转圈; 3分:向对侧倾倒; 4分:不能自发行走,意识丧失。分值越高,说明动物行为障碍越严重。
1.4脑组织梗死范围的检测采用TTC染色法。动物麻醉清醒后24 h将大鼠断头,取出完整的脑组织,迅速置于-20℃的冰箱中,冻存20min。切成5~6片,每隔2mm切一片。第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间[4]。切片应均匀。将切片置于TTC中,常规浓度为2%,用锡箔纸盖住后,放入37℃恒温箱15~30min,不时翻动脑片,保证均匀接触到染色液。最后,数码相机拍照,计算机计算梗死区域体积所占大脑半球总体积的百分比。
1.5脑组织TNF-α和IL-1β测定动物麻醉清醒后24 h,选取栓塞缺血同侧的大鼠脑组织,匀浆处理脑组织,然后离心,取上清液。采用ELISA法,严格按照ELISA试剂盒说明书操作测定脑组织TNF-α 和IL-1β水平。
1.6统计学方法采用SPSS13.0统计软件。计量资料以±s表示,神经行为学评分比较采用秩和检验,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1各组不同时间神经行为学评分比较见表1。
表1 各组不同时间神经行为学评分比较(分,)
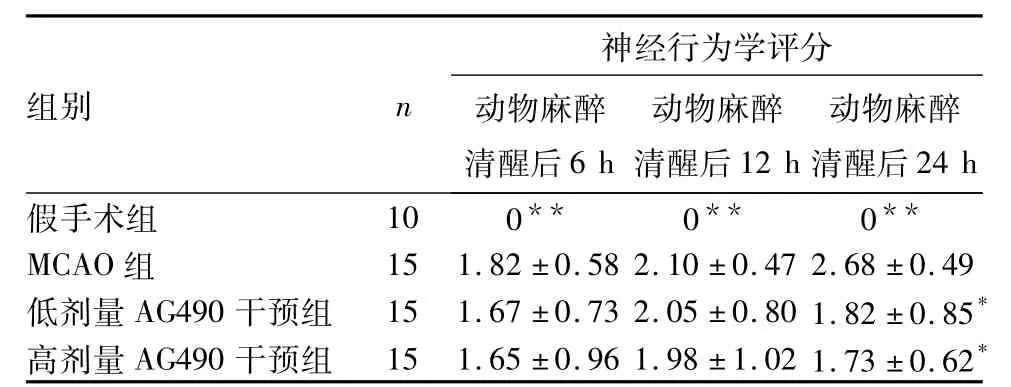
表1 各组不同时间神经行为学评分比较(分,)
注:与MCAO组同期比较,*P<0.05,**P<0.01。
组别 n 24 h神经行为学评分动物麻醉清醒后6 h动物麻醉清醒后12 h动物麻醉清醒后假手术组 10 0** 0** 0**MCAO组 15 1.82±0.58 2.10±0.47 2.68±0.49低剂量AG490干预组 15 1.67±0.73 2.05±0.80 1.82±0.85*高剂量AG490干预组 15 1.65±0.96 1.98±1.02 1.73±0.62*
2.2各组脑组织梗死范围比较假手术组无脑组织梗死发生,MCAO组脑组织梗死范围为(16.84± 4.60)%,低剂量AG490干预组为(10.37± 2.60)%,高剂量AG490干预组为(8.26±3.07)%。MCAO组、高剂量AG490干预组和低剂量AG490干预组脑组织梗死范围均高于假手术组(P均<0.01);高剂量AG490干预组、低剂量AG490干预组和MCAO组脑组织梗死范围依次增高(P均<0.01)。
2.3各组脑组织TNF-α和IL-1β水平比较见表2。
表2 各组脑组织TNF-α和IL-1β水平比较(mg/g,)
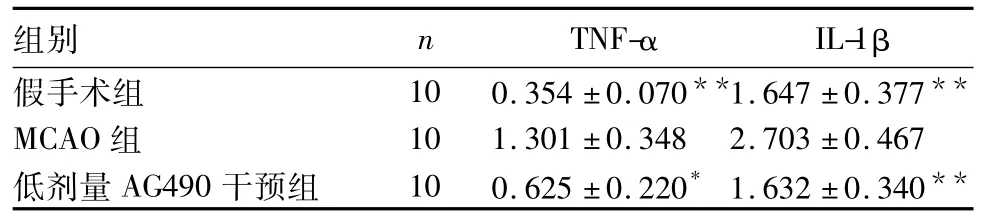
表2 各组脑组织TNF-α和IL-1β水平比较(mg/g,)
注:与MCAO组比较,*P<0.05,**P<0.01。
组别 n TNF-α IL-1β假手术组 10 0.354±0.070**1.647±0.377**MCAO组 10 1.301±0.348 2.703±0.467低剂量AG490干预组 10 0.625±0.220*1.632±0.340**
3 讨论
目前,面对日益加重的老龄化问题,心脑血管疾病已经成为危害人们身体健康的主要疾病,其发病率呈现逐年增高的趋势。脑缺血损伤后的区域主要表现为炎症反应,包括氧自由基产生、水解酶生成、溶酶体破坏、白细胞聚集以及炎症介质形成等方面。脑缺血损伤后的一系列炎症反应,最终会导致血脑屏障受损,内皮细胞的参与会加重脑损害,引起脑水肿。以上的病理生理过程中会有各种各样的炎性因子参与其中,包括TNF-α和IL-1β。
IL-1β是IL-1在脑组织中主要的活性形式,可由内皮细胞和神经胶质细胞等多种活性细胞合成和分泌。其不仅能协同其他细胞因子促进T、B细胞活化,还能诱导其他炎症介质产生,增强内皮细胞与白细胞的黏附,调节TNF-α和IL-6的产生[5,6]。目前认为,IL-1β是一种重要的炎性因子,其失控性表达是炎症反应失控性发生、发展的重要因素,是反映脑缺血急性期损伤程度的标志物[7]。它诱导的炎症反应与JAK/STAT信号通路密切相关[8]。TNF-α具有触发和级联放大炎症反应的作用,是诱导过度炎症反应的关键性促炎因子,在缺血性脑血管病的发病机制中起重要作用,是脑缺血形成后脑组织梗死的主要原因[9,10]。其可诱导细胞黏附因子表达,增加血管内皮细胞通透性,导致炎症介质释放和聚集,在脑缺血损伤后期的炎症细胞浸润和组织损伤中发挥很大作用,因此降低TNF-α的表达是对脑缺血损伤后神经功能障碍的一种保护性措施。本研究结果显示,与假手术组比较,MCAO组、高剂量AG490干预组和低剂量AG490干预组神经功能行为学评分、TNF-α和IL-1β水平高,脑组织梗死范围大;与MCAO组比较,高剂量AG490干预组、低剂量AG490干预组神经功能行为学评分低,TNF-α、IL-1β水平低,脑组织梗死范围小。提示AG490可通过降低TNF-α和IL-1β水平,抑制炎症反应从而起到脑组织保护作用。
研究表明,众多细胞内的信号转导需要借助JAK-STAT信号转导通路,其在缺血性脑血管病中的作用越来越受到关注[11]。本实验采用的干预药物AG490是一种选择性拮抗JAK2酪氨酸磷酸化的抑制剂,能有效地阻断下游信号转导和转录激活子STAT的活化,特异性地抑制JAK-STAT信号转导通路,从而有效地阻断其信号通路的信号转导过程。结果显示采用AG490阻断JAK-STAT信号转导通路后,大鼠脑缺血损伤后的神经功能损伤程度减轻、脑组织梗死范围缩小和炎症反应减轻,因此推断AG490通过抑制JAK-STAT信号转导通路保护脑缺血损伤。
参考文献:
[1]Fenyo IM,Florea IC,Raicum,et al.Tyrphostin AG490 reduces NAPDH oxidase activity and expression in the aorta of hypercholesterolemic apolipoprotein E-deficientmice[J].Vascul Pharmacol,2011,54(3-6): 100-106.
[2]Kondylim,Gatzounis G,Kyritsis A,et al.Immunohistochemicaldetection of phosphorylated JAK-2 and STAT-5 proteins and correlation with erythropoietin receptor(EpoR)expression status in human brain tumors[J].J Neurooncol,2010,100(2): 157-164.
[3]Ergul A,ElgebalymM,MiddlemoremL,et al.Increased hemorrhagic transformation and altered infarct size and localization after experimental stroke in a ratmodel type 2diabetes[J].BMC Neurol,2007,(7): 33.
[4]张均田.现代药理实验方法[M].北京:北京医科大学中国协和医科大学联合出版社,1998: 1382,1409-1413.
[5]BenningerdH,Georgiadisd,Kremer C,et al.Mechanism of ischemic infarct in spontaneous carotiddissection[J].Stroke,2004,35(2): 482-485.
[6]Castellanosm,Castillo J,GarcíamM,et al.Inflammation-mediateddamage in progressing lacunar infarctions: a potential therapeutic target[J].Stroke,2002,33(4): 982-987.
[7]Clark WM,Rinker LG,Lessov NS,et al.Lack of interleukin-6 expression is not protective against focal central nervous system ischemia[J].Stroke,2000,31(7): 1715-1720.
[8]Jee SH,Chu CY,Chiu HC,et al.Interleukin-6 induced basic fibroblast growth factor-dependent angiogenesis in basal cell carcinoma cell line via JAK/STAT3 and PI3-kinase/Akt pathways[J].J Investdermatol,2004,123(6): 1169-1175.
[9]Sairanen T,Carpén O,Karjalainen-LindsbergmL,et al.Evolution of cerebral tumor necrosis factor-alpha productionduring human ischemic stroke[J].Stroke,2001,32(8): 1750-1758.
[10]Fenyo IM,Florea IC,Raicum,et al.Tyrphostin AG490 reduces NAPDH oxidase activity and expression in the aorta of hypercholesterolemic apolipoprotein E-deficientmice[J].Vascul Pharmacol,2011,54(3-6): 100-106.
[11]Ke JJ,Wang YL,Li JG,et al.Pretreatment effect of adenosine on activation of NF kappaB and level of TNF-alphaduringmyocardial ischemia and reperfusion in rats[J].Chin J Traumatol,2004,7(1): 25-27.
·临床研究·
收稿日期:( 2015-07-06)
文章编号:1002-266X(2015)37-0031-03
文献标志码:A
中图分类号:R651.1
doi:10.3969/j.issn.1002-266X.2015.37.010
