89Sr联合唑来膦酸治疗骨转移瘤骨痛的安全性及疗效评价
2015-02-20张青菊徐文贵戴东宋秀宇
张青菊 徐文贵 戴东 宋秀宇
·临床研究与应用·
89Sr联合唑来膦酸治疗骨转移瘤骨痛的安全性及疗效评价
张青菊 徐文贵 戴东 宋秀宇
目的:评价89Sr及89Sr联合唑来膦酸治疗骨转移瘤骨痛的安全性及疗效。方法:回顾性分析确诊为恶性肿瘤骨转移患者87例,分为89Sr治疗组53例,89Sr联合唑来膦酸34例(其中4例未入组、再分为89Sr治疗优先组17例、唑来膦酸优先组13例);89Sr联合唑来膦酸亚组分组标准为89Sr治疗后2~14天行唑来膦酸治疗,或唑来膦酸治疗后4~7天行89Sr治疗。通过χ2检验、连续校正χ2检验或Fisher精确概率检验方法比较不同治疗方法止痛有效率及KPS变化。通过独立样本Kruskal-Wallis检验比较不同原发肿瘤行89Sr及89Sr联合唑来膦酸治疗后止痛有效率及KPS变化。结果:全部病例均未出现较严重不良反应。89Sr及89Sr联合唑来膦酸治疗后,患者均表现疼痛评分减低,KPS评分提高,其中以89Sr联合唑来膦酸治疗疼痛评分及KPS评分变化更明显,差异有统计学意义(P=0.047;P=0.036)。比较唑来膦酸治疗优先组与89Sr治疗优先组止痛有效率和KPS提高率(P=1.000和P=0.667),差异无统计学意义。不同原发肿瘤89Sr治疗(P=0.837和P=0.074)及89Sr联合唑来膦酸治疗(P=0.321和P=0.118)后骨痛及KPS评分变化比较未见明显差异。结论:89Sr及89Sr联合唑来膦酸治疗骨转移瘤均有较好疗效,其中,两者联合治疗较89Sr治疗安全性无差异,但疗效更佳。
89Sr 唑来膦酸 骨转移瘤 联合治疗
恶性肿瘤骨转移发生率逐年增加,常见于前列腺癌(67%~75%)、乳腺癌(67%~75%)、肺癌(30%~60%)、胃癌、肾癌、甲状腺癌、宫颈癌、骨与软组织恶性肿瘤等[1]。包括骨痛及病理性骨折、脊髓压迫症、高钙血症等的骨相关事件(skeletal related events)严重影响晚期骨转移患者生存质量,尤以骨痛为著。姑息性治疗(双膦酸盐类药物、同位素内照射、全身化疗、内分泌治疗、手术治疗、局部放疗等)是晚期骨转移瘤有效的治疗方式之一,其中89Sr核素治疗及双膦酸盐类药物对全身多发性骨转移瘤治疗具有明显优势[2-3]。
89Sr与钙是同族化学元素,主要通过发射纯β射线而减小骨膜张力、减少疼痛物质释放以及射线直接对肿瘤细胞的杀伤等发挥作用,其经静脉注射后10天内于骨转移病灶聚集达到一个高峰,并在骨病灶滞留长达90天[4]。双膦酸盐是一类焦膦酸盐类似物,可减少破骨细胞生成,降低其活性,并增加其细胞凋亡,具有较强抗骨吸收性。唑来膦酸是目前活性最强的双膦酸盐,其治疗骨转移骨痛中位起效缓解时间为4天,中位缓解持续时间27天[5]。此二者在骨转移瘤的应用均已得到证实,关于二者联合治疗骨转移瘤,及其最佳联合方式的探索尚有待研究。本文将二者在其各自最大发挥作用时间联合用于治疗恶性肿瘤骨转移,并探索其有效联合方式。
1 材料与方法
1.1 材料
1.1.1 临床资料回顾性分析2013年1月至2015年1月在天津医科大学肿瘤医院确诊为恶性肿瘤多发骨转移患者共87例(前列腺癌21例、乳腺癌29例、肺癌16例、其他包括胃癌4例、肾癌4例、肝癌3例、结直肠2例、鼻咽癌1例、甲状腺癌1例、卵巢癌1例、纵隔类癌1例、子宫内膜癌1例、多发性骨髓瘤1例、原发肿瘤待查2例)。全部病例一般资料见表1。
1.1.2 入组标准全部病例均经病理或临床及影像学检查证实为恶性肿瘤多发性骨转移;患者一般情况尚可,预计生存期>3个月;至少2周以上未使用钙剂、4周内未行外放射治疗或化疗;血常规检查:WBC≥4.0×109/L、RBC≥3.5×1012/L、PLT≥100×109/L;肝肾功能检查正常;止痛药种类在治疗前1周及治疗期间尽量不改变;无核素治疗禁忌证;除外脊椎转移造成脊髓压迫或瘫痪者。
1.2 方法
1.2.1 治疗方法89Sr采用静脉注射给药,所有患者统一剂量为148 MBq。唑来膦酸4 mg,静脉滴15 min,每3~4周/次。89Sr联合唑来膦酸治疗组分为:89Sr优先组,89Sr治疗后2~14天行唑来膦酸治疗;唑来膦酸优先组,唑来膦酸治疗后4~7天行89Sr治疗。
1.2.2 疗效判断标准1)疼痛程度评估根据NCCN成人癌痛临床实践指南(中国版)疼痛分级标准,结合疼痛视觉模拟法(VRS)及数级法(NRS)详细记录患者治疗前及治疗后1、2、4、12周疼痛变化情况。0级:无疼痛;Ⅰ级(轻度疼痛,1~3级):疼痛可以耐受,睡眠不受影响;Ⅱ级(中度疼痛,4~6级):疼痛不能耐受,睡眠受影响,需服用止痛药;Ⅲ级(重度疼痛,7~10级):疼痛剧烈不能忍受,睡眠严重受影响,需要止痛药维持。2)疼痛疗效评价:完全有效(CR):疼痛分级标准下降2级;部分有效(PR):疼痛分级标准下降1级;无效(NR):疼痛分级标准无下降或上升;有效率:(完全有效+部分有效)/总病例数。3)体力状况分级按WHO(世界卫生组织)KPS(Karnofsky)评分疗效评价标准,治疗后KPS评分较治疗前升高≥10分为提高,减少≥10分为降低,增减<10分为稳定。4)安全性评估治疗后2、4、12周复查白细胞(WBC)、血小板(PLT)及肝功能(ALT、AST)。按WHO成人血液学急性、亚急性毒性反应分度标准评估治疗前后各指标变化情况,统计变化病例数。
1.3 统计学方法
采用SPSS 17.0统计软件包进行数据分析。计数资料用x±s描述;各不同治疗方法止痛疗效及KPS疗效比较用χ2检验、连续校正χ2检验或Fisher精确概率检验;通过独立样本Kruskal-Wallis检验比较不同原发肿瘤89Sr及89Sr联合唑来膦酸治疗后止痛有效率及KPS变化。P<0.05为差异具有统计学意义。
2 结果
2.1 安全性
全部病例均未出现较严重恶心、呕吐、腹泻、便秘等消化道反应、过敏反应或血液毒性等不良反应(表2)。全部病例经对症治疗后,血象及肝肾功能均恢复至正常范围。

表1 患者一般资料Table 1 Clinical data of all cases
2.2 止痛有效率及KPS评分变化
89Sr联合唑来膦酸治疗组止痛有效率及KPS评分变化均较89Sr治疗组明显,差异有统计学意义(P=0.047,P=0.036,表3)。比较唑来膦酸治疗优先组与89Sr治疗优先组止痛有效率KPS评分,差异无统计学意义(P=1.000,P=0.667,表4)。不同原发肿瘤89Sr治疗(P=0.837,P=0.074)、89Sr联合唑来膦酸治疗(P=0.321,P=0.118)后骨痛及KPS评分变化比较未见明显差异(表5)。89Sr与唑来膦酸治疗后3个月以内疼痛评分变化及KPS评分变化分别见图1,2。

表2 89Sr、89Sr联合唑来膦酸治疗后血液学毒性反应评估例Table 2 Evaluation of hematological toxicity after treatment with89Sr-chloride or89Sr plus zoledronic acidn

表3 89Sr、89Sr联合唑来膦酸治疗骨痛缓解情况及KPS评分变化Table 3 Comparison between bone-pain relief and changes in KPS score after treatment with89Sr-chloride or89Sr plus zoledronic acid

表4 89Sr与唑来膦酸不同联合方式治疗组骨痛缓解情况及KPS评分变化例Table 4 Comparison between bone-pain relief and changes in KPS score after various administrations of89Sr-chloride and zoledronic acidn

表5 不同原发肿瘤89Sr、89Sr联合唑来膦酸治疗后骨痛缓解情况及KPS评分变化例Table 5 Comparison between bone-pain relief and changes in KPS score in various primary tumors after treatment with89Sr-chloride or89Sr plus zoledron⁃ic acidn
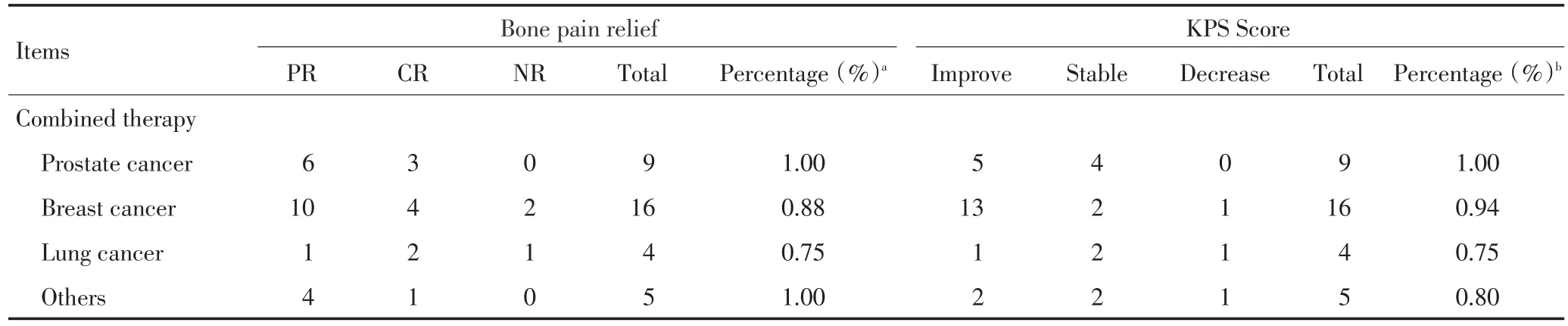
表5 不同原发肿瘤89Sr、89Sr联合唑来膦酸治疗后骨痛缓解情况及KPS评分变化例(续表5)Table 5 Comparison of bone pain relief and changes in the KPS score of different primary tumors after89Sr-chloride alone or combined therapy with zole⁃dronic acidn(continued table 5)

图1 89Sr与89Sr联合唑来膦酸治疗疼痛评分变化Figure 1 Comparison between changes in pain score after treatment with89Sr-chloride or89Sr plus zoledronic acid

图2 89Sr与89Sr联合唑来膦酸治疗KPS评分变化Figure 2 Comparison between changes in KPS score after treatment with89Sr-chloride alone or89Sr plus zoledronic acid
3 讨论
1942年Pecher[6]首次报道将89Sr用于治疗骨转移瘤骨痛。89Sr主要发射纯β射线,射线能量平均为1.46 MeV,物理半衰期50.5天。89Sr经静脉注射后能特异高效地聚集于骨转移病灶,10天内于骨转移病灶聚集达到一个高峰,并滞留长达90天[4]。文献报道[7],89Sr治疗骨转移骨痛有效率为48%~86%。本研究89Sr治疗后,疼痛缓解有效率为66%,与文献报道一致。Lewington等[8]证实89Sr发挥止痛作用得益于其β射线辐射性而非Sr元素本身。其主要通过1)损伤疼痛敏感神经细胞;2)减少肿瘤生长所致神经张力性疼痛;3)抑制疼痛介质前列腺素E2(PGE2)和白细胞介素-6(IL-6)的释放[9]减少疼痛。89Sr与钙属同族化学元素,其主要通过吸附于骨基质而作用于成骨性骨转移瘤。但也有研究推测其可作用于溶骨性骨肿瘤:雷尼酸锶用于骨质疏松症,其中89Sr通过减少破骨细胞分化及其破骨活动减少骨吸收[10-11]等发挥主要药理作用,而雷尼酸仅保证其在盐溶液中不与金属阳离子螯合而保持较高水平。
临床诸多骨肿瘤相关并发症均与破骨细胞所致的骨吸收相关。双膦酸盐属焦膦酸盐类似物,可以有效减少骨吸收。唑来膦酸作为第三代含氮双膦酸盐,临床前研究显示其通过诱导肿瘤细胞凋亡、对抗细胞黏附侵袭、抑制肿瘤血管生成等直接和间接方式达到抗肿瘤的目的[12]。唑来膦酸治疗肿瘤引起的高钙血症时,血钙在第24~48 h开始下降,第3~5天降至正常水平,第5~6天后可降至最低水平[13],故其在人体内发挥稳定作用是第5~7天。唑来膦酸治疗骨转移骨痛中位起效缓解时间为第4天,中位缓解持续时间27天[5]。
Storto等[14]报道89Sr联合唑来膦酸治疗骨转移疼痛疗效优于二者单独应用。Yamada等[15]证实89Sr联合唑来膦酸治疗乳腺癌骨转移骨痛疗效佳且安全。亦有诸多文献报道89Sr联合唑来膦酸治疗恶性肿瘤骨转移骨痛具有协同作用,且各组联合方式各不相同。本组病例尝试分别于89Sr治疗后2~14天行唑来膦酸治疗,以及唑来膦酸治疗后4~7天行89Sr治疗,比较两者止痛有效率及KPS评分变化,结果显示无差异。由此得出,89Sr与唑来膦酸联合方式多样,且安全有效。本组病例显示89Sr治疗及89Sr与唑来膦酸联合治疗后,不同原发肿瘤在止痛有效率及KPS评分变化方面均未见明显差异。
血液学毒性反应是89Sr治疗的主要毒副反应。部分患者在注射后4周左右出现轻度白细胞、血小板减少,在12周内即恢复到治疗前水平[16]。研究发现[17],血小板或白细胞下降的最低点与剂量相关,并在给药后5~7周出现,但到3个月时的血小板或白细胞水平大约为基线的80%,并与所接受的剂量无关。Kasalicky等[18]报道89Sr重复治疗达5次未见明显骨髓抑制。本组病例89Sr治疗及89Sr联合唑来膦酸治疗后,仅部分患者出现轻度血液学毒性及肝功能变化,但对症治疗后全部恢复。
综上所述,89Sr联合唑来膦酸治疗骨转移瘤骨痛及KPS评分变化优于89Sr单独使用,患者疼痛评分减低,KPS评分提高,无明显不良反应。关于两者联合方式,89Sr治疗优先组与唑来膦酸优先组疗效差异无统计学差异。
[1]Yu SY,Jiang ZF,Zhang L,et al.Chinese expert consensus state⁃ment on clinical diagnosis and treatment of malignant tumor bone metastasis and bone related diseases[J].Chinese-German J of Clin Oncol,2010,9(1):1-12.[于世英,江泽飞,张力,等.恶性肿瘤骨转移及骨相关疾病临床诊疗中国专家共识(英文)[J].中德临床肿瘤学杂志,2010,9(1):1-12.]
[2]Tomblyn M.The role of bone-seeking radionuclides in the pallia⁃tive treatment of patients with painful osteoblastic skeletal metas⁃tases[J].Cancer Control,2012,19(2):137-144.
[3]Buga S,Sarria JE.The management of pain in metastatic bone dis⁃ease[J].CancerControl,2012,19(2):154-166.
[4]Blake GM,Zivanovic MA,McEwan AJ,et al.Sr-89 therapy: strontium kinetics in disseminated carcinoma of the prostate[J]. Eur J Nucl Med,1986,12(9):447-454.
[5]Tao L,Wang HL,Chen J,et al.A clinical study for Zoledronic acid in the relief of pain due to bone metastatic malignancy[J].China Oncology,2006,16(12):1057-1059.[陶莉,王洪林,陈剑,等.唑来膦酸治疗76例恶性肿瘤骨转移性疼痛[J].中国癌症杂志,2006,16(12): 1057-1059.]
[6]Pecher C.Biological investigation with radioactive calcium and strontium:preliminary report on the use of radioactive strontium in treatment of metastatic bone cancer[J].Pharmacology,1942,11(2): 117-149.
[7]Kuroda I.Effective use of strontium-89 in osseous metastases[J]. Ann Nucl Med,2012,26(3):197-206.
[8]Lewington VJ,McEwan AJB,Ackery DM,et al.A prospective, randomized double-blind crossover study to examine the fficacy of strontium-89 in pain palliation in patients with advanced prostate cancer metastatic to bone[J].Eur J Cancer,1991,27(8):954-958.
[9]Davis J,Pither RJ.Biochemical responses in cultured cells follow⁃ing exposure to 89SrCl2:potential relevance to the mechanism of action in pain palliation[J].Eur J Cancer,2001,37(18):2464-2469.
[10]Takahashi N,Sasaki T,Tsouderos Y,et al.S 12911-2 inhibits os⁃teoclastic bone resorption in vitro[J].J Bone Miner Res,2003,18 (6):1082-1087.
[11]Baron R,Tsuouderos Y.In vitro effect of S12911-2 on osteoclast function and bone marrow acrophage differentiation[J].Eur J Pharmacol,2002,450(1):11-17.
[12]Rosen LS,Gordon D,Kaminski M,et al.Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma:a phaseⅢ,double-blind,comparative trial[J].Cancer J,2001,7(5): 377-387.
[13]Coukell AJ,Markham A.Pamidronate.A review of its use in the management of osteolytic bone metastases,tumour-induced hy⁃percalcaemia and Paget's disease of bone[J].Drugs Aging,1998, 12(2):149-168.
[14]Storto G,Klain M,Paone G,et al.Combined therapy of Sr-89 and zoledronic acid in patients with painful bone metastases[J]. Bone,2006,39(1):35-41.
[15]Yamada K,Yoshimura M,Kaise H,et al.Concurrent use of Sr-89 chloride with zoledronic acid is safe and effective for breast cancer patients with painful bone metastases[J].Exp Ther Med, 2012,3(2):226-230.
[16]Robinson RG,Spi cer JA,Preston DF,et al.Treatment of metastatic bone pain with 89Sr[J].Nucl Med Biol,1987,14(3):219-222.
[17]Crawford ED,Balmer C,Kozlowski JM,et al.The use of 89Sr for palliation of pain from bone metastases associated with hormone refractory prostate cancer[J].Urology,1994,44(4):481-485.
[18]Kasalicky J,Krajská V.The effect of repeated strontium-89 chlo⁃ride therapy on bone pain palliation in patients with skeletal can⁃cer metastases[J].Eur J Nucl Med,1998,25(10):1362-1367.
(2015-10-12收稿)
(2015-11-18修回)
(编辑:杨红欣)
Safety and efficiency evaluation of the combined therapy of89Sr plus zoledronic acid in patients with painful bone metastases
Qingju ZHANG,Wengui XU,Dong DAI,Xiuyu SONG
Correspondence to:Wengui XU;E-mail:wenguixy@tom.com
Department of Molecular Imaging and Nuclear Medicine,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China.
Objective:To evaluate and compare the safety and efficiency of the combined therapy of89Sr plus zoledronic acid and those of89Sr-chloride alone,in patients with painful bone metastases.Methods:A total of 87 patients with osseous metastasis were randomly divided into treatment groups of89Sr-chloride alone(group A,53 patients)and89Sr plus zoledronic acid(group B,34 patients).A total of 17 patients in group B received zoledronic acid 2-14 days after 89Sr therapy,and 13 other patients in the group received 89Sr 4-7 days after zoledronic-acid therapy.Pain response and KPS score were evaluated after the different treatments.Results:No obvious bone marrow suppression and liver damage were found in all cases.All patients who received both89Sr-chloride and89Sr plus zoledronic acid showed reduced bone pain and total discomfort,as well as improved KPS score,but the response was more pronounced in group B (P=0.047;P=0.036).No statistical differences in pain score and KPS scores were observed between the groups treated with zoledronic acid first and89Sr therapy first(P=1.000;P=0.667).Comparison of bone pain relief and changes in the KPS score of different primary tumors after treatment with89Sr-chloride or 89Sr plus zoledronic acid showed no statistical significance.Conclusion:Compared with89Sr-chloride,treatment with89Sr plus zoledronic acid was more effective in patients with painful bone metastases.The safety of these two treatments are similar.
89Sr,zoledronic acid,bone metastases,combined therapy
10.3969/j.issn.1000-8179.2015.23.113

张青菊 专业方向为恶性肿瘤的分子影像诊断及核素治疗。
天津医科大学肿瘤医院分子影像与核医学诊疗科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060)
徐文贵 wenguixy@tom.com
E-mail:476114480@qq.com
