MIF在不同分子分型乳腺癌中的表达和意义
2015-02-18苏洳鋗蒋依娜李晓峰王鸿雁
苏洳鋗,蒋依娜,邓 元,李晓峰,王鸿雁
(西安交通大学医学部第一附属医院:1.肿瘤内科,陕西西安 710061;2.病理科,陕西西安 710061)
乳腺癌患者在免疫表型、病理组织学形态、生物学特征等方面存在明显个体化差异。对病理组织类型和术后临床分期大致相同的乳腺癌患者,实施同一治疗方案后,其治疗敏感性和预后转归也常存迥异。基于此,乳腺癌的分类分型逐步聚焦于分子层面[1-2]。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种源于T淋巴细胞的细胞因子,其在肿瘤的发生发展中发挥了重要作用[3]。但MIF与不同分子分型乳腺癌的关系研究却少有报道。本研究拟分析不同分子分型乳腺癌中MIF的表达差异,比较MIF与乳腺癌临床病理特征关系,探索不同分型乳腺癌的分子生物学特征。
1 材料与方法
1.1 病例选择及随访 收集2003年1月至2006年12月在西安交通大学医学部第一附属医院行改良根治切除的乳腺癌标本100例。入选病例均有完整的临床资料,年龄30~73岁,中位年龄52.37岁。肿瘤直径0.90~7.90cm,平均2.90cm。参照第七版AJCC/UICC标准进行病理组织学分型和术后临床分期。非特异性浸润性导管癌参照Bloom-Richardson半定量法进行组织学分级。乳腺癌患者的随访从切除术后开始,至少随访5年。终点定义为患者因乳腺癌死亡,排除其他原因死亡和失访的患者。
1.2 主要试剂 兔抗人ER、PR、HER2单克隆抗体购自福州迈新公司;鼠抗人CK5/6、CK14以及兔抗人EGFR购自北京中杉金桥公司;鼠抗人MIF单克隆抗体购自美国圣克鲁斯公司。
1.3 免疫组化SP染色 标本蜡块切片,厚度2~4μm。二甲苯Ⅰ、Ⅱ、Ⅲ,及无水乙醇、950mL/L乙醇、900mL/L乙醇、850mL/L乙醇依次浸泡。30 mL/L甲醇双氧水阻断内源性过氧化物酶。蒸馏水及PBS缓冲液清洗。组织抗原修复,滴加一抗80μL张,30℃孵育。滴加二抗,DAB显色,苏木素复染,脱水,透明,封片,镜检。
1.4 免疫组化阳性定位和判读标准 ①ER、PR表达定位于细胞核,呈棕黄色。ER、PR阳性标准:染色强度和阳性细胞百分比总计分≥3,为阳性。其中染色强度计分标准为:阴性0分,弱阳性1分,中等阳性2分,强阳性3分;阳性细胞百分比计分标准为:<1%为1分,1%~10%为2分,11%~33%为3分,34%~66%为4分,≥67%为5分。②HER2表达定位于细胞膜,呈黄色或棕黄色。HER2阳性标准:>30%癌细胞呈强且完整的细胞膜棕褐色为HER2(3+),即HER2阳性;>10%癌细胞呈完整细胞膜着色,但着色不均匀或强弱不确定为 HER2(2+),即HER2不确定表达;癌细胞不着色或呈不完整的细胞膜着色为 HER2(-)或 HER2(1+),即 HER2阴性。③CK5/6、CK14表达定位于细胞质,呈棕黄色;EGFR表达定位于细胞质或细胞膜,呈棕黄色。CK5/6、CK14、EGFR阳性标准:阳性细胞数>10%视为CK5/6、CK14、EGFR阳性。④MIF表达定位于细胞质,呈棕黄色。MIF阳性标准:染色程度分级与阳性细胞百分比乘积>4者为阳性。其中染色程度分级标准为:不着色0级,淡黄色1级,黄色2级,棕黄或黄褐色3级。阳性细胞百分比标准为:<5%为0级,5%~25%为1级,25%~50%为2级,>50%为3级。
1.5 乳腺癌分子分型标准 依据ER、PR、HER2、CK5/6、CK14、EGFR阳性表达,将100例乳腺癌标本分为Luminal型、HER2(+)型、基底细胞样型(BLs型)和正常乳腺样型(NBLs型)。ER(+)/PR(+)、且 HER2(+)者为 Luminal型;ER(-)、PR(-)、且 HER2(+)者为 HER2(+)型;ER(-)、PR(-)、HER2(-)、且 CK5/6(+)/CK14(+)/EGFR(+)者为 BLs型;ER(-)、PR(-)、HER2(-)、CK5/6(-)、CK14(-)、EGFR(-)为 NBLs型[5]。
1.6 微血管密度(MVD)计数标准 于低倍镜下观察整张切片血管分布情况,选择癌灶周围间质血管密集区,在200倍视野内计算3个不同区域的MVD数,取其平均值,换算成/mm2。凡能被CD34标记为棕色的单个内皮细胞或内皮细胞群,则为一个微血管。有明显肌层的血管以及硬化区域的血管则不计数。
1.7 统计学处理 应用SPSS 16.0统计学软件,计量资料表示为均数±标准差(±s),两组间比较采用两独立样本t检验;样本方差不齐时,则选用校正t检验(t′检验)。计数资料表示为例(百分率),组间比较采用χ2检验、连续校正的χ2检验或确切概率法。等级资料(肿瘤大小、术后TMN分期等)的组间比较采用秩和检验。相关性分析采用Spearman双变量相关性分析。生存分析采用Kaplan-Meier法,生存曲线用Log-rank检验比较。P<0.05表示差异有统计学意义。
2 结 果
2.1 一般资料和分子分型 100例乳腺癌患者均为女性。非特异性浸润性导管癌67例,浸润性小叶癌16例,髓样癌11例,黏液癌6例。非特异性浸润性导管癌中Ⅰ级3例,Ⅱ级19例,Ⅲ级45例。临床Ⅰ期34例,Ⅱ期52例,Ⅲ~Ⅳ14例。Luminal型、HER2(+)型、BLs型和NBLs型乳腺癌分布为49%(49例)、15%(15例)、25%(25例)、11%(11例)。见图1。
2.2 MIF与分子分型的关系 MIF在Luminal型、HER2(+)型、BLs型和NBLs型乳腺癌中阳性表达率分别为34.6%(17/49)、73.3%(11/15)、32%(8/25)、36.3%(4/11)。各分子分型中 MIF表达有统计学差异(P<0.05,表1)。进一步用Spearman等级相关分析发现,MIF表达与HER2(+)型乳腺癌呈正相关,提示MIF阳性者多为HER2(+)型乳腺癌。

图1 各免疫指标的阳性结果Fig.1 Positive results of immunohistochemistry SP
2.3 MIF与临床病理参数的关系 MIF在不同年龄、肿瘤大小、绝经状态、肿瘤组织学类型、病理组织学分级和术后临床分期的患者间无明显统计学差异(P>0.05),但在不同腋窝淋巴结转移状态的患者间有统计学差异(P<0.05,表1)。进一步用Spearman等级相关分析发现,MIF表达与腋窝淋巴结转移呈正相关,提示MIF阳性者易发生腋窝淋巴结转移。
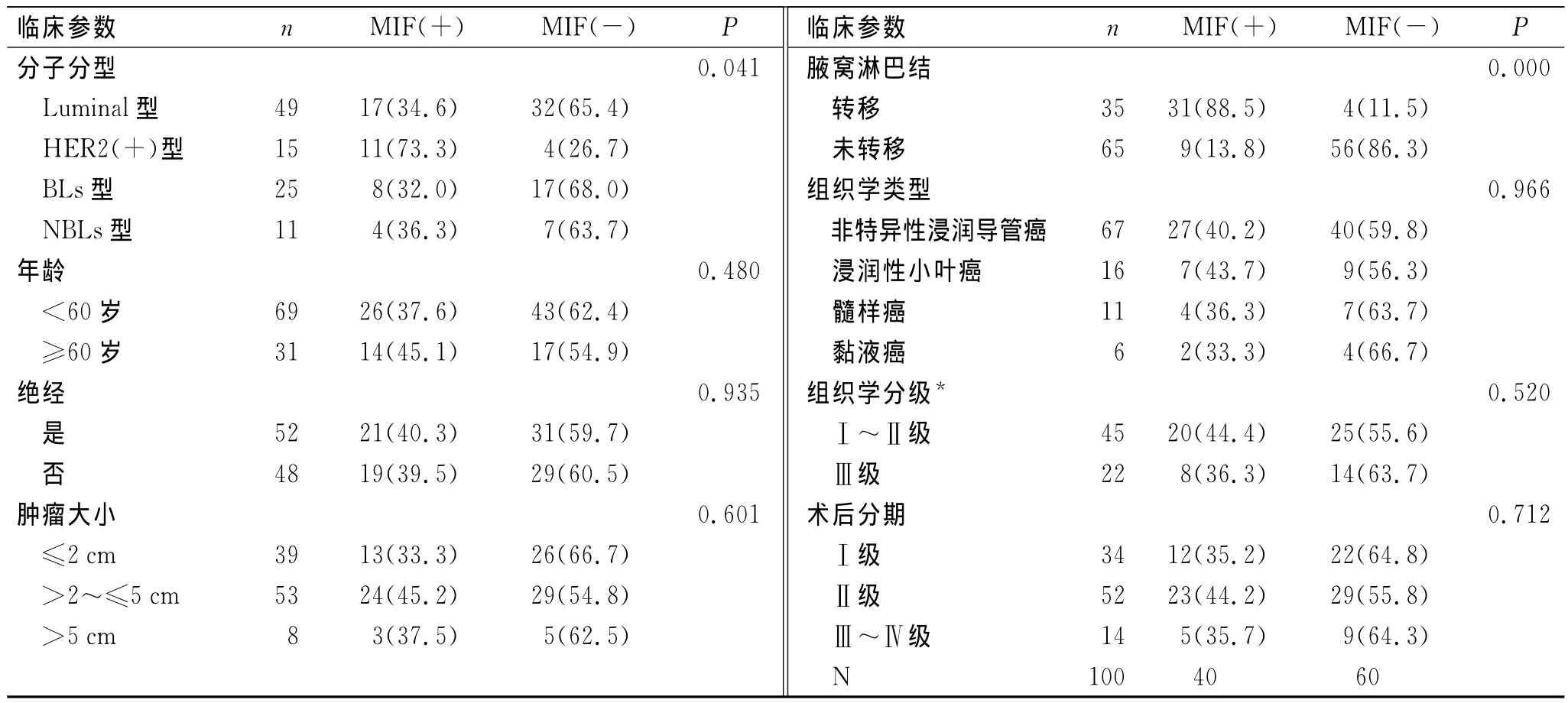
表1 不同分子分型及临床病理参数的乳腺癌患者的MIF表达Tab.1 The expression of MIF in different molecular subtypes and clinical pathological parameters of breast cancer
2.4 MIF与MVD的关系 100例乳腺癌病例中,40例 MIF阳性者 MVD均值为33.23±11.06/200倍视野,明显高于60例阴性者 MVD均值18.44±5.08/200倍视野,差异有统计学意义(P<0.05)。提示MIF阳性者MVD值较高,肿瘤血管新生明显。
2.5 MIF与乳腺癌预后的关系 100例乳腺癌患者,死亡59例,5年生存率为41%。40例MIF阳性的患者中31例死亡,中位生存时间为18个月;60例MIF阴性的患者中28例死亡,中位生存时间为36个月。Kaplan-Meier法示MIF阳性者和MIF阴性者间的生存曲线(图2)。生存曲线用Log-rank检验(Log-rank值为19.516,P=0.000)后证实,MIF阴性者的5年生存率明显高于MIF阳性者,提示MIF阳性的乳腺癌患者预后较差。
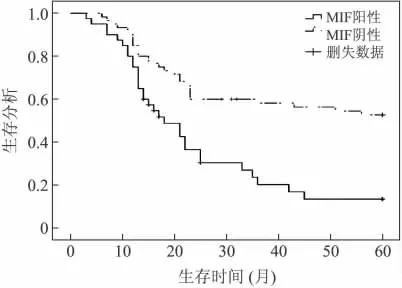
图2 Kaplan-Meier法示MIF阳性者和阴性者的5年生存情况Fig.2 Kaplan-Meier method showed 5-year overall survival of the patients with positive-MIF expression and negative-MIF expression
3 讨 论
乳腺癌分子分型大致为4种:Luminal型、HER2(+)型、BLs型和NBLs。每个分型可进一步再分类[4]。分型依据主要为各分型间蛋白标记物表达的差异。虽有学者提出,免疫组化划分分子亚型与标准的基因芯片划分方法有一定差异,但前者已能基本反映乳腺癌各分子分型特征,且敏感性在76%,特异性为100%[5],故已被普遍认可。本研究亦采用免疫组化SP法,根据ER、PR、HER2、CK5/6、CK14、EGFR表达差异,将100例乳腺癌划分为Luminal型、HER2(+)型、BLs型和NBLs型。因样本量限制,未对每个分型再分类。分型操作过程简便、经济。各分子分型乳腺癌的发病率尚无统一定论[6]。KIM 等[7]对776例浸润性乳腺癌进行分子分型归类后发现,Luminal A型发病率约44.5%,Luminal B型7.8%,HER2(+)型17.1%,BLs型14.7%。IHEMELANDU 等[8]同样大样本量分析了乳腺癌各分子分型发病率,结果显示Luminal A 型、Luminal B型、BLs型、HER2(+)型发病率为50%、14.1%、23.2%、12.7%。本研究样本中Luminal型分布最多(49例),符合既往文献中Luminal型高发病率的结论。
近年来,有关MIF在乳腺癌中表达及临床意义的报道并不少见。但本研究将MIF与乳腺癌分子分型联系起来,对此较少涉及的方向进行探索。结果发现,MIF阳性者多见于 HER2(+)型乳腺癌,提示HER2(+)型乳腺癌的一个重要分子特征很可能是MIF阳性。回顾既往研究,不同分子分型乳腺癌恶性生物学特征存在明显差异。HER2(+)型乳腺癌多肿瘤直径较大,淋巴结转移多见,病理分期较晚,预后较差[9]。乳腺癌各分型的预后研究也指出,Luminal A型预后最佳,Luminal B型和 NBLs型预后较好,而BLs型和 HER2(+)型预后最差[10-11]。
在MIF影响乳腺癌发生发展机制研究中,已证实炎症细胞和肿瘤细胞之间存在某种协同关系。在肿瘤细胞侵袭区域及其邻近间质组织中,多有巨噬细胞聚集。巨噬细胞通过分泌MIF等生物因子,协助肿瘤细胞产生降解细胞外基质的酶类,促进肿瘤细胞侵袭、扩散和转移,并提供肿瘤组织中血管内皮细胞分裂、增殖,促进肿瘤血管新生[12]。本研究比较了不同临床病理参数乳腺癌患者的 MIF表达,分析了MIF阳性组和阴性组MVD值差异,并比较了MIF阳性者和阴性者的5年生存情况。结果发现,MIF阳性者易发生腋窝淋巴结转移,肿瘤新生血管更为明显,且预后较差。HAWKINS等[13]研究显示,MIF在乳腺癌中的表达程度直接关系到肿瘤的预后评估和治疗策略。HLA可通过影响MIF,一定程度发挥乳腺癌免疫靶向治疗的作用。SCHULZ等[14]在MIF促进乳腺癌发生发展的机制研究中指出,HER2/ErbB2过表达可控制HSF1活性。而 MIF、AKT和HSF1间的相互影响会促进HER2(+)型乳腺癌恶性生长。结合本研究结果,MIF的表达程度很可能是乳腺癌恶性生物学特征的一个重要促进因素。FERSCHING等[13]研究表明,乳腺癌预后标记物合理筛选直接关系到手术、化疗等治疗策略的制定,以及有效减少化疗毒副作用。而 MIF、sFAS、CEA、CA15-3等生物因子的表达程度对评估乳腺癌预后意义重大。MIF可作为一种预测癌细胞侵袭、转移、预后的标志物。
综上所述,基于MIF促进肿瘤发生发展的正性作用和HER2(+)型乳腺癌高于其他分型(Luminal或NBLs)的生物学特征,我们推测:MIF不仅是HER2(+)型乳腺癌的一个分子特征,而且直接或间接影响了HER2(+)型的恶性生物学特征。针对HER2(+)型乳腺癌的抗MIF靶向药物,很可能是一种乳腺癌靶向治疗新思路。虽然MIF与HER2(+)型乳腺癌恶性生物学特征的关系仍待大样本量研究给予证实,但探索不同分型乳腺癌的分子生物学特征和潜在靶向治疗靶点临床意义重大。
[1]BEABER EF,MALONE KE,TANG MT,et al.Oral contraceptives and breast cancer risk overall and by molecular subtype among young women[J].Cancer Epidemiol Biomarkers Prev,2014,23(5):755-764.
[2]CHEN X,SUN L,CONG Y,et al.Baseline staging tests based on molecular subtype is necessary for newly diagnosed breast cancer[J].J Exp Clin Cancer Res,2014,17(33):28.
[3]SCHULZ R,MOLL UM.Targeting the heat shock protein90:a rational way to inhibit macrophage migration inhibitory factor function in cancer[J].CurrOpin Oncol,2014,26(1):108-113.
[4]De RONDE JJ,BONDER MJ,LIPS EH,et al.Breast cancer subtype specific classifiers of response to neoadjuvant chemotherapy do not outperform classifiers trained on all subtypes[J].PLoS One,2014,9(2):e88551.
[5]WIECHMANN L,SAMPSON M,STEMPEL M,et al.Presenting features of breast cancer differ by molecular subtype[J].Ann Surg Oncol,2009,16(10):2705-2710.
[6]SINGH R,GUPTA S,PAWAR SB,et al.Evaluation of ER,PR and HER-2 receptor expression in breast cancer patients presenting to a semi urban cancer centre in Western India[J].J Cancer Res Ther,2014,10(1):26-28.
[7]IHEMELANDU CU,LEFFALL LD,DEWITTY RL,et al.Molecular breast cancer subtypes in premenopausal and postmenopausal African-American women:age-specific prevalence and survival[J].J Surg Res,2007,143:109-118.
[8]KIM MJ,RO JY,AHN SH.Clinicopathologic significance of the basal-like subtype of breast cancer:a comparison with hormone receptor and Her2/neu-overexpressing phenotypes[J].Human Pathology,2006,37:1217-1226.
[9]De BOER R,BEITH J,CHIRGWIN J,et al.Systemic treatment of HER2+ metastatic breast cancer:Clinical conundrums and future perspectives[J].Asia Pac J Clin Oncol,2014,10(Suppl S4):15-25.
[10]GNANT M,BARTSCH R,STEGER GG.VHER2-positive breast cancer:a new piece of the puzzle[J].Lancet Oncol,2014,15(7):668-669.
[11]WILCKEN N,ZDENKOWSKI N,WHITE M,et al.Systemic treatment of HER2-positive metastatic breast cancer:A systematic review[J].Asia Pac J Clin Oncol,2014,10(Suppl S4):1-14.
[12]LIPPITZ BE.Cytokine patterns in patients with cancer:a systematic review[J].Lancet Oncol,2013,14(6):e218-228.
[13]HAWKINS O,VERMA B,LIGHTFOOT S,et al.An HLA-presented fragment of macrophage migration inhibitory factor is a therapeutic target for invasive breast cancer[J].J Immunol,2011,186(11):6607-6616.
[14]SCHULZ R,STRELLER F,SCHEEL AH,et al.HER2/ErbB2 activates HSF1 and thereby controls HSP90 clients including MIF in HER2-overexpressing breast cancer[J].Cell Death Dis,2014,2(5):e980.
[15]FERSCHING DM,NAGEL D,SIEGELE B,et al.Apoptosisrelated biomarkers sFAS,MIF,ICAM-1 and PAI-1in serum of breast cancer patients undergoing neoadjuvant chemotherapy[J].Anticancer Res,2012,32(5):2047-2058.
