一氧化氮合酶在胃食管反流病患者食道黏膜的表达
2015-02-18郭晓燕任春蓉
郭晓燕,王 婷,董 蕾,秦 斌,姜 炅,任春蓉
(西安交通大学医学部第二附属医院消化内科,陕西西安 710004)
胃食管反流病(gastroesophageal reflux disease,GERD)是消化系统的一种常见病,近年的流行病学调查显示亚洲地区GERD的症状和反流性食管炎的流行率较以往普遍升高[1-2]。GERD的发病与多因素有关,目前认为主要因素是胃食管连接部抗反流屏障结构和(或)功能障碍以及食管防御功能进行性丧失[3]。一氧化氮(NO)可调节食管括约肌的张力,其增多使括约肌松弛,其减少使括约肌收缩。一氧化氮合酶(nitric oxide synthase,NOS)分布的量和活性可直接影响到NO的形成和作用[4]。nNOS与神经递质有关,iNOS与炎性介质有关。国内外目前少有报道GERD患者的中食管下段黏膜组织nNOS、iNOS密度变化、活性及mRNA表达是否有差异。本课题从蛋白和基因水平同时研究其表达,旨在探讨GERD发生中NO相关分子发生的变化,为临床开拓新的治疗方法提供更确切的理论依据。
1 资料与方法
1.1 对象与材料 选取2007年10月至2010年3月在西安交通大学医学部第二附属医院消化内科门诊就诊的12例非糜烂性反流病(NERD)、13例反流性食管炎(RE)和8例健康对照。NERD的诊断标准为有胃食管反流症状但内镜下无反流性食管炎表现者。RE以国际公认的胃镜下反流性食管炎诊断标准(洛杉矶分类法)选取,均符合以下条件:有反酸、烧心等典型症状;经胃镜检查除外消化性溃疡和肿瘤等器质性疾病,无明显的胃及十二指肠炎症;无腹部手术史;无肝胆疾病及严重的全身疾病,无结缔组织病和糖尿病病史。此外,由于吸烟、饮酒、肥胖、幽门螺杆菌感染等因素均参与了GERD的发生,所以入选对象均为非肥胖者、无吸烟、饮酒等不良习惯,无幽门螺杆菌感染史。正常对照组选取无反酸、烧心等症状,无免疫疾病、感染疾病病史,胃镜下食管下段黏膜无明显病变的功能性消化不良患者。所有研究对象均知情同意,并且本研究获得西安交通大学医学部第二附属医院伦理委员会批准。
PENTAX电子胃镜由西安交通大学医学部第二附属医院消化内科提供;兔抗人NOS-1(nNOS)多克隆抗体和兔抗人NOS-2(iNOS)多克隆抗体购自北京博奥森生物技术公司。免疫组化二抗购自中杉金桥公司,Trizol Reagent购自Invitrogen公司,免疫组化染色图像采集使用Aristoplan Q570C图像分析仪(莱卡公司)。
1.2 标本取材 内镜检查由同一位熟练的内镜医师按操作标准进行。活检方法:经胃镜活检孔活检齿状线上方4块食管黏膜组织,RE于病变明显部位多点取材,所取组织中2块立即用100mL/L甲醛固定4h后行HE染色及免疫组化实验,另2块组织立刻放入液氮速冻30min后放入-70℃冰箱保存待用。
1.3 食道黏膜的HE染色 将标本制备蜡块,连续切片,片厚3~5μm,常规脱蜡、水化后→苏木素液染色5min→自来水冲洗苏木素至返蓝→去离子水浸泡2min→伊红液染色30s→800mL/L乙醇1min→950mL/L乙醇Ⅰ3min,2次→无水乙醇5min,2次→二甲苯3min,2次→中性树胶封固。染色结果:细胞核呈蓝色,胞质、黏膜肌层呈深浅不一的红色。经病理学专家鉴定选取各组符合诊断条件的标本行免疫组化分析。
1.4 食道黏膜组织nNOS、iNOS免疫组化染色 所取食道黏膜石蜡包埋组织行4~5μm连续切片,58℃电热恒温干燥箱过夜,脱蜡至水,梯度乙醇水洗,30mL/L过氧化氢去除内源性过氧化物酶,室温置10min,PBS冲洗,高压锅120℃修复4min,PBS冲洗,滴加一抗(一抗浓度为1∶100),37℃水浴2h,PBS冲洗,滴加生物素化二抗,37℃水浴1h,PBS冲洗,室温下DAB显色,苏木精复染,明胶封片。采用Image pro plus 6.0软件进行免疫组化表达强弱的判定分析。
1.5 Real-time PCR检测 按说明书要求提取RNA,经琼脂糖凝胶电泳鉴定,―80℃保存待用。并用Nano DropND-1000分光光度计测定含量和纯度,根据测定RNA含量结果进行标准化。并按说明书要求合成cDNA并进一步行实时荧光定量PCR。以NCBI GenBank中提供的人类基因序列行NOS引物 设 计,序 列 为 nNOS-P1,5′-AGCCGAGGCCAAAAACTGAGAA-3′,nNOS-P2,5′-AATGGGGAGAAATTCGGCTGTG-3′,iNOS-P1,5′-TTCCACGTTGGCAGGGTCCC-3′,iNOS-P2,5′-GATGCCCGCAGGTGTTCCA-3′。内参基因采用β-actin,序列为 Forward Primer 5′-ATCGTGCGTGACATTAAGGAGAAG-3′,Reverse Primer 5′-AATGGGGAGAAATTCGGCTGTG-3′,由北京奥科生物技术有限责任公司合成。反应体系:Real-time PCR Master Mix(2×)12.5μL,上下游引物(10μmol/L)各1μL,cDNA 1μL,Green DNA Ⅰdye(5×)3μL,用DEPC水将总反应体积调至25μL。反应条件为:95℃15min,然后95℃30s,60℃1min,72℃30s共40循环。同时用去离子水代替cDNA作为PCR反应体系的阴性对照。
1.6 统计学分析 采用SPSS 13.0软件处理数据。实验结果以±s表示。多组间比较采用单因素方差分析(ANOVA)检验,两组间比较使用Turkey t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般临床资料的比较 12例NERD患者,7例男性,5例女性,平均年龄42.42岁;13例RE患者,8例男性,5例女性,平均年龄43.92岁;8例对照者为5例男性,3例女性,平均年龄43.5岁,各组间患者年龄、性别差异均无统计学意义(P>0.05)。12例RE患者内镜下食管下段黏膜均表现为充血、糜烂,少数患者可见溃疡形成,有的溃疡融合成斑片状。8例对照者和12例NERD患者的内镜下鳞、柱状上皮交界(SCJ)和胃食管交界(EGJ)位于同一水平面,贲门开闭良好,齿状线清晰、无上移,食管下段及贲门黏膜光滑、血管纹理清晰。
2.2 食道黏膜HE染色的比较 正常对照组除可见正常的食管复层鳞状上皮和固有层,尚可见小动、静脉,有的可深达黏膜肌层,镜下未见中性粒细胞及嗜酸性粒细胞等炎性改变,符合正常食管下段的组织形态(图1A)。NERD镜下多数无异常表现,有时可见上皮基底细胞厚度增加,固有层乳头延长,伸向上皮层,无炎性细胞浸润(图1B)。RE中病变较轻者可见鳞状上皮增生、不规则增厚,棘层亦增厚,基底层变厚,黏膜固有层乳头上移,深入上皮超过65%,表层鳞状细胞水肿、空泡变性(图1C)。
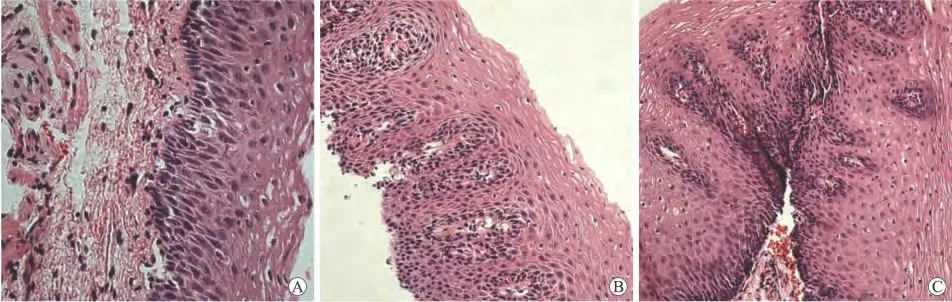
图1 各组食道黏膜HE染色结果Fig.1 HE staining of esophageal mucosa in each group
2.3 食管黏膜中nNOS和iNOS的分布比较 RE组nNOS蛋白主要在食管黏膜上皮细胞胞质中表达,密集分布,胞质呈深黄至棕黄颗粒(图2A),NERD组也主要在食管黏膜上皮细胞胞质中表达,但分布不如RE组密集,胞质颜色呈浅黄色至黄色(图2B)。正常对照组nNOS蛋白在食管黏膜上皮细胞中有少量表达(图2C)。
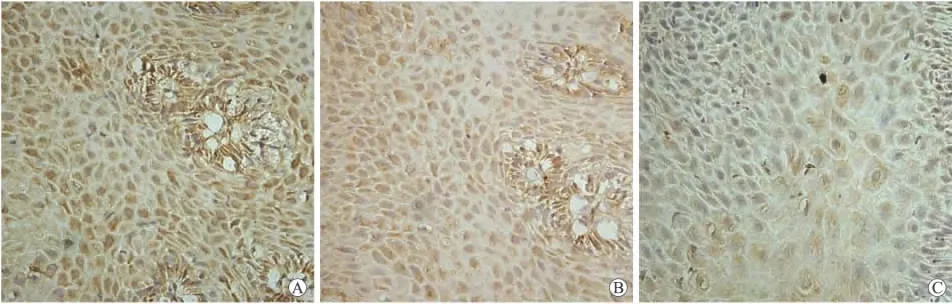
图2 RE、NERD和正常对照组的食道黏膜nNOS的分布Fig.2 Distribution of nNOS in the esophagus of RE and GERD patients and healthy subjects(×400)
RE组iNOS蛋白亦主要在食管黏膜上皮细胞中表达,密集分布,胞质呈深黄至棕黄颗粒,少量iNOS细胞核也呈阳性(图3A);NERD组也主要在食管黏膜上皮细胞胞质中表达,但分布不如RE组密集,胞质颜色呈浅黄色至黄色(图3B)。正常对照组iNOS蛋白在食管黏膜上皮细胞中几乎未见表达(图3C)。
2.4 食管黏膜中NOS含量的比较 nNOS和iNOS蛋白在食管黏膜中表达量均为RE组最大,NERD组次之,对照组最小,差异均有统计学意义(表1)。
2.5 食管黏膜中NOS mRNA含量的比较 各组内参基因Ct值基本接近,表明实验稳定。Ct值与mRNA的初始含量成反比。将各组Ct值带入Real-time PCR专用软件行随机化检验(randomization test),RE和NERD组的人食管下段黏膜nNOS mRNA和iNOS mRNA Ct值较对照组小,mRNA表达量丰富,与对照组相比差异有有统计学意义,而RE和NERD组比较差异亦有统计学意义,两种基因在RE组中的表达量最多(图4)。
表1 NOS免疫组化染色灰度值的比较Tab.1 Comparison of immunohistological staining gray value of NOS(±s)
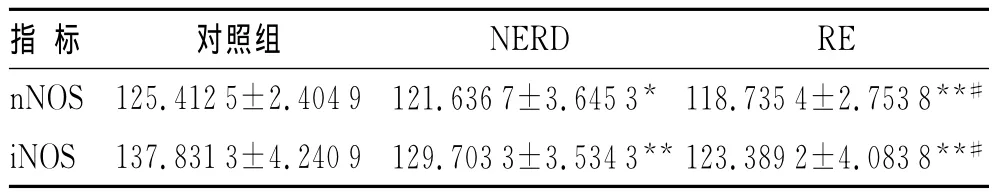
表1 NOS免疫组化染色灰度值的比较Tab.1 Comparison of immunohistological staining gray value of NOS(±s)
与对照组比较,*P<0.05,**P<0.01,与NERD组比较,#P<0.01。
指 标 对照组NERD RE nNOS 125.412 5±2.404 9 121.636 7±3.645 3* 118.735 4±2.753 8**#iNOS 137.831 3±4.240 9 129.703 3±3.534 3**123.389 2±4.083 8**#

图3 食道iNOS在RE、NERD和正常黏膜的分布Fig.3 Distribution of iNOS in the esophagus in RE and GERD patients and healthy subjects

图4 RE、NERD和正常组食管粘膜nNOS(A)和iNOS(B)mRNA表达的比较Fig.4 Expressions of nNOS(A)and iNOS(B)mRNA in the esophagus of RE patients,GERD patients and healthy subjects
3 讨 论
GERD是指胃十二指肠内容物反复反流入食管的相关疾病,亚洲地区以每周至少发作1次烧心或反流为诊断标准,再按照内镜下食管表现,分为RE、NERD和Barrett食管炎3个类型[5-6]。近年患病率逐年上升[7],在我国进行的GERD流行病学调查,预测本病的年、月和周流行率分别为29.8%、8.9%和2.5%[8],这虽然比西方发达国家低,但仍然造成了沉重的社会和经济负担。
GERD发生发展的病理生理学变化主要为食管抗反流屏障功能减弱、食管黏膜屏障受损、反流的胃和(或)十二指肠内容物侵袭食管黏膜,这也是各种类型GERD的共同发病机制的基础。食管主要受兴奋性运动神经元和抑制性运动神经元双重共同支配,食管上段为横纹肌,主要受胆碱能神经支配,食管下段的环形平滑肌则主要受非胆碱能神经支配,其中食管下括约肌(LES)的神经支配中抑制性运动神经元起主要作用。目前,已经证实了NO为肠神经系统中非肾上腺素能以及非胆碱能神经的主要抑制性神经递质,该递质介导的食管反应可能涉及到LES松弛、LES和食管环行肌的超极化及食管平滑肌的终止反应,对维持其一定的张力起着重要作用,张力下降可能导致 TLESR 频繁发生[4,9-10]。
NO由NOS介导生成,该酶是NO合成过程中唯一的限速酶,NO的生成量及生物学效应直接受到其活性变化的调节,因此常采用测定NOS活性反映其组织细胞中NO的含量,并了解NO的合成部位以研究NO在不同部位的病理生理作用。现已证实,食管括约肌张力受NO调节,NO增多使括约肌松弛,NO减少使括约肌收缩[4],其机制目前认为[11-13],一方面NO可能是TLESR的启动因子,激活鸟苷酸环化酶,使环磷鸟苷增加,降低细胞内Ca2+或对Ca2+的敏感性,引起肌肉松弛,从而使LES松弛,其中nNOS起到了主要作用[7];另一方面使依赖cGMP的蛋白激酶活性上升,促使蛋白磷酸化使肌肉松弛,从而使LES松弛;另外,NO又是一种炎性介质,一般认为iNOS在正常状态下不表达,需细胞因子等刺激后才会诱导性表达,而产生的NO则介导后继效应,并与超氧化物反应产生过氧化亚硝酸(PXN),后者加速脂类和巯基化合物的氧化反应,引起急慢性炎症[14]。目前,普遍认为导致食管黏膜损伤的重要因素是NOS的高表达,它产生的NO可能与食管疾病的发生和进程有关。
本研究应用免疫组织化学方法检测了nNOS和iNOS在RE、NERD患者和正常食管黏膜组织中的表达,观察发现RE患者食管黏膜组织中两种NOS分布和表达均出现异常,食管黏膜上皮阳性细胞数目增多,密集分布,着色加深,胞质呈深黄至棕黄颗粒,NERD组也主要在食管黏膜上皮细胞中表达,但分布不如RE组密集,胞质颜色呈浅黄色至黄色。正常对照组nNOS蛋白在食管黏膜上皮细胞中有少量表达,而iNOS表达缺如,分析各组间灰度并进行两两比较,差异亦有统计学意义(P<0.05),其中iNOS在RE中表达的结果与文献报道一致[15]。同时,采用Real-time PCR方法检测两种NOS mRNA的相对含量,从基因水平进一步论证其在GERD中的发展变化,发现3组之间也有显著差异,mRNA表达量由正常食管黏膜到NERD再到RE逐渐递增。GERD患者食管下段黏膜组织两种NOS的分布和表达异常,共同引起食管组织内、细胞内和细胞间NO分布及量的改变,提示iNOS和nNOS可能共同引发食管平滑肌的收缩和舒张障碍,随着病情逐渐加剧,这种改变有进行性加重的趋势。该异常表达可能与LES的功能失调有关,从而出现反酸、嗳气、胸骨后疼痛等临床症状,反流又可刺激食管组织产生NO,这也进一步说明在GERD发生发展中,NO可能是导致损伤的主要机制之一。
综上所述,本研究探索了GERD患者食管下段黏膜组织中nNOS、iNOS的蛋白和mRNA的表达变化,为临床开拓新的治疗方法提供了理论上的依据。但由于时间、经费等各方面的限制,本研究仅在小样本范围内进行了探讨,以后还需要在大样本研究中进一步证实。
[1]WONG BC,KINISHOITA Y.Systematic review on epidemiology of gastroesophageal reflux disease in Asia[J].Clin Gastroenterol Hepatol,2006,(4)4:398-407.
[2]GOH KL.Changing epidemiology of gastroesophageal reflux disease in the Asian-Pacific region:an overview[J].Gastroenterol Hepatol,2004,19(9):S22-S25.
[3]陈灏珠.实用内科学[M].第十二版.北京:人民卫生出版社,2007:1849-1852.
[4]谢勇,黄缘,王崇文,等.下食管括约肌压力与局部组织内一氧化氮和血管活性肠肽含量的关系[J].中华消化内镜杂志,1999,16(6):334-336.
[5]FOCK KM,TALLEY NJ,FASS R,et al.亚太地区胃食管反流病的处理共识:更新版[J].胃肠病学,2008,13(7):421-436.
[6]LIU X,LI M,XU D,et al.Prevalence and clinical importance of gastroesophageal reflux in Chinese patients with systemic sclerosis[J].Clin Exp Rheumatol,2012,30(2S71):S60-S66.
[7]JUNG HK,HONG SJ,JO YJ,et al.Updated guidelines 2012 for gastroesophageal reflux disease[J].Korean J Gastroenterol,2012,60(4):195-218.
[8]WONG WM,LAI KC,LAM KF,et al.Prevalence,clinical spectrum and health care utilization of gastroesophageal reflux disease in a Chinese population:apopulation-based study[J].Aliment Pharmacol Ther,2003,18(6):595-604.
[9]TAKAHASHI T.Pathophysiological significance of neuronal nitric oxide synthase in the gastrointestinal tract[J].J Gastroenterol,2003,38(5):421-430.
[10]HIRSCH DP,HOLLOWAY RH,TYTGAT GNJ,et al.Involvement of nitric oxide in human transient lower esophageal sphincter relaxations and esophageal primary peristalsis[J].Gastroenterology,1998,115(6):1374-1380.
[11]王薇,付亮,高欣,等.胆汁反流与食管下端括约肌组织中一氧化氮及血管活性肠肽的关系[J].中国综合临床,2005,21(2):134-136.
[12]朱晓燕,林培茂.胃食管反流病中一氧化氮、血管活性肠肽对食管的作用[J].中华现代中西医杂志,2003,1(2):109-112.
[13]袁圆,林中,李小玲.伴胃肠动力障碍的重症急性胰腺炎大鼠结肠黏膜下神经节一氧化氮合酶阳性神经元的变化[J].郑州大学学报:医学版,2013,48(1):47-50.
[14]DE-GIORGIO R,PARODI JE,BRECHA NC,et al.Nitric oxide producing neurons in the monkey and human digestive system[J].I Comp Neurol,1994,342(4):619-627.
[15]李军杰,郑勇,王月香,等.诱导型一氧化氮合酶在反流性食管炎患者食管黏膜中的表达[J].胃肠病学和肝病学杂志,2007,16(3):209-212.
