大骨节病软骨细胞线粒体功能及其与患者年龄的相关性
2015-02-18刘江涛庞清江吴翠艳
刘江涛,庞清江,王 云,吴翠艳,郭 雄
(1.宁波市第二医院骨科中心,浙江宁波 315010;2.西安交通大学医学部公共卫生系、教育部环境与疾病相关基因重点实验室,陕西西安 710061)
大骨节病(Kashin-Beck disease,KBD)是一种地方性退行性骨关节疾病,主要分布在我国从东北至西南的狭长区域[1]。本病的病因尚不明确,但在过去150年里提出了50余种相关危险因素,目前主要集中在三种病因假说:生物地球化学(低硒)假说,粮食真菌毒素污染中毒假说,以及饮用水有机质污染假说[2]。大骨节病的特征性病变为关节软骨和生长板软骨的深层细胞坏死,软骨基质丧失,进而导致继发性骨关节病和骨关节畸形,严重者可致伤残和劳动能力丧失[3]。成熟软骨组织中的唯一细胞类型为软骨细胞,它产生并维持软骨基质,且参与软骨组织损伤的修复[4]。
线粒体(mitochondrion)在许多细胞活动中发挥着重要作用,包括产生三磷酸腺苷(adenosine triphosphate,ATP)为细胞供能,大量中间代谢产物的氧化和细胞内环境稳态的调节等。线粒体还是细胞内氧自由基产生的场所,同时本身也是氧自由基攻击的靶标[5]。线粒体功能障碍可引起细胞内的多种信号级联反应、氧化应激反应以及细胞死亡等[6]。
既往研究表明,大骨节病患者软骨细胞线粒体损伤[7],且在粮食真菌毒素和环境低硒等有害可疑致病因素实验中,软骨细胞线粒体损伤的形态学改变明显[8]。由于大骨节病软骨损伤主要发生在儿童和青少年中,随着年龄的增长而关节软骨损伤加重,是否软骨线粒体功能损伤与年龄有关尚不明确。本研究重点评估大骨节病患者关节软骨细胞的线粒体功能及其与年龄的关系。
1 材料与方法
1.1 主要试剂 DMEM购自Hyclone公司,胎牛血清购自兰州民海公司,Ⅱ型胶原酶购自Gibco公司,TMRM荧光探针、ATP检测试剂盒和活性氧检测试剂盒购自GIBCO/Invitrogen公司。
1.2 软骨组织和细胞培养 关节软骨组织来自10例大骨节病患者和8例正常对照。大骨节病患者是按照大骨节病诊断标准[7]被诊断为Ⅱ度和Ⅲ度的患者(4女/6男,43岁至60岁),并在接受全膝关节置换术时取其软骨。正常膝关节软骨取自死于交通意外的捐献者新鲜尸体(3女/5男,33岁至62岁)。分离软骨细胞:PBS冲洗3次,37℃孵育10min。胰蛋白酶处理之后,将软骨切片置于Ⅱ型胶原酶溶液中37℃孵育12~16h。纱布过滤除去未消化的软骨碎片,软骨细胞接种于DMEM培养瓶中,50mL/L CO2培养箱37℃孵育,培养液每周更换2~3次。原代或一代细胞用于所有实验。锥虫蓝染色评估细胞活力。
1.3 线粒体呼吸链复合体活性的测定 用分光光度法测定呼吸链复合体活性[9]。将5~40μg的线粒体蛋白加入到终体积为1mL的缓冲液中,分别加入各自的底物后,通过测定340nm波长处还原型烟酰胺腺嘌呤二核 苷 酸 (nicotinamide adenine dinucleotide-reduced,NADH)吸光度值计算复合体Ⅰ活性、600nm处二氯酚靛酚(2,6-dichlorophenolindophenol,DCPIP)吸光度值计算复合体Ⅱ活性、550nm处还原型细胞色素C吸光度值计算复合体Ⅲ活性,550nm处还原型细胞色素C吸光度值计算复合体Ⅳ活性,以及412nm处5-硫-2-硝基苯甲酸[5,5′-dithiobis(2-nitrobenzoic acid),DTNB]吸光度值计算柠檬酸合酶的活性。用柠檬酸合酶活性来标准化线粒体呼吸链复合体活性,酶活性单位为nmol/min/mg protein。
1.4 细胞内ATP含量的检测 细胞内ATP含量检测根据GIBCO/Invitrogen公司的ATP检测试剂盒说明书操作。离心收集1×106细胞,TD洗细胞一次,悬浮于100μL TE缓冲液。先冰上孵育5min;再100℃沸水煮5min。然后14 000g离心2~3min,留取上清到新的EP管;BCA法测定蛋白浓度。双蒸水稀释ATP标准溶液稀释成适当的浓度梯度:0、0.001、0.01、0.1、1、10μmol/L。加样品和ATP 标准溶液到ATP检测标准反应混合物。利用Biotek Synergy HT多功能微孔板检测仪检测化学发光,绘制标准曲线,根据标准曲线计算样品中的ATP含量。
1.5 线粒体膜电位的检测 离心收集1×106细胞,PBS洗涤细胞1次,悬浮细胞于200nmol/L TMRM工作液中,37℃避光孵育15min。PBS洗细胞3次,重新悬浮细胞后转移到不透明黑色96孔板,Biotek Synergy HT多功能微孔板检测仪于540nm激发波长检测荧光变化。以Hoechst 33342作为对照,设定激发波长392nm,计算相对线粒体膜电位。
1.6 细胞内活性氧的检测 收集1×106cells/mL密度的细胞,以含10μmol/L DCFH-DA的PBS(pH 7.4)取代培养基,37℃避光孵育1h,流式细胞仪在485nm激发波长和530nm发射波长检测DCFH的荧光强度。结果以控制荧光强度的百分率表示,荧光强度反映氧化应激水平。
1.7 统计学分析 采用SPSS 13.0统计软件处理,组间比较采用独立样本t检验,线粒体功能与年龄相关性研究采用线性回归分析,结果用均数±标准差(±s)表示,P<0.05为差异有统计学意义。
2 结 果
2.1 正常和大骨节病软骨细胞线粒体呼吸链复合体活性的比较 线粒体呼吸链复合体活性检测结果显示,与正常人软骨细胞相比,大骨节病患者软骨细胞线粒体复合体Ⅱ、Ⅲ和Ⅳ活性均显著下降;相反,柠檬酸合酶活性显著增加。大骨节病患者软骨细胞线粒体蛋白含量和复合体Ⅰ活性虽有下降,但与正常对照相比差异并无统计学意义(表1)。
2.2 线粒体呼吸链复合体活性与患者年龄的关系 线性回归分析显示,不论是大骨节病还是正常对照组,软骨细胞复合体Ⅰ活性和患者年龄之间没有相关性;同时,尽管复合体Ⅱ、Ⅲ和Ⅳ活性在大骨节病明显低于正常对照,但是它们和年龄之间也没有发现相关性(图1、表2)。
表1 正常和大骨节病软骨细胞线粒体呼吸链复合体活性的比较Tab.1 Specific activity of the mitochondrial respiratory chain complexes in normal and KBD chondrocytes(±s)
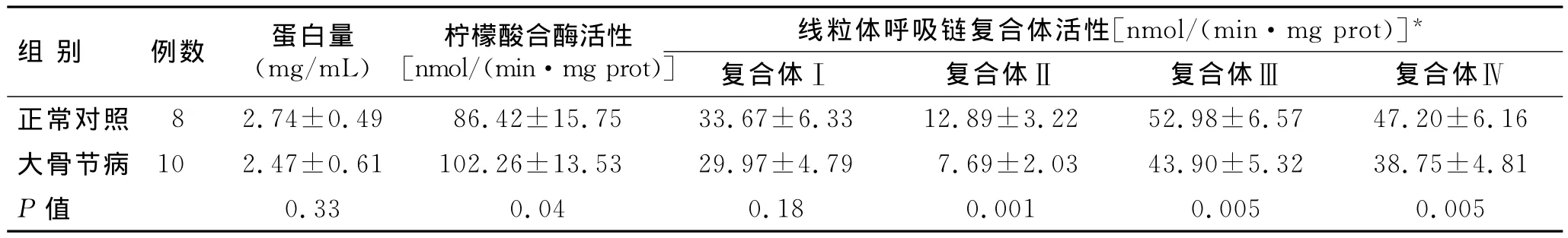
表1 正常和大骨节病软骨细胞线粒体呼吸链复合体活性的比较Tab.1 Specific activity of the mitochondrial respiratory chain complexes in normal and KBD chondrocytes(±s)
* 线粒体呼吸酶链复合体活性用柠檬酸合酶活性校正为:mmol/(min·mg prot)/(柠檬酸合酶活性)×100。
组别 例数 蛋白量(mg/mL)柠檬酸合酶活性[nmol/(min·mg prot)]线粒体呼吸链复合体活性[nmol/(min·mg prot)]*复合体Ⅰ 复合体Ⅱ 复合体Ⅲ 复合体Ⅳ正常对照 8 2.74±0.49 86.42±15.75 33.67±6.33 12.89±3.22 52.98±6.57 47.20±6.16大骨节病 10 2.47±0.61 102.26±13.53 29.97±4.79 7.69±2.03 43.90±5.32 38.75±4.81 P值0.33 0.04 0.18 0.001 0.005 0.005
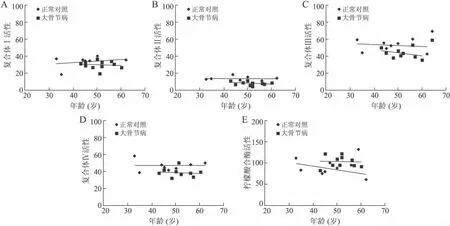
图1 2组线粒体呼吸链复合体活性和年龄的关系Fig.1 Correlation between activity of mitochondrial respiratory chain complexes and donor age in normal and KBD chondrocytes
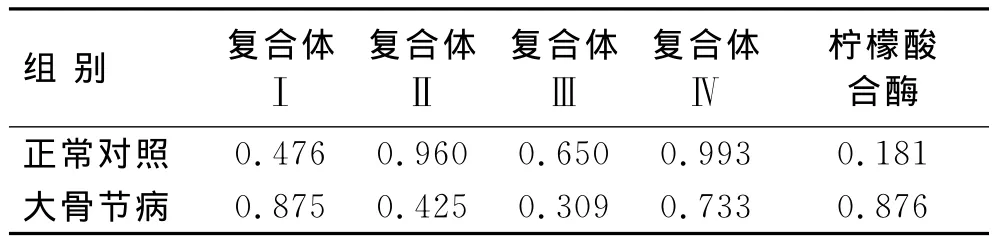
表2 2组线粒体呼吸链复合体活性和年龄相关性的P值Tab.2 P-value of correlation between donor age and activity of mitochondrial respiratory chain complexes (P)
2.3 细胞内ATP含量的分析 大骨节病患者软骨细胞内ATP水平(30.68±4.96)比正常软骨细胞(42.15±7.27)明显下降,且差异具有统计学意义(P=0.001)(图2)。
2.4 软骨细胞线粒体膜电位水平 荧光探针TMRM检测线粒体膜电位结果显示,大骨节病软骨细胞(1.78±0.39)与正常软骨细胞(2.72±0.55)相比,线粒体膜电位显著下降(P=0.001,图3)。
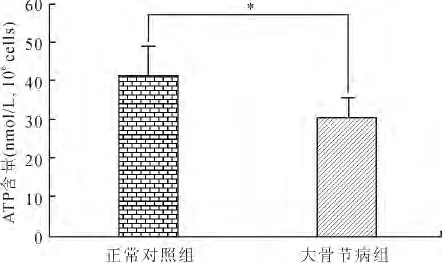
图2 正常对照组和大骨节病组软骨细胞内ATP含量的比较Fig.2 Cellular ATP content in normal and KBD chondrocytes
2.5 2组线粒体膜电位和年龄的关系 虽然细胞内线粒体膜电位水平随着年龄的增加而下降,但是回归分析并未证明二者在大骨节病患者软骨细胞(P=0.36)或正常软骨细胞(P=0.25)之间存在着关联性(图4)。
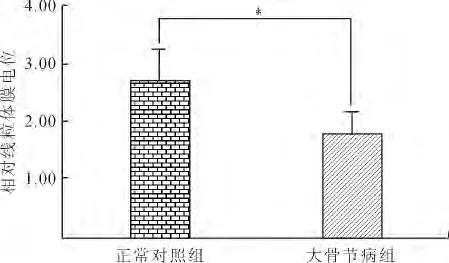
图3 正常和大骨节病软骨细胞线粒体膜电位水平的比较Fig.3 Mitochondrial membrane potential in normal and KBD chondrocytes
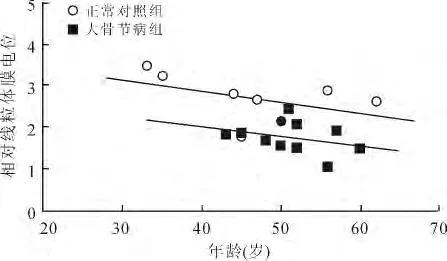
图4 软骨细胞线粒体膜电位和年龄的相关性Fig.4 Correlation between mitochondrial membrane potential and donor age
2.6 细胞内活性氧含量的比较 细胞内活性氧含量反映了线粒体产生和清除氧自由基的功能,过量的活性氧产生会导致细胞凋亡增加。Carboxy-H2DCFDA荧光探针检测细胞内活性氧,与正常软骨细胞相比,大骨节病软骨细胞内的活性氧含量增加了1.2倍,差异具有统计学意义(P<0.001)(图5)。
3 讨 论
本研究首次证实了成人大骨节病患者存在软骨细胞线粒体功能的改变,包括线粒体数目的增多,线粒体呼吸链复合体功能障碍,ATP耗竭,线粒体去极化,以及活性氧含量的增加;线粒体功能与年龄在大骨节病和正常对照组间均无显著相关性。
在氧化磷酸化过程中,线粒体内膜上的四个电子传递链复合体(呼吸链复合体Ⅰ~Ⅳ)协调作用生成ATP,产生能量。对大骨节病软骨细胞线粒体电子传递链复合体Ⅰ~Ⅳ活性的研究发现,复合体Ⅱ、Ⅲ和Ⅳ活性明显降低,与对照组相比分别降低了40.34%、17.14%和17.90%,电子传递链功能因此受损。而线粒体电子传递链功能的下降可能通过以下三种途径得以补偿:①通过增加线粒体数量,柠檬酸合酶活性增加反映了大骨节病软骨细胞线粒体数目的增多[10];②通过复合体Ⅰ(NADH 脱氢酶)途径,有氧呼吸中线粒体呼吸链复合体Ⅰ需要较少的氧消耗[11],而多元回归分析证实复合体Ⅰ活性未见明显降低;③还可能通过增加无氧代谢避免过多活性氧的产生[12]。呼吸链复合体活性的下降,会导致细胞内ATP含量的减少。实验证实,大骨节病软骨细胞内ATP含量比对照组减少27.14%。
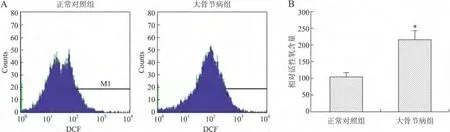
图5 正常对照组和大骨节病组软骨细胞内活性氧含量的比较Fig.5 Intracellular ROS level in normal and KBD chondrocytes
细胞线粒体膜电位的维持与细胞内多种因素有关。首先,需要线粒体呼吸链复合体功能的正常[13]。研究证实,利用线粒体呼吸链复合体特异性抑制剂或RNA干扰技术阻断呼吸链复合体活性,均可导致线粒体膜电位的降低[14]。其次,细胞内ATP水平对维持线粒体膜电位也非常重要。细胞内ATP和线粒体膜电位相互依存,细胞利用ATP来维持线粒体膜电位,同时ATP的产生也需要线粒体提供正常范围内的膜电位[15]。大骨节病软骨细胞呼吸链酶复合体活性的降低和ATP含量的减少,最终导致细胞线粒体膜电位的下降。而较低的线粒体膜电位会导致细胞内ATP含量和线粒体呼吸链复合体功能的进一步下降,形成一种恶性循环。
在生物体内,氧化和抗氧化处于平衡的状态,正常情况下的细胞代谢需要线粒体消耗氧来满足机体的营养和能量需求,进行三大营养物质代谢和生成ATP;另一方面线粒体自身富含的多种酶、结构蛋白、膜脂质及核酸等,也是活性氧直接攻击的目标[16]。线粒体功能的损伤势必引起细胞氧利用率的降低,从而产生更多的ROS,造成线粒体和细胞内氧化损伤的恶性循环[17]。大骨节病软骨细胞活性氧含量比正常对照增加1.2倍,同时线粒体功能明显受损,说明线粒体功能损伤和氧化应激相互作用的不良循环在大骨节病的发病过程中起到重要的作用。
年龄因素被认为是与线粒体功能密切相关的一个重要指标,线粒体功能通常随着年龄的增加而降低[18]。但在本研究中,我们并未发现大骨节病或正常对照者的线粒体功能与年龄相关。复合体Ⅱ、Ⅲ、Ⅳ和柠檬酸合酶活性随年龄的增加而减少,但无统计学意义;相反,复合体Ⅰ活性随年龄的增加而升高,同样它和年龄之间也无统计学意义。细胞内线粒体膜电位水平随着年龄的增加而下降,回归分析也未能证明二者之间在大骨节病软骨细胞或正常软骨细胞存在关联性。这种结果可能因为以下几方面的原因:①软骨细胞中无氧代谢功能代偿性增强,掩盖了部分线粒体功能随年龄变化的趋势。②大骨节病发病期主要在儿童,到中老年期病情相对平稳,线粒体能也趋于稳定[19]。③由于软骨样本的特殊性,每个年龄段的病例数有限,未能真实的反映线粒体功能随年龄变化的趋势。
总之,线粒体功能障碍参与了大骨节病的病理生理改变,可能在大骨节病的发病过程中发挥了重要作用。大骨节病患者的软骨细胞线粒体复合体Ⅱ、Ⅲ和Ⅳ活性、细胞内ATP含量、以及线粒体膜电位的显著降低。相反,软骨细胞线粒体数目却明显增多。这可能是机体为维持细胞内的ATP产量,代偿性升高线粒体量以弥补线粒体氧化磷酸能力的降低。在大骨节病和正常对照组中,线粒体功能与年龄均无显著相关性,说明大骨节病和软骨老龄化可能是不同的代谢过程。
[1]中华人民共和国国家卫生和计划生育委员会.2013年我国卫生和计划生育事业发展统计公报[EB].2014.http://www.nhfpc.gov.cn/guihuaxxs/s10742/201405/886f82dafa344c3097f1d16581a1bea2.shtml.
[2]全国大骨节病监测组.2006年全国大骨节病病情监测总结报告[J].中国地方病学杂志,2006,25(6):670-672.
[3]GUO X,MA WJ,ZHANG F,et al.Recent advances in the research of an endemic osteochondropathy in China:Kashin-Beck disease[J].Osteoarthr Cartilage,2014,22(11):1774-1783.
[4]MERA H,ITOKAZU M,WAKITANI S.Cartilage repair and regenerative medicine:past,present,and future[J].Clin Calcium,2013,23(12):1715-1722.
[5]VENDITTI P,DI STEFANO L,DI MEO S.Mitochondrial metabolism of reactive oxygen species[J].Mitochondrion,2013,13(2):71-82.
[6]BRAND MD,NICHOLLS DG.Assessing mitochondrial dysfunction in cells[J].Biochem J,2011,435(2):297-312.
[7]LIU JT,GUO X,MA WJ,et al.Mitochondrial function is altered in articular chondrocytes of an endemic osteoarthritis,Kashin-Beck disease[J].Osteoarthr Cartilage,2010,18(9):1218-1226.
[8]YAN D,KANG P,YANG J,et al.The effect of Kashin-Beck disease-affected feed and T-2 toxin on the bone development of Wistar rats[J].Int J Rheum Dis,2010,13(3):266-272.
[9]MANEIRO E,MARTIN MA,DE ANDRES MC,et al.Mitochondrial respiratory activity is altered in osteoarthritic human articular chondrocytes[J].Arthritis Rheum,2003,48(3):700-708.
[10]CILLERO-PASTOR B,MARTIN MA,ARENAS J,et al.Effect of nitric oxide on mitochondrial activity of human synovial cells[J].BMC Musculoskelet Disord,2011,12:42.
[11]SHARMA LK,LU J,BAI Y.Mitochondrial respiratory complex I:structure,function and implication in human diseases[J].Curr Med Chem,2009,16(10):1266-1277.
[12]ALMEIDA A,ALMEIDA J,BOLANOS JP,et al.Different responses of astrocytes and neurons to nitric oxide:the role of glycolytically generated ATP in astrocyte protection[J].Proc Natl Acad Sci USA,2001,98:15294-15299.
[13]JOHNSON K,JUNG A,MURPHY A,et al.Mitochondrial oxidative phosphorylation is a downstream regulator of nitric oxide effects on chondrocyte matrix synthesis and mineralization[J].Arthritis Rheum,2000,43(7):1560-1570.
[14]LOPEZ-ARMADA MJ,CARAMES B,MARTIN MA,et al.Mitochondrial activity is modulated by TNFa and IL-1beta in normal human chondrocyte cells[J].Osteoarthr Cartilage,2006,14(10):1011-1022.
[15]BRAND MD,NICHOLLS DG.Assessing mitochondrial dysfunction in cells[J].Biochem J,2011,435(2):297-312.
[16]RABILLOUD T,HELLER M,RIGOBELLO MP,et al.The mitochondrial antioxidant defence system and its response to oxidative stress[J].Proteomics,2001,1(9):1105-1110.
[17]ZOROV DB,JUHASZOVA M,SOLLOTT SJ.Mitochondrial reactive oxygen species(ROS)and ROS-induced ROS release[J].Physiol Rev,2014,94(3):909-950.
[18]GREEN DR,GALLUZZI L,KROEMER G.Mitochondria and the autophagy-inflammation-cell death axis in organismal aging[J].Science,2011,333(6046):1109-1112.
[19]FANG H,GUO X,FAROOQ U,et al.Development and validation of a quality of life instrument for Kashin-Beck disease:an endemic osteoarthritis in China[J].Osteoarthr Cartilage,2012,20(7):630-637.
