Twist和VEGF在上皮性卵巢癌中的表达
2015-02-18杨丽娜
杨丽娜,吴 娟,赵 静,戴 斌,杨 红
(1.第四军医大学西京医院妇产科,陕西西安 710032;2.中国兵器工业卫生研究所,陕西西安 710065;3.第四军医大学西京医院肝胆胰脾外科,陕西西安 710032)
卵巢癌是妇科三大恶性肿瘤之一,其发病率位居女性生殖系统恶性肿瘤第二位,但致死率却为各类妇科肿瘤之首[1],对妇女的生命健康造成严重威胁。美国癌症学会最新报道称,2013年大约有22 240新发病例被诊断为卵巢癌,同年14 030名患者死于该疾病[2]。它具有起病隐匿、易转移、预后差等特点。随着现代检测及治疗手段的进步,卵巢癌治疗取得了长足进展,但由于其较高的转移率及复发率,总体预后依旧较差。因此,探讨卵巢癌的发病机制以及探寻影响其浸润、转移的关键因素,将有利于提高卵巢癌患者的总体治疗有效率及生存率。Twist蛋白既是一种癌基因蛋白,又是调控上皮间质化(epithelial-mesenchy-mal transition,EMT)的重要转录因子,与细胞凋亡及恶性肿瘤的形成、侵袭、转移有密切关系[3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是肿瘤血管形成的关键调控因子,是目前所知作用最强的血管生成刺激因子,通过刺激血管内皮细胞增殖和移行,增加肿瘤血管的通透性,增强癌细胞浸润能力,最终促进恶性肿瘤的发展和侵袭转移,已成为肿瘤治疗新靶点。目前,两者在卵巢癌中的关系尚无报道。本研究通过免疫组织化学法,检测Twist和VEGF在卵巢癌中的表达,分析两者与临床病理特征的关系,并探讨它们在卵巢癌侵袭、转移中的作用及相关性。
1 资料与方法
1.1 标本来源 本实验所有标本选自2010年9月至2013年1月第四军医大学西京医院及陕西省中医学院附属第二医院行手术切除并经病理证实为上皮性卵巢癌及正常卵巢组织所制蜡块,其中上皮性卵巢癌组织标本80例,均为原发性肿瘤,术前未接受放化疗、未服用激素类药物。年龄:<50岁43例,≥50岁37例;FIGO分期:Ⅰ~Ⅱ期43例,Ⅲ~Ⅳ期37例;病理分级:Gl级28例,G2级35例,G3级17例;组织分化类型:浆液性囊腺癌51例,黏液性囊腺癌29例;淋巴结转移:有转移20例,无转移60例。对照组10例正常卵巢组织来自卵巢活检病例和因子宫肌瘤、功能性子宫出血或子宫脱垂行全子宫切除同时行卵巢切除病例,病理证实卵巢组织无异常。
1.2 主要试剂 Twist兔抗人单克隆抗体购自英国Abcam公司,工作浓度按照1∶100的体积浓度进行稀释。VEGF鼠抗人单克隆抗体(一抗稀释浓度为1∶50)、SP免疫组织化学染色试剂盒、浓缩型DAB试剂盒均购自北京中杉金桥生物技术公司。
1.3 方法 采用免疫组化SP法,所有标本经40g/L多聚甲醛液固定,常规石蜡包埋,4μm厚连续切片,染色步骤严格按照试剂盒说明书进行,石蜡切片常规脱蜡,PBS冲洗,高温高压抗原修复,加Twist及VEGF工作液4℃过夜,DAB显色,苏木精复染,中性树胶封固。PBS代替一抗作为阴性对照。
1.3.1 结果判断 按照半定量积分法判定结果:光镜下,以胞质出现棕色或棕褐色颗粒作为阳性结果,由2名病理医师进行独立双盲评分。每张切片随机选取5个400倍光学显微镜下视野,将所选取视野中阳性细胞的染色范围及染色强度依据以下标准进行半定量化,最终结果取平均值。具体标准为:①染色范围计分,将阳性细胞数占总细胞数的比率按照<5%,6%~25%,26%~50%,51%~75%,>75%分别记为0、1、2、3、4分;②染色强度分,按照未染色、淡黄色、棕色、棕褐色分别记为0、1、2、3分。染色范围计分与染色强度计分乘积为染色结果:0~2分为阴性表达(-),≥3分为阳性表达,其中3~6分为低表达(+),7~12分为高表达(■)。
1.3.2 统计学分析 计数资料以百分率表示,Twist、VEGF蛋白阳性表达率比较采用χ2检验,所有检验为双侧检验,P<0.05为差异有统计学意义,应用SPSS 17.0统计软件进行分析、求Spearman秩相关系数。
2 结 果
2.1 Twist在卵巢癌及正常卵巢组织中的的表达情况 Twist蛋白阳性染色主要定位于卵巢癌及正常卵巢细胞的胞质中,在上皮性卵巢癌组织中,60%(48/80)高表达,25%(20/80)低表达,15%(12/80)阴性表达;在正常卵巢组织中,免疫组化染色显示仅10%(1/10)低表达,其余均为阴性(图1)。

图1 Twist在正常卵巢组织(A)和上皮性卵巢癌组织(B、C、D)中的表达情况Fig.1 Expression of Twist in normal ovarian tissues and epithelial ovarian cancer tissues(×200)
2.2 VEGF在卵巢癌及正常卵巢组织中的的表达情况 VEGF蛋白阳性染色主要定位于卵巢癌及正常卵巢细胞的胞质中,在上皮性卵巢癌组织中,62.5%(50/80)高表达,23.7%(19/80)低表达,13.8%(11/80)阴性表达;在正常卵巢组织中,免疫组化染色显示低表达20%(2/10),其余80%(8/10)为阴性表达(图2)。
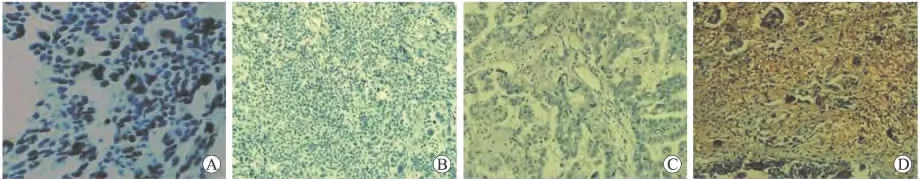
图2 VEGF在正常卵巢组织(A)和上皮性卵巢癌组织(B、C、D)中的表达情况Fig.2 Expression of VEGF in normal ovarian tissues and epithelial ovarian cancer tissues(×200)
2.3 Twist与VEGF在上皮性卵巢癌及正常卵巢组织中的表达情况 Twist与VEGF在卵巢癌组织中的阳性表达率明显高于正常卵巢组织。其中,Twist蛋白在在上皮性卵巢癌组织中的阳性表达率85%(68/80),在正常卵巢组织中的阳性表达率10%(1/10),差异有统计学意义(P<0.01);VEGF蛋白在上皮性卵巢癌组织中的阳性表达率86.25%(69/80),在正常卵巢组织中的阳性表达率20%(2/10),差异有统计学意义(P<0.01,表1)。
2.4 Twist与VEGF表达和卵巢癌临床病理特征的关系 Twist与VEGF表达水平与卵巢癌的临床分期、病理分级、淋巴结转移相关(P<0.01),与卵巢癌患者年龄、组织类型无关(P>0.05,表2)。
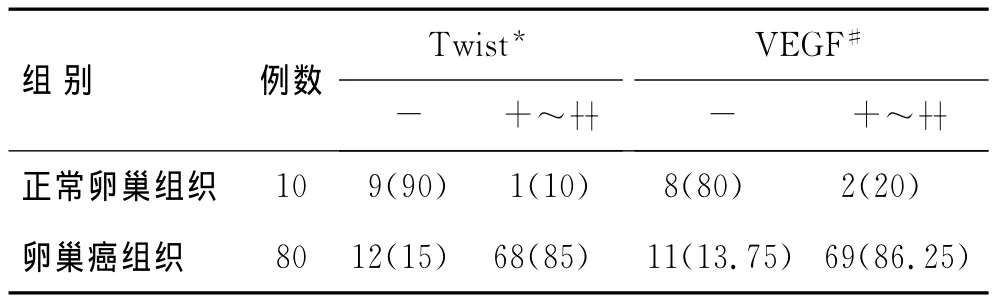
表1 Twist与VEGF在卵巢癌及正常卵巢组织中的表达情况Tab.1 The expressions of Twist and VEGF in epithelial ovarian cancer and normal ovarian tissues [n(%)]
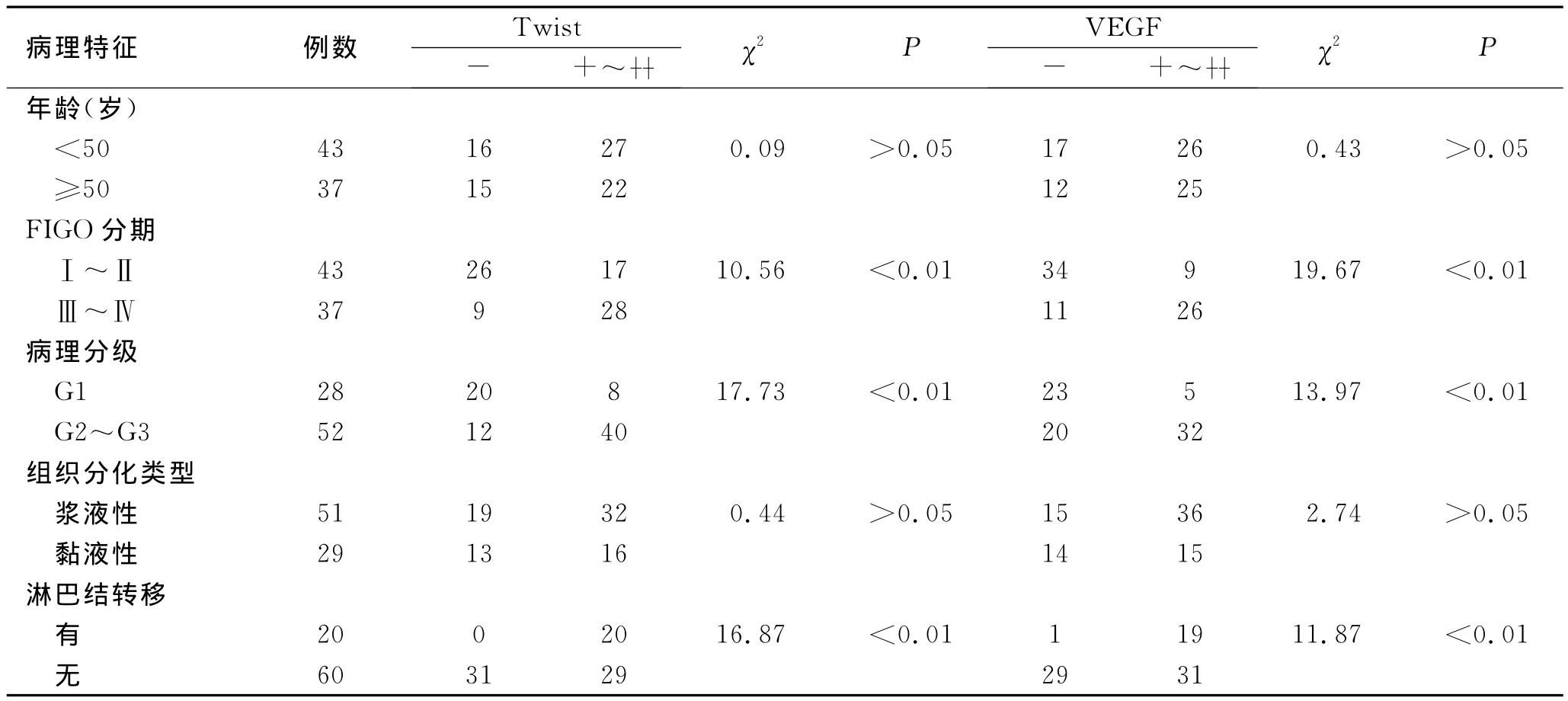
表2 Twist与VEGF蛋白表达与卵巢癌临床病理特征的关系Tab.2 Correlation of Twist and VEGF expressions with clinical pathological data of epithelial ovarian cancer
2.5 卵巢癌组织中Twist和VEGF表达的相关性分析 Spearman秩相关分析显示,在上皮性卵巢癌组织中Twist表达与VEGF的表达呈正相关(r=0.646,P<0.01,表3)。
3 讨 论
侵袭和转移是卵巢癌最重要的生物特征之一,也是卵巢癌治疗失败和死亡的直接因素。因此,如何更好地抑制癌细胞侵袭、转移成为卵巢癌临床治疗和基础研究的热点和难点。上皮间质转化,即上皮细胞从有极性的上皮表型转变为高度运动性的纤维母细胞样或间叶性表型,在早期胚胎发生中发挥重要作用。体外及体内研究均表明,上皮间质转化机制在上皮性肿瘤的进展、浸润、侵袭转移中得以激活,是上皮来源的肿瘤细胞获得侵袭性的关键分子事件,在恶性肿瘤的发展及转移播散过程中发挥主要的病理作用[4]。Twist基因最初在果蝇的胚胎发育研究中发现,可调节细胞移动和组织重建,诱导中胚层发育。目前研究证实,Twist在多种人类上皮来源肿瘤中高表达[5-7],与上皮间质转化现象及肿瘤转移密切相关,是上皮间质转化过程的关键调控因子[3]。研究表明,在乳腺癌组织中Twist通过诱导CCL2招募巨噬细胞,促进血管内皮细胞生成,形成肿瘤微血管[8]。在肝癌细胞中过表达Twist可促进癌细胞的侵袭、转移能力,Twist在诱导肝癌细胞发生EMT及生成内皮依赖性血管过程中发挥着重要的作用[9]。KAJIYAMA等[10]研究发现,Twist与卵巢癌复发、转移及不良预后相关。本研究结果表明,Twist蛋白在卵巢癌组织中的阳性表达率显著高于正常卵巢组织,同时Twist表达水平与卵巢癌的分期、病理分级及淋巴结转移相关(P<0.05),与其他文献报道的研究结果一致。提示Twist在卵巢癌的发生、发展及侵袭、转移中起作用。
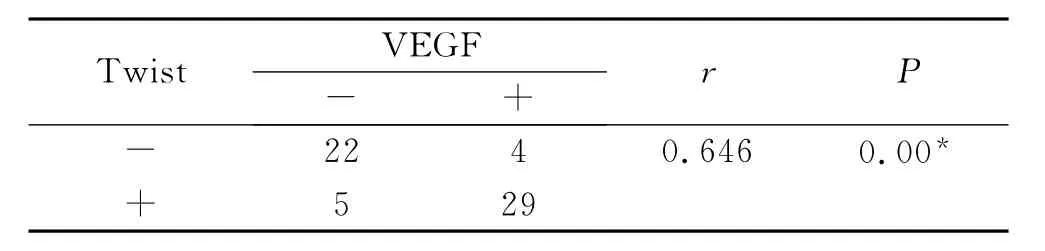
表3 Twist与VEGF在卵巢癌中表达的相关性分析Tab.3 The correlation between Twist and VEGF expressions in epithelial ovarian cancer
VEGF是一种高度特异性的促血管生成因子,通过与血管内皮细胞表面的VEGF受体(VEGFR)结合后可以调节血管内皮细胞活性,增加肿瘤血管的通透性,促进实体肿瘤的进展[11]。而肿瘤血管生成在肿瘤的生长及转移中起重要作用,被认为是肿瘤发生的重要表现,血管生成作为肿瘤生态系统中的一个重要因素参与并影响肿瘤的生物学行为[12]。本研究中卵巢癌组织中VEGF蛋白的表达明显高于正常卵巢组织,且其表达与FIGO分期、病理分级、淋巴结转移有关(P<0.05),提示VEGF是肿瘤细胞生长发展的重要促进因子,可能参与上皮性卵巢癌的发生及恶性侵袭、转移,抑制VEGF的生成,可能减缓肿瘤的侵袭。
Twist可以调节VEGF mRNA及蛋白表达在肝癌、非小细胞肺癌组织中已有相关报道[13]。有研究表明,VEGF与VEGFR结合后,胰腺癌细胞系Twist表达增加,进而出现EMT表型改变,侵袭转移能力增强[14]。MIRONCHIK等[13]通过体内外实验证实上调乳腺癌细胞Twist表达后,VEGF表达亦随之增加。本研究首次在卵巢癌中发现Twist和VEGF表达呈明显正相关(r=0.646,P<0.01),提示Twist和VEGF在卵巢癌侵袭转移中起协同作用。其机制可能是:一方面Twist增加VEGF表达,促进肿瘤血管、淋巴管生成,增加其通透性,利于肿瘤组织营养供应,加速肿瘤的演进过程,促进转移,并且脱落的癌细胞易播散于盆腹腔,进一步诱导播散部位肿瘤血管生成,从而增加其侵袭、转移能力;另一方面,VEGF通过上调Twist表达,诱导EMT,从而增强肿瘤细胞侵袭能力,促进肿瘤细胞穿过细胞外基质进入淋巴管、血管及肿瘤组织表面能,利于播散、转移。但两者的具体作用机制有待进一步明确。
[1]SALEHI F,DUNFIELD L,PHILLIPS KP,et al.Risk factors for ovarian cancer:an overview with emphasis on hormonal factors[J].Toxicol Environ Health B Crit Rev,2008,11(3-4):301-321.
[2]SIEGEL R,NAISHADHAM D,JEMAL A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[3]KANG Y,MASSAGUE J.Epithelial-mesenchymal transitions:twist in development and metastasis[J].Cell,2004,118(3):277-279.
[4]LEE JM,DEDHAR S,KALLURI R,et al.The epithelialmesenchymal transition:new insights in signaling,development,and disease[J].Cell Biol,2006,172(7):973-981.
[5]WALLERAND H,ROBERT G,PASTICIER G,et al.The epithelial-mesenchymal transition-inducing factor TWIST is an attractive target in advanced and/or metastatic bladder and prostate cancers[J].Urol Oncol,2010,28(5):473-479.
[6]YU L,LU S,TIAN J,et al.TWIST expression in hypopharyngeal cancer and the mechanism of TWIST-induced promotion of metastasis[J].Oncol Rep,2012,27(2):416-422.
[7]RU GQ,WANG HJ,XU WJ,et al.Upregulation of Twist in gastric carcinoma associated with tumor invasion and poor prognosis[J].Pathol Oncol Res,2011,17(2):341-347.
[8]LOW-MARCHELLI JM,ARDI VC,VIZCARRA EA,et al.Twist1 induces CCL2 and recruits macrophages to promote angiogenesis[J].Cancer Res,2013,73(2):662-671.
[9]CHE N,ZHAO XL,SUN T,et al.The role of Twist1in hepatocellular carcinoma angiogenesis:a clinical study[J].Hum Pathol,2011,42(6):840-847.
[10]KAJIYAMA H,HOSONO S,TERAUCHI M,et al.Twist expression predicts poor clinical outcome of patients with clear cell carcinoma of the ovary[J].Oncology,2006,71(5-6):394-401.
[11]NIEVES BJ,D'AMORE PA,BRYAN BA,et al.The function of vascular endothelial growth factor[J].Biofactors,2009,35(4):332-337.
[12]CAO Y.Angiogenesis:What can it offer for future medicine?[J].Exp Cell Res,2010,316(8):1304-1308.
[13]MIRONCHIK Y,WINNARD PT JR,VESUNA F,et al.Twist overexpression induces in vivo angiogenesis and correlates with chromosomal instability in breast cancer[J].Cancer Res,2005,65(23):10801-10809.
[14]YANG AD,CAMP ER,FAN F,et al.Vascular endothelial growth factor receptor-1 activation mediates epithelial to mesenchymal transition in human pancreatic carcinoma cells[J].Cancer Res,2006,66(1):46-51.
