肿瘤相关基因S100A6在肺腺癌组织中的表达及临床意义
2015-02-18郎红娟金发光
郎红娟 姜 华 金发光
杨拴盈2 南岩东1
肿瘤相关基因S100A6在肺腺癌组织中的表达及临床意义
郎红娟1姜华1金发光1
杨拴盈2南岩东1
第四军医大学唐都医院后备人才基金(5033)
作者单位: 710038 西安,第四军医大学唐都医院呼吸与危重症医学科1
710004 西安,西安交通大学第二附属医院呼吸内科2
EF手型钙结合蛋白S100A6是S100蛋白家族的重要成员之一,在钙离子存在的条件下,通过与靶蛋白的相互作用而发挥重要的生物学作用[1]。近年来的研究显示,S100A6基因广泛参与了肿瘤细胞的增殖、周期、凋亡、分化等一系列生物学过程,与肿瘤的发生、发展、侵袭、转移及预后关系密切[2-3]。然而,目前尚不清楚肺腺癌S100A6基因表达与其临床病理及预后的关系。为此,我们应用RT-PCR和Western-blot 等方法,对肺腺癌组织及A549肺腺癌细胞系S100A6基因表达进行检测,旨在为进一步探索S100A6基因在肺腺癌细胞恶性生物学行为作用机制的相关研究奠定基础。
对象与方法
一、研究对象
收集2010年1月至2012年1月第四军医大学唐都医院手术后肺腺癌患者标本20例,其中男10例,女10例;年龄26~73岁;具有吸烟史13例,无吸烟史7例;临床分期I期4例,Ⅱ期5例,Ⅲ期4例,Ⅳ期7例。A549人肺腺癌癌细胞购至上海中科院细胞库。
二、试验方法
1. 试剂:S100A6抗体购自美国Sigma公司,GAPDH抗体购于安博生物技术公司;PCR相关试剂购于宝生物工程(大连)有限公司;RPMI1640培养基购于Hyclone公司,胰蛋白酶、胎牛血清(Sigma公司),其他试剂均为国产或进口分析纯。
2. 组织标本处理:手术切除离体0.5 h肺腺癌标本,分别剪取大小约2 cm×2 cm×2 cm的肺癌组织及距离癌组织5 cm以上正常肺组织,生理盐水反复冲洗去除血液,放入焦碳酸二乙酯(diethylpyrocarbonate, DEPC)水处理的冻存管,储存液氮罐中。
3. 细胞培养:A549细胞采用RPMI1640培养基(含有10%新生小牛血清,100 U/ml的青霉素和100 μg/ml的链霉素),在含5%CO2、37 ℃饱和湿度的细胞培养箱中培养。
4. 肺腺癌组织S100A6 mRNA和蛋白表达检测: 应用RT-PCR检测肺腺癌组织 mRNA表达,组织匀浆后,按照Trizol说明书提取RNA,测定总RNA的纯度,将RNA逆转录为cDNA,以适量cDNA为模板,在TaqDNA聚合酶催化PCR扩增。S100A6上游引物:5′-ATGGCATGCCCCCTGGAT-3′,下游引物为:5′-TGAGGGCTTCATTGTAGATC-3′;β-actin 上游引物为:5-GTGGGGCGCCCCAGGCACCA-3,下游引物为:5-CTCCTTAATGTCACGCACGATTTC-3。扩增条件为:94 ℃/3 min;94 ℃/30 s,57 ℃/30 s,72 ℃/40 s;循环32圈。72 ℃延伸10 min。图像采集后,通过比较S100A6和β-actin mRNA条带灰度值评价A549细胞中S100A6 mRNA的相对表达量。
应用Western-blot检测S100A6 蛋白表达。组织标本匀浆,加入适量细胞裂解液,6 000×g,离心15 min,取上清,采用BCA进行蛋白质定量后置-80 ℃贮存备用。灌制12%SDS-聚丙烯酰胺凝胶,常规电泳,转膜,封闭,一抗(1︰200),4 ℃孵育过夜,二抗(1︰2 000),室温孵育2 h,ECL(化学荧光发光法)显色。图像经Uvpgrabit Image软件测定各条带的吸光度,以各条带的吸光度值与GAPDH吸光度值的比值进行蛋白表达量的比较。
5. 肺腺癌细胞S100A6 mRNA和蛋白表达检测: 收集处于对数生长期的A549细胞进行S100A6 mRNA和蛋白表达检测,具体方法同上。
三、统计学方法
统计学分析采用t检验,以P<0.05为差异具有统计学差异。
结果
一、肺腺癌组织与癌旁正常组织S100A6 mRNA和蛋白差异表达
Western-blot分析结果显示,肺腺癌组织S100A6吸光度值与GAPDH吸光度值比值为0.76±0.19,癌旁正常肺组织吸光度值比值为0.29±0.15,二者比较差异具有显著性(P<0.05),见表1。图1、2;RT-PCR分析结果显示,肺腺癌组织S100A6和β-actin mRNA条带灰度比值为0.77±0.39,癌旁正常肺组织条带灰度比值为0.15±0.08,二者比较差异具有显著性(P<0.05)。

表1 S100A6在肺腺癌组织和癌旁正常组织差异表达
注:Western Blot:免疫印迹试验;RT- PCR:逆转录PCR

图1Western-blot检测S100A6蛋白在肺腺癌组织表达,T:肺腺癌组织, N:癌旁正常肺组织
图2RT-PCR检测S100A6基因在肺腺癌组织表达,T:肺腺癌组织, N:癌旁正常肺组织
二、肺腺癌组织S100A6 mRNA和蛋白表达与临床特征关系分析
肺腺癌组织S100A6与患者临床特征关系分析显示,在大于或等于60岁和小于60岁的两个年龄组患者中S100A6 mRNA和蛋白表达均无显著性差异(P>0.05),在男、女两组之间无显著性差异(P>0.05);而吸烟指数(吸烟指数=每天吸烟支数×吸烟年数)大于或等于200组S100A6 mRNA和蛋白表达均显著高于吸烟指数小于200组(P<0.05);ⅢⅣ分期组S100A6 mRNA和蛋白表达显著高于Ⅲ分期组(P<0.05),见表2。
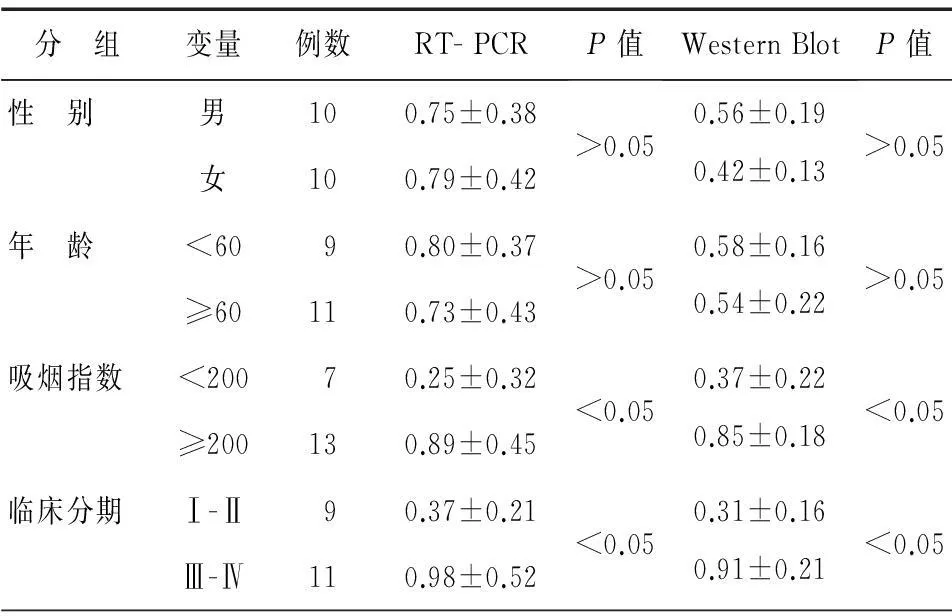
表2 S100A6表达与患者临床病理特征关系
注:Western Blot:免疫印迹试验;RT- PCR:逆转录PCR
三、A549肺腺癌细胞系S100A6 mRNA和蛋白表达
进一步检测 A549人肺腺癌细胞系S100A6 mRNA相对表达量为0.43±0.12,蛋白表达量为0.38±0.14,见图3。
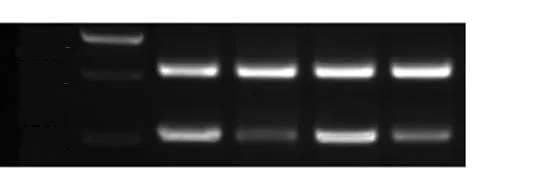
图3S100A6基因在肺腺癌A549细胞系的表达,A:Western-blot,B:RT-PCR
讨论
原发性支气管肺癌(简称肺癌)是目前最常见的恶性肿瘤之一。根据病理学和生物学行为的不同,肺癌分为鳞癌、腺癌、小细胞肺癌和大细胞未分化癌。肺腺癌发病率呈逐年上升的趋势,已经成为最常见的肺癌组织学类型之一[6]。近年来,尽管多学科联合治疗在一定程度上延长了肺腺癌的生存时间,但由于肺腺癌恶性程度高,早期即可出现胸膜、纵隔淋巴结、骨骼、脑等器官的转移,致使患者初诊时已处于Ⅲ-Ⅳ期,失去了手术治疗的时机,5年生存率仍然不足5%[7]。因此,探索肺腺癌侵袭转移的分子机制并寻找特异性的分子靶点,对肺腺癌的诊治具有重大意义。
前期应用蛋白质组学技术发现,肺腺癌组织与癌旁组织S100A6肽段峰具有显著性差异,提示其有可能作为肺腺癌重要的生物标志物[8]。S100A6钙结合蛋白是1987年Kuznicki和Filipek在研究腹水瘤过程中发现的一个钙结合蛋白,相对分子量约10.5×103,当时命名为“钙周期蛋白(Calcyclin)”,而后经研究证实Calcyclin属于S100蛋白家族[9]。现在已经明确的S100家族成员有21个,S100A6蛋白是S100蛋白家族成员之一,在细胞中呈离散性分布,主要存在于胞质、胞膜以及核被膜[10]。应用多克隆抗体技术发现S100A6蛋白存在于骨骼肌、心脏、胃、肺、肾等多种组织器官中[11-13]。S100A6蛋白功能包括钙传感器、释放细胞内钙信号、调控细胞周期及细胞分化,刺激Ca2+依赖的胰岛素释放、刺激催乳素分泌及胞外分泌等[14]。
本研究中,我们首先应用RT-PCR和Western-blot等研究方法,发现肺腺癌组织S100A6基因和蛋白表达显著高于癌旁正常肺组织(P<0.05)。进一步对S100A6表达与其临床病理特征分析,发现吸烟程度和肿瘤分期是影响其表达的重要因素,且吸烟程度越重、肿瘤分期越晚,S100A6基因和蛋白表达越明显,提示S100A6可能在致癌因素的作用下早期即参与了肺癌恶变过程,并且伴随了肺癌的侵袭、转移等一系列生物学过程。肿瘤细胞系是研究肿瘤生物学特性的重要的动物模型,但是S100A6在肺腺癌细胞系的表达情况尚不清楚,我们应用RT-PCR和Western-blot证实了S100A6基因和蛋白在A549肺腺癌细胞系能够稳定高表达,为进一步采用RNA干扰、基因敲除等方法研究S100A6参与肺癌发生发展的作用机制奠定了基础。
已有的研究也表明,S100A6在多种肿瘤组织和细胞均有表达,结直肠癌组织S100A6高表达与β-catenin和核纤层蛋白A/C(lamin A/C)形成相互作用,促进了结直肠癌形成和发展[15]。Ohuchida等[16]发现S100A6可有效区分胰腺癌和慢性胰腺炎,是用于评价胰腺恶性潜能的标志物和影响胰腺癌预后及生存的独立因子。Tamai等[17]发现S100A6可能是MLL-AF4急性淋巴细胞白血病联合异基因造血干细胞移植治疗的有效靶点。S100A6 蛋白作为肿瘤检测的标志物在临床上的应用价值正日益受到重视,比如肝癌S100A6 蛋白的表达可有效的从肝细胞癌中鉴别出胆管癌,并且明显优于甲胎蛋白、癌胚抗原、糖抗原等目前临床上常用的血清标志物[18-19]。
S100A6调控肿瘤的发生发展可能涉及复杂的信号网络机制,并与多种细胞因子相互作用有关。本研究中,我们采用R-T PCR和Western blot等研究方法初步明确了S100A6基因与蛋白在肺腺癌中的表达情况及其与肺腺癌临床病理的关系,随后我们将扩大样本量进一步建立其在肺腺癌诊断中的灵敏度、特异度及阳性预测值,并将利用分子生物学技术最终阐明S100A6在肺癌发病过程的生物学机制。
参考文献
1Ji YF, Huang H, Jiang F, et al. S100 family signaling network and related proteins in pancreatic cancer[J]. Int J Mol Med, 2014 , 33(4): 769-776.
2南岩东, 马李杰, 金发光, 等. EF手型钙结合蛋白S100A6及其与肿瘤关系的研究进展[J]. 国际呼吸杂志, 2014, 34(20): 1561-1565.
3苗静混, 周兰. S100A6的转录调控及其与肿瘤关系的研究进展[J]. 重庆医科大学学报, 2007, 32(7): 779-781.
4Raponi M, Zhang Y, Yu J, et al. Gene expression signatures for predicting prognosis of squamous cell and adenocarcinomas of the lung[J]. Cancer Res, 2006, 66(15): 7466-7472.
5任成山, 钱桂生. 支气管肺癌研究的新思维[J/CD]. 中华肺部疾病杂志:电子版, 2009, 2(3): 143-146.
6钱桂生. 肺癌不同病理类型发生率的变化情况及其原因[J/CD]. 中华肺部疾病杂志: 电子版, 2011, 4(1): 1-6.
7Ettinger DS: Ten years of progress in non-small cell lung cancer[J]. J Natl Compr Canc Netw, 2012, 10(3): 292-295.
8Nan Y, Jin F, Yang S, et al. Discovery of a set of biomarkers of human lung adenocarcinoma through cell-map proteomics and bioinformatics[J]. Med Oncol, 2010, 27(4): 1398-1406.

10Filipek A. S100A6 and CacyBP/SIP - two proteins discovered in ehrlich ascites tumor cells that are potentially involved in the degradation of beta-catenin[J]. Chemotherapy, 2006, 52(1): 32-34.

11Leniak W, Swart GW, Bloemers HP, et al. Regulation of cell specific expression of calcyclin (S100A6) in nerve cells and other tissues[J]. Acta Neurobiol Exp (Wars), 2000, 60(4): 569-575.
12Schneider G, Filipek A. S100A6 binding protein and Siah-1 interacting protein (CacyBP/SIP): spotlight on properties and cellular function[J]. Amino Acids, 2011 , 41(4): 773-780.
13Emberley ED, Murphy LC, Watson PH. S100 proteins and their influence on pro-survival pathways in cancer[J]. Biochem Cell Biol, 2004, 82(4): 508-515.
14Eckert RL, Broome AM, Ruse M, et al. S100 proteins in the epidermis [J]. J Invest Dermatol, 2004, 123(1): 23-33
15Kilanczyk E, Graczyk A, Ostrowska H, et al. S100A6 is transcriptionally regulated by beta-catenin and interacts with a novel target, lamin A/C, in colorectal cancer cells[J]. Cell Calcium, 2012, 51(6): 470-477.
16Ohuchida K, Mizumoto K, Yu J, et al. S100A6 is increased in a stepwise manner during pancreatic carcinogenesis: clinical value of expression analysis in 98 pancreatic juice samples [J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(4): 649-654.
17Tamai H, Miyake K, Yamaguchi H, et al. Resistance of MLL-AFF1positive acute lymphoblastic leukemia to tumor necrosis factor-alpha is mediated by S100A6 upregulation[J]. Blood Cancer J, 2011, 1(11): e38.
18张丽君, 刘银坤, 朱运松. 钙结合蛋白S100A6 基因的研究进展[J]. 国外医学(临床生物化学与检验学分册), 2004, 25(6):542-544.
19南岩东, 常蕊静, 穆德广, 等. 肿瘤相关蛋白S100A6结构和功能的分析与预测[J]. 现代肿瘤医学, 2013, 21(6): 1180-1184.
(本文编辑:张大春)
郎红娟,姜华,金发光,等. 肿瘤相关基因S100A6在肺腺癌组织中表达及其临床意义[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(5): 574-578.
·论著·
【摘要】目的探讨肿瘤相关基因S100A6在肺腺癌组织及肺腺癌细胞系的表达及其临床意义。方法分别应用RT-PCR和Western-blot方法对20例肺腺癌组织及其癌旁正常肺组织S100A6基因和蛋白表达进行检测,比较肺癌组织和正常肺组织之S100A6表达有无差异,对肺癌组织S100A6表达与患者临床病理特征相关性进行分析;进一步检测A549人肺腺癌细胞系S100A6基因和蛋白表达。结果肺腺癌组织S100A6 mRNA表达相对比值为0.77±0.39,癌旁正常肺组织S100A6 mRNA 表达相对比值为0.15±0.08,二者比较差异具有显著性(P<0.05);Western-blot分析结果显示,肺腺癌组织S100A6蛋白表达相对比值为0.76±0.19,癌旁正常肺组织S100A6蛋白表达相对比值为0.29±0.15,二者比较差异具有显著性(P<0.05);肺腺癌组织S100A6与患者临床特征关系分析显示,在大于或等于60岁和小于60岁的两个年龄组患者中S100A6 mRNA和蛋白表达均无显著性差异(P>0.05),在男、女两组患者之间无显著性差异(P>0.05);而吸烟指数大于或等于200组患者S100A6 mRNA和蛋白表达均显著高于吸烟指数小于200组患者(P<0.05);ⅢⅣ分期组S100A6 mRNA和蛋白表达显著高于Ⅲ分期组(P<0.05);A549人肺腺癌细胞系S100A6基因和蛋白可稳定高表达。结论S100A6在肺腺癌中明显高表达,且与肿瘤发生发展密切相关,有望作为肺腺癌的重要生物标志物。
【关键词】S100A6;肺腺癌;标志物,肿瘤;发病机制
Expression and clinical significance of tumor-associated S100A6 gene in lung adenocarcinomaLangHongjuan1,JiangHua1,JinFaguang1,YangShuanying2,NanYandong1.1DepartmentofRespiratoryMedicine,TangduHospital,FourthMilitaryMedicalUniversity,Xi′an710038,China;2DepartmentofRespiratoryMedicine,SecondAffiliatedHospitalofXi′anJiaoTongUniversity,Xi′an710004,China
Correspondingauthor:NanYandong,Email:nanyandong2008@163.com
【Abstract】ObjectiveTo investigate the expression and clinical significance of tumor-associated gene S100A6 in lung adenocarcinoma. MethodsIt was detected that the gene and protein expression of S100A6 in 20 cases of lung adenocarcinoma tissue and paraneoplastic normal lung tissue by RT-PCR and Western-blot, it was analyzed that the correlation between the clinical and pathological features and the expression of S100A6 gene and tested the expression of S100A6 gene in human lung adenocarcinoma A549 cell. ResultsThe relative expression amount of S100A6 mRNA in lung adenocarcinoma tissues and in paraneoplastic normal lung tissues were 0.77±0.39 and 0.15±0.08, respectively and the difference between the two groups was significant (P<0.05); The relative expression amount of S100A6 protein in lung adenocarcinoma tissues and in paraneoplastic normal lung tissues were 0.76±0.19 and 0.29±0.15, respectively and the difference between the two groups was significant (P<0.05). S100A6 gene and protein high expression was significantly associated with staging of lung cancer and smoking index (P<0.05), but not with age and gender (P>0.05). The gene and protein expression of S100A6 were stable and high in A549 cells. ConclusionsThe high expression of S100A6 gene in lung adenocarcinoma is closely related to tumor development and is expected as an important biomarker for lung cancer.
【Key words】S100A6;Lung adenocarcinoma;Biomarker;Pathogenesis
收稿日期:(2015-03-20)
文献标识码:中图法分类号: R563,R734.2 A
通讯作者:南岩东, Email:nanyandong2008@163.com
基金项目:国家自然科学基金(81001040);第四军医大学优秀文职人员基金(2011-01);
DOI:10.3877/cma.j.issn.1674-6902.2015.05.009
