1,25-二羟维生素D3抑制RhoA/ROCK通路减轻幼鼠海水淹溺型肺损伤的实验研究
2015-02-18罗建峰吴华杰石曌玲
罗建峰 吴华杰 石曌玲
张敏龙2 金发光2
1,25-二羟维生素D3抑制RhoA/ROCK通路减轻幼鼠海水淹溺型肺损伤的实验研究
罗建峰1吴华杰1石曌玲1
张敏龙2金发光2
淹溺是全球第三大意外死亡原因。据报道,每年因淹溺导致的死亡人数接近150万,目前也是我国0~14岁年龄组人群第一位的死因,而海水淹溺导致的死亡在其中占据了一大部分[1- 2]。呼吸心搏骤停是淹溺儿童致死最常见原因,而存活下来的患儿往往合并急性肺损伤(acute lung injury, ALI)和急性呼吸窘迫综合症(acute respiratory distress syndrome, ARDS)。前期大量研究表明,海水吸入导致了肺组织屏障通透性的增加,从而引起了肺泡腔和肺间质严重的水肿。
RhoA/ROCK (Rho-associated coil forming protein kinase) 通路是钙敏感的信号通路,该通路通过影响肌球蛋白ATP酶的活性对细胞骨架收缩反应进行调控[3]。在细胞骨架收缩反应中,ROCK引起肌球蛋白轻链(light-chain of myosin, MLC)的磷酸化,而磷酸化的MLC最终促进了肌球蛋白ATP酶的激活,从而导致细胞骨架蛋白的重组、张力纤维成型以及细胞的收缩[4]。因此,RhoA/ROCK信号通路在细胞屏障通透性的增加中起到了重要作用。另外,研究证实RhoA/ROCK信号通路在炎症反应的调节方面也有明显的效果。
1,25-二羟维生素D3[1,25-(OH)2VitD3]除了已知的调节钙和磷的代谢外,还具有免疫调节的功能。已有研究表明,1,25-二羟维生素D3在抑制中性粒细胞的浸润和炎症因子的产生方面有着显著作用[5-6]。本实验观察了1,25-二羟维生素D3对于肺组织水肿和通透性的影响,并且进一步探讨了RhoA/ROCK信号通路在海水吸入型肺损伤中的相关作用机制。在我们之前的研究中,地塞米松已经被证实对于海水吸入型肺损伤具有良好的干预效果[7-8]。因此,本课题组选择了该药物作为阳性治疗对照。
材料与方法
一、实验材料
选择健康雄性21日龄SD(Sprague-Dawley)幼鼠32只,清洁级,体质量44~61 g,第四军医大学实验动物中心提供。1,25-二羟维生素D3(HPLC≥99%)和地塞米松(HPLC≥98%)均购自Sigma公司,1,25-二羟维生素D3灌注液用10%甲醇-1‰Triton X-100溶液制成,地塞米松灌注液用5‰羧甲基纤维素钠(sodium carboxymethylcellulose)溶液制成。配方海水根据中国国家海洋局第三海洋研究所海洋生化研究室提供的我国东南沿海海水的主要成分配制:NaCl 26.518 g/L,MgSO43.305 g/L,MgCl22.447 g/L,CaCl21.141 g/L,NaHCO30.202 g/L,KCl 0.725 g/L,NaBr 0.083 g/L;pH 8.2,相对密度1.05,渗透压1 300 mmol/L。炎症因子 ELISA试剂盒购于R&D公司。β-actin、RhoA、MYPT-1和磷酸化MYPT-1(p-MYPT1)抗体均购于Santa Cruz公司。
二、实验动物分组
用完全随机方法将实验幼鼠共32只分为四组,每组8只:A:空白对照组,B:海水处理组,C:VitD3处理组,D:地塞米松处理组。各组幼鼠分别在海水滴入前1h灌胃处理:A和B组:生理盐水;C组:25 μg/kgVitD3;D组:10 mg/kg地塞米松。幼鼠海水肺损伤模型的制备:幼鼠通过腹腔注射3%戊巴比妥钠(1.5 ml/kg)进行麻醉,仰卧固定,气管切开插入气管导管后维持自主呼吸,后取1 ml的注射器插入气管,在4 min之内缓慢注入3 ml/kg海水。模型制备完成后,放血处死并切取肺组织。
三、检测指标及方法
1. 肺组织湿干重比值(W/D ratio)测定:取每只幼鼠右肺上叶,滤纸吸去表面水分和血迹,电子天平称湿重,后置于55 ℃烘干箱中72 h至恒重,称量干重,分别以湿重除以干重即为湿干比。
2. 伊文思蓝法检测肺组织通透性:在各组幼鼠处死前,将伊文思蓝(20 mg/kg体重)静脉注射到幼鼠体内,迅速取出幼鼠肺组织并用生理盐水注射入右心室,冲洗肺组织,直到左心房流出液为无色透明为止。之后,将肺组织在60 ℃下干燥72 h,干肺称重后被放入60 ℃甲酰胺中(3 ml/100 mg),上清液以离心半径8 cm,1 200 r/min离心30 min,在620 nm检测光密度值,通过比对伊文思蓝标准曲线得出各样本中伊文思蓝浓度(μg/g组织)。
3. TNF-α和IL-1β检测:用ELISA试剂盒检测肺组织TNF-α和IL-1β的含量,上述测量过程严格按照试剂盒相关说明要求操作。
4. Western-blot检测RhoA、GTP-RhoA、MYPT-1和p-MYPT1蛋白表达:幼鼠肺组织用裂解液处理,裂解产物离心(以离心半径8 cm,1 200 r/min离心30 min,4 ℃),收集上清。将等量的不同蛋白进行SDS-PAGE电泳,之后在100 V电压低温下转移至醋酸纤维素膜上,用5%的脱脂牛奶封闭2 h。加入1︰1 000稀释的一抗,4 ℃孵育过夜,反复洗脱后,加入1︰5 000稀释的羊抗兔二抗,37 ℃温育1 h,用ECL系统显色,避光保存并照相,做灰度扫描处理,结果用目的蛋白与β-actin的相对比值表示。RhoA活性检测采用Rho pull-down (Upstate Biotechnology公司)分析法检测,具体步骤严格按照试剂盒说明进行。
五、统计学方法
结果
一、肺组织湿干比值(W/D ratio)和肺组织通透性结果
各组幼鼠气管内滴入海水4 h后,肺组织湿干比和伊文思蓝通透性明显增加(P<0.001),VitD3和地塞米松能够明显降低肺组织湿干比和通透性,但VitD3与地塞米松治疗效果无显著差异,见图1。

图1各组幼鼠肺组织湿干比值(W/D)和肺组织通透性结果,A:空白对照组,B:海水4 h组,C:VitD3处理组,D:地塞米松处理组n=8;***P<0.001vs. 空白对照组;###P<0.001,##P<0.01vs. 海水4 h组
二、炎症因子检测结果
海水处理4 h后幼鼠肺组织匀浆中TNF-α和IL-1β的含量显著增加(P<0.001),VitD3和地塞米松明显抑制了炎症因子的表达(P<0.05),VitD3与地塞米松治疗效果无显著差异,见图2。
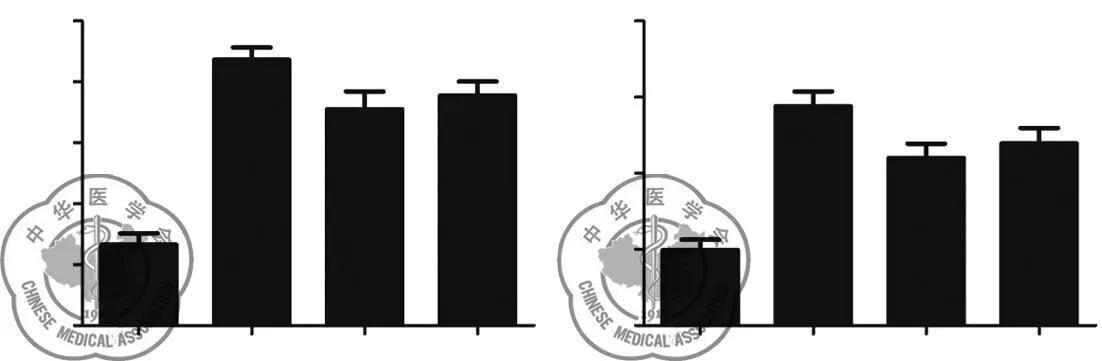
图2各组幼鼠肺组织炎症因子检测结果,A:空白对照组,B:海水4 h组,C:VitD3处理组,D:地塞米松处理组n=8;***P<0.001vs. 空白对照组;##P<0.01,#P<0.05vs. 海水4 h组
三、RhoA活性检测结果
海水处理4 h后幼鼠肺组织中GTP-RhoA表达显著增加(P<0.001),VitD3和地塞米松能够明显抑制RhoA的激活(P<0.05),但VitD3效果好于地塞米松(P<0.05),见图3。
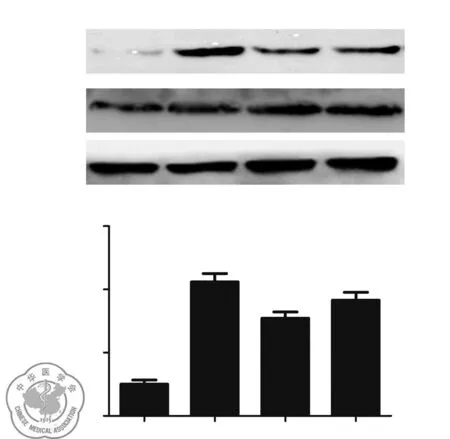
图3各组幼鼠肺组织活性RhoA检测结果,A:空白对照组,B:海水4 h组,C:VitD3处理组,D:地塞米松处理组n=8;***P<0.001vs. 空白对照组;###P<0.001,#P<0.05vs. 海水4 h组;○P<0.05vs. 地塞米松处理
四、MYPT-1磷酸化检测结果
MYPT-1(myosin phosphatase target subunit 1)作为肌球蛋白轻链磷酸酶调节亚单位,是RhoA信号通路的下游效应分子。海水处理4 h后幼鼠肺组织中p-MYPT1表达明显增加(P<0.001),VitD3和地塞米松能够显著抑制MYPT-1的激活(P<0.05),但VitD3效果好于地塞米松(P<0.05),见图4。

图4各组幼鼠肺组织磷酸化MYPT-1检测结果,A:空白对照组,B:海水4 h组,C:VitD3处理组,D:地塞米松处理组n=8;***P<0.001vs. 空白对照组;###P<0.001vs. 海水4 h组;○P<0.05vs. 地塞米松处理组
讨论
小儿海水淹溺后会发生一系列的病理变化,其中最主要的是炎症反应和肺组织屏障通透性增加引起的肺组织水肿。高渗的海水吸入肺泡时,通过高渗效应和肺屏障通透性的破坏,会使大量液体和炎症细胞渗出,并在肺泡腔和肺间质集聚,同时这些炎症细胞分泌大量的炎症因子和活性氧基团,进一步加重了肺损伤。这表明了肺组织屏障的破坏是海水吸入肺损伤的关键发病环节。本研究发现海水吸入后,幼鼠肺组织湿干比显著增加,肺组织屏障通透性也明显增加,同时炎症因子的表达也增高。而1,25-二羟维生素D3则减轻了肺组织的炎症和水肿反应。
目前治疗上除机械通气外,规范的药物治疗仍在进一步研究中[9]。1,25-二羟维生素发挥免疫调控的作用是通过与细胞核内维生素D受体相结合,从而进一步调控其下游基因发挥效应[10]。近期诸多研究表明,在人类白细胞、树突状细胞、以及成纤维细胞中,1,25-二羟维生素D3主要起抑制炎症反应以及调节免疫的作用[11-14]。此外,1,25-二羟维生素D3在前列腺细胞增生过程中可抑制细胞骨架的重构[15]。
RhoA分子属于小分子G蛋白家族,主要通过其下游效应分子Rho激酶ROCK发挥作用。ROCK是一种丝氨酸/苏氨酸蛋白激酶。激活状态的RhoA即GTP-RhoA与ROCK结合,进一步磷酸化其下游底物MYPT-1,从而调节细胞的多种行为,包括细胞形状改变、迁移等[3]。近年来多个研究表明,RhoA/ROCK信号通路在炎症反应的调节以及细胞骨架重构方面也有着重要作用[13]。本研究发现海水刺激可导致幼鼠肺组织中RhoA分子的激活,同时引起其下游MYPT-1分子的磷酸化。而1,25-二羟维生素D3可显著的抑制了肺组织中RhoA分子的激活,同时也抑制MYPT-1分子的磷酸化。综上,这些实验结果证明RhoA/ROCK信号通路在幼鼠海水淹溺型肺损伤的发生发展中起到了重要作用。同时也部分解释了1,25-二羟维生素D3在幼鼠海水淹溺型肺损伤中的作用机制,并且为1,25-二羟维生素D3在小儿海水淹溺型肺损伤的临床应用提供了实验依据。
参考文献
1van Beeck EF, Branche CM, Szpilman D, et al. A new definition of drowning: towards documentation and prevention of a global public health problem[J]. Bull World Health Organ, 2005, 83(11): 853-856.
2Orlowski JP, Szpilman D. Drowning. Rescue, resuscitation, and reanimation[J]. Pediatr Clin North Am, 2001, 48(3): 627-646.
3Amano M, Chihara K, Kimura K, et al. Formation of actin stress fibers and focal adhesions enhanced by Rho-kinase[J]. Science, 1997, 275(5304): 1308-1311.
4Amano M, Ito M, Kimura K, et al. Phosphorylation and activation of myosin by Rho-associated kinase (Rho-kinase)[J]. J Biol Chem, 1996, 271(34): 20246-20249.
5Takano Y, Mitsuhashi H, Ueno K. 1alpha, 25-Dihydroxyvitamin D(3) inhibits neutrophil recruitment in hamster model of acute lung injury[J]. Steroids, 2011, 76(12): 1305-1309.
6张敏龙, 王莉, 金发光. 1,25-二羟维生素D3调节NF-κB通路对减轻海水吸入型急性肺损伤的作用[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(5): 512-517.
7金发光, 郭佑民. 地塞米松调节claudin-4减轻海水淹溺性肺水肿的机制研究[J/CD]. 中华肺部疾病杂志:电子版, 2013, 6(2): 124-129.
8王莉, 张敏龙, 金发光. 地塞米松通过加强自噬和抑制凋亡减轻海水吸入型肺损伤[J/CD]. 中华肺部疾病杂志:电子版, 2014, 7(6): 627-631.
9Sprung CL, Annane D, Keh D, et al. Hydrocortisone therapy for patients with septic shock[J]. N Engl J Med, 2008, 358(2): 111-124.
10Lips P. Vitamin D physiology[J]. Prog Biophys Mol Biol, 2006, 92(1): 4-8.
11Rostkowska-Nadolska B, Sliupkas-Dyrda E, Potyka J, et al. Vitamin D derivatives: calcitriol and tacalcitol inhibits interleukin-6 and interleukin-8 expression in human nasal polyp fibroblast cultures[J]. Adv Med Sci, 2010, 55(1): 86-92.
12Fukuoka M, Ogino Y, Sato H, et al. Regulation of RANTES and IL-8 production in normal human dermal fibroblasts by active vitamin D3 (tacalcitol)[J]. Br J Pharmacol, 1998, 124(7): 1433-1438.
13Takahashi K, Horiuchi H, Ohta T, et al. 1 alpha, 25-dihydroxyvitamin D3 suppresses interleukin-1beta-induced interleukin-8 production in human whole blood: an involvement of erythrocytes in the inhibition[J]. Immunopharmacol Immunotoxicol, 2002, 24(1): 1-15.
14Dong X, Craig T, Xing N, et al. Direct transcriptional regulation of RelB by 1alpha, 25-dihydroxyvitamin D3 and its analogs: physiologic and therapeutic implications for dendritic cell function[J]. J Biol Chem, 2003, 278(49): 49378-49385.
15Penna G, Fibbi B, Amuchastegui S, et al. The vitamin D receptor agonist elocalcitol inhibits IL-8-dependent benign prostatic hyperplasia stromal cell proliferation and inflammatory response by targeting the RhoA/Rho kinase and NF-kappaBpathways[J]. Prostate, 2009, 69(5): 480-493.
(本文编辑:张大春)
罗建峰,吴华杰,石曌玲,等. 1,25-二羟维生素D3通过抑制RhoA/ROCK通路减轻幼鼠海水淹溺型肺损伤[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(5): 565-568.
·论著·
【摘要】目的探讨1,25-二羟维生素D3对幼鼠海水吸入型肺损伤的干预作用及其机制。方法32只SD幼鼠随机分为空白对照组、海水处理组、活性VitD3处理组和地塞米松处理组,每组8只。海水处理组幼鼠给予气管内灌注3 ml/kg海水,VitD3处理组和地塞米松处理组在海水处理组的基础上分别给予25 μg/kg VitD3和10 mg/kg地塞米松灌胃处理。分别检测各组肺组织湿干比和通透性变化,ELISA法检测肺组织中炎症因子肿瘤坏死因子-α(TNF-α)和白细胞-1β(IL-1β)的表达,Western blot检测GTP-RhoA和磷酸化MYPT-1的表达变化。结果与正常对照组比较,海水气管内滴入4 h后幼鼠肺部组织出现明显炎症和水肿,炎症因子TNF-α和IL-1β的表达显著增高,RhoA的活化和MYPT-1磷酸化增加;1,25-二羟维生素D3和地塞米松干预可显著减轻海水导致的肺组织损伤,减少了TNF-α和IL-1β的释放,并且抑制了RhoA的活化和MYPT-1的磷酸化。结论RhoA/ROCK通路参与幼鼠海水吸入型肺损伤的发展,1,25-二羟维生素D3能够通过调节该信号通路减轻肺损伤。
【关键词】急性肺损伤;海水;1,25-二羟维生素D3;RhoA/ROCK;幼鼠
1,25-(OH)2VitD3alleviates seawater drowning-induced acute lung injury in young rats by inhibiting RhoA/ROCK pathwayLuoJianfeng1,WuHuajie1,ShiZhaoling1,ZhangMinlong2,JinFaguang2.1DepartmentofPaediatrics,XijingHospital,FourthMilitaryMedicalUniversity,Xi′an710032,China;2DepartmentofRespiratoryDisease,TangduHospital,FourthMilitaryMedicalUniversity,Xi′an710038,China
Correspondingauthor:JinFaguang,Email:jinfag@fmmu.edu.cn
【Abstract】ObjectiveTo observe the therapeutic effect of 1,25-(OH)2VitD3in seawater aspiration-induced acute lung injury of young rats and explore the possible mechanisms. MethodsYoung SD rats were randomly divided into 4 groups, 8 in each group: control group, seawater group, VitD3pre-treated group and dexamethasone pre-treated group. Seawater (3 ml/kg) was instilled into the airway of young rats in seawater group. Rats in VitD3group and dexamethasone group were injected with 25 μg/kg VitD3or 10 mg/kg dexamethasone followed by seawater. W/D ratio and lung tissue permeability detection was carried out after modeling. The expression of TNF-α and IL-1β were measured by ELISA and the expression of GTP-RhoA and phospho-MYPT1 were measured by Western blot. ResultsCompared with control group, lung tissue inflammation and edema were obvious and the expression of TNF-α and IL-1β were increased after 4 h seawater stimulation. The expression of GTP-RhoA and phospho-MYPT1 were up-regulated. However, administration of 1,25-(OH)2VitD3attenuated lung inflammation and edema, suppressed the release of TNF-α and IL-1β, and inhibited the expression of GTP-RhoA and phospho-MYPT1. ConclusionRhoA/ROCK pathway plays important role in the seawater aspiration-induced acute lung injury of young rats and 1,25-(OH)2VitD3attenuated lung injury by inhibiting RhoA/ROCK pathway.
【Key words】Acute lung injury;Seawater;1,25-(OH)2VitD3;RhoA/ROCK;Young rats
收稿日期:(2015-04-10)
文献标识码:中图法分类号: R563 A
通讯作者:金发光,Email: jinfag@fmmu.edu.cn
基金项目:作者单位: 710032 西安,第四军医大学西京医院儿科1;710038 西安,第四军医大学唐都医院呼吸与危重症医学科2
DOI:10.3877/cma.j.issn.1674-6902.2015.05.007
