克霉唑栓微生物限度检查方法的验证
2015-02-16张亚茹陈莉莉曹佳茜赵肖肖
张亚茹,陈莉莉,曹佳茜,赵肖肖
克霉唑栓微生物限度检查方法的验证
张亚茹,陈莉莉,曹佳茜,赵肖肖
目的 探讨克霉唑栓微生物限度方法学验证。方法采用45 ℃ 1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液制备供试液,采用薄膜过滤法。结果各菌的回收率达到70%以上。结论该方法适合不同基质的克霉唑栓微生物限度方法检查。
克霉唑;微生物限度检查;方法验证
0 引言
克霉唑为广谱抗真菌药,对多种真菌,尤其是白色念珠菌有较强的抗菌作用。其作用机制是抑制真菌细胞膜的合成,以及影响其代谢过程。而克霉唑栓由于剂型特点,及其基质的影响,更使其抑菌活性成分很难去除,回收率很难达到要求。故从供试液的制备、取样量、冲洗液的体积、滤膜的选用等方面进行了考察。以适当的方法消除制剂中抗微生物物质的活性后,才能进行其微生物限度的检查。本文对克霉唑栓微生物限度检查方法进行试验研究,以确定该药物所用微生物限度检查方法的有效可行。
1 仪器与材料
1.1 样品名称及来源 克霉唑栓(批号:131004,上海现代制药股份有限公司);克霉唑栓(批号:140401,武汉中联药业集团四药药业有限公司);克霉唑栓(批号:130403,马应龙药业集团有限公司);克霉唑栓(批号:20140402,哈尔滨欧替药业有限公司)。
1.2 实验用品
1.2.1 验证用菌种 枯草芽孢杆菌[CMCC(B)63501]、金黄色葡萄球菌[CMCC(B)26003]、大肠埃希菌[CMCC(B)44102]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]、铜绿假单胞菌[CMCC(B)10104],以上菌种均由中国药品生物制品检定所提供。
1.2.2 培养基 胆盐乳糖培养基,批号:130902;改良马丁琼脂培养基,批号:121122;营养琼脂培养基,批号:1309272;pH 7.0氯化钠-蛋白胨溶液,批号:1211262;玫瑰红钠琼脂培养基,批号:1312182;营养肉汤培养基,批号:121218;沙氏葡萄糖液体培养基,批号:1302252;沙氏葡萄糖琼脂培养基,批号:1309022;甘露醇氯化钠琼脂培养基,批号:1107112;溴化十六烷基三甲铵琼脂培养基,批号:110928。以上培养基均由北京三药科技开发公司提供。
1.2.3 仪器设备 32 ℃电热恒温培养箱:DNP-9272型,上海精宏实验设备有限公司;25 ℃霉菌培养箱:MJP-150型,上海精宏实验设备有限公司;HQM.C型立式灭菌器:山东新华医疗器械股份有限公司;电子天平:PL2002型梅特勒-托利多仪器(上海)有限公司;水浴恒温振荡器:SHA-C型,江苏省金坛市宏华仪器厂;数显恒温水浴:HH-6型,常州国华电器有限公司。
1.2.4 微孔滤膜 A.材质:尼龙,尺寸:直径50 mm,性状:亲水性,孔径:0.45 μm,厂家:杭州泰林生物技术设备有限公司。B.材质:混合纤维素酯,尺寸:直径47 mm,性状:亲水性,孔径:0.45 μm,厂家:杭州泰林生物技术设备有限公司。C.进口CAT.NO:HVWP047S6 LOT.NO:F2PA66030 QTY:150PK,10元/膜。
2 验证方法
2.1 验证依据 《中国药典》2010年版二部附录Ⅺ J微生物限度检查法[1]。
2.2 菌液制备
2.2.1 取经32 ℃培养24 h的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、铜绿假单胞菌的营养琼脂斜面培养物适量,加入到0.9%无菌氯化钠溶液中,与标准比浊液浊度相当,作为原液;取原液倍量稀释至细菌数约为50~100 cfu/mL,备用。
2.2.2 取经25 ℃培养48 h的白色念珠菌改良马丁琼脂斜面培养物适量,加入到0.9%无菌氯化钠溶液中,与标准比浊液浊度相当,作为原液;取原液倍量稀释至酵母菌数约为50~100 cfu/mL,备用。
2.2.3 取经25 ℃培养7 d的黑曲霉改良马丁琼脂斜面培养物,加5 mL含0.05%吐温80的0.9%无菌氯化钠溶液洗下霉菌孢子,取出霉菌孢子悬液倍量稀释至霉菌数约为50~100 cfu/mL,备用。
2.3 供试液制备 称取供试品10g,加45 ℃1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液100 mL,置恒温振荡器中震荡使溶解,稍放置,取清液(无渣)作为1∶10的供试液,备用。
2.4 菌落计数方法[2]
2.4.1 常规法 取1∶10供试液清液1 mL和50~100 cfu试验菌,分别注入同一平皿中,立即倾注琼脂培养基。按平皿法测定其菌落数。
2.4.2 培养基稀释法 取1∶10供试液清液1 mL分别注入10个平皿中,同时加入50~100 cfu试验菌,立即倾注琼脂培养基。按平皿法测定其菌落数。
2.4.3 薄膜过滤法 细菌计数:取1∶10供试液的清液1 mL,采用薄膜过滤法,冲洗量500 mL/膜,冲洗液为45 ℃ 1%吐温80的0.1%蛋白胨水溶液,最后一次冲洗液中加入50~100 cfu试验菌。霉菌酵母菌计数:取1∶10供试液的清液1、0.5 mL,采用薄膜过滤法,冲洗量1 000 mL/膜,冲洗液为45 ℃ 1%吐温80的0.1%蛋白胨水溶液,最后一次冲洗液中加入50~100 cfu试验菌。
2.5 回收率测定 试验组:分别按上述菌落计数方法进行试验组的菌落计数。计算供试液的平均菌落数。菌液组:测定每一株菌的试验菌数。供试液对照组:取供试液1 mL,按菌落计数方法测定供试品本底菌数。稀释剂对照组:取稀释剂1 mL和50~100 cfu试验菌,按试验组菌数测定方法测定其菌数。
2.6 控制菌检查方法的验证[3-4]
2.6.1 白色念珠菌(薄膜过滤法)试验组:取1∶10供试液的清液10、5、2 mL,采用薄膜过滤法,冲洗量1 000 mL/膜,冲洗液为45 ℃ 1%吐温80的0.1%蛋白胨水溶液,取膜放入100 mL沙氏葡萄糖液体培养基中,加入10~100 cfu试验菌,25 ℃培养48~72 h,取上述培养物,划线接种于沙氏葡萄糖琼脂培养基平板上,培养24~48 h,必要时可延长至72 h。结果:按上述方法,10、5 mL未检出试验菌,2 mL检出试验菌,故此方法供试液取样量2 mL可行。
2.6.2 金黄色葡萄球菌(薄膜过滤法)试验组:取1∶10供试液的清液10 mL,采用薄膜过滤法,冲洗量500 mL/膜,冲洗液为45 ℃ 1%吐温80的0.1%蛋白胨水溶液,取膜放入100 mL营养肉汤培养基中,再加入10~100 cfu试验菌,32 ℃培养18~24 h,必要时可延长至48 h,取上述培养物,划线接种于甘露醇氯化钠琼脂培养基平板上,培养24~72 h。结果:按上述方法,检出试验菌,方法可行。
2.6.3 铜绿假单胞菌(培养基稀释法)试验组:取1∶10供试液的清液10 mL和10~100 cfu试验菌,加入到200 mL胆盐乳糖培养基中,32 ℃培养18~24 h,取培养物,划线接种于溴化十六烷基三甲铵琼脂培养基的平板上,培养18~24 h。结果:按上述方法,检出试验菌,方法可行。
3 结果
3.1 菌落计数及回收率测定 结果表明,在三次独立的平行试验中,常规法及培养基稀释法回收率达不到要求,见表1、表2。采用薄膜过滤法,取样量1 mL时,白色念珠菌的回收率<70%,而取样量减小到0.5 mL时,白色念珠菌的回收率高于70%,见表3、表4。故细菌、霉菌、酵母菌菌落计数采用薄膜过滤法,但霉菌、酵母菌计数时、取样量减小到0.5 mL进行。

表1 常规法菌落计数及回收率测定结果(cfu)

表2 培养基稀释法菌落计数及回收率测定结果(cfu)
3.2 控制菌检查 结果表明,采用薄膜过滤法和培养基稀释法进行验证,白色念珠菌、金黄色葡萄球菌和铜绿假单胞菌阳性对照菌检出。见表5。
3.3 根据验证试验结果确定克霉唑栓微生物限度检查法
3.3.1 菌落计数 细菌计数可采用薄膜过滤法(1 mL供试液,500 mL冲洗液/膜)检验;霉菌及酵母菌计数可采用薄膜过滤法(0.5 mL供试液,1 000 mL冲洗液/膜)检验。
3.3.2 控制菌检查 白色念珠菌采用薄膜过滤法(2 mL供试液,1 000 mL冲洗液/膜);金黄色葡萄球菌采用薄膜过滤法(10 mL供试液,500 mL冲洗液/膜);铜绿假单胞菌(培养基稀释法培养基用量200 mL)检验。

表3 薄膜过滤法(取样量1 mL)菌落计数及回收率测定结果(cfu)
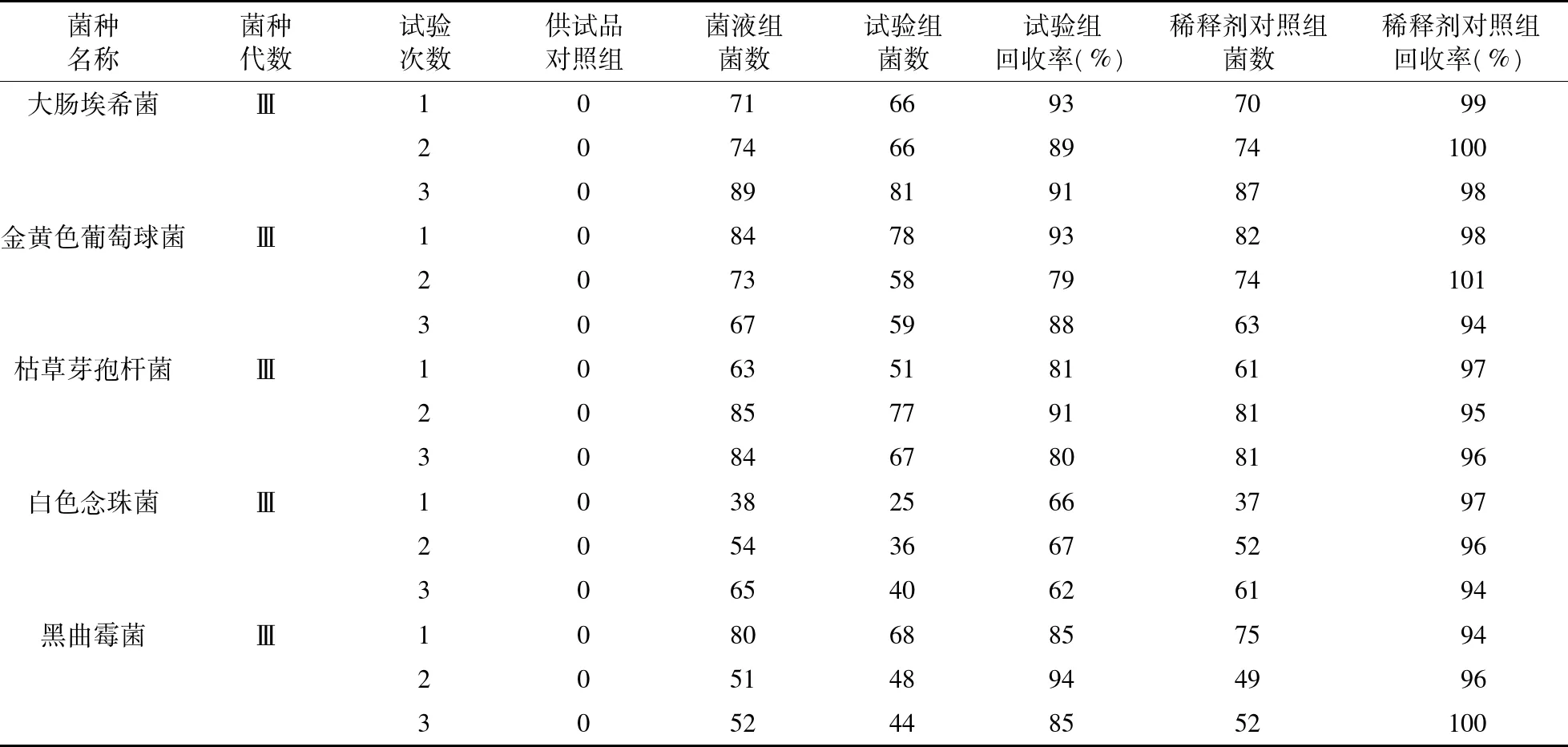
表4 薄膜过滤法(取样量0.5 mL)回收率测定结果(cfu)

表5 控制菌检查结果
4 讨论
4.1 供试液的制备 供试液制备完成后,如果取混悬状态的供试液,白色念珠菌的回收率和控制菌的检验都达不到要求;制备完成后,稍放置,取中间的清液就能达到要求。
4.2 取样量和冲洗液的量的选择 细菌计数取1 mL,冲洗量500 mL/膜回收率就能达到要求;白色念珠菌取样量0.5 mL,冲洗量1 000 mL/膜时,实验菌的回收率才能达到要求。而控制菌只有铜绿假单胞菌可以用培养基稀释法检出阳性菌,白色念珠菌和金黄色葡萄球菌用薄膜过滤法,取样量和冲洗液的量也做了考察,最后确定白色念珠菌取样量2 mL供试液,1 000 mL冲洗液/膜;金黄色葡萄球菌取样量10 mL,500 mL冲洗液/膜。
4.3 微孔滤膜的选择 滤膜的过滤速度A [1] 国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010:附录107. [2] 繆玉萍.离心沉淀-培养基稀释法检查克霉唑阴道片微生物限度(细菌)[J].心理医生(下半月版),2012,5:29-30. [3] 中国药品生物制品检定所.中国药品检验标准操作规范[S].北京:中国医药科技出版社,2010:351. [4] 周剑,王刚林.克霉唑阴道片微生物检查方法学研究[J].中国药业,2013,22(22):57-59. Verification of microbial limit examination for clotrimazole suppositories ZHANG Ya-ru,CHEN Li-li,CAO Jia-xi,ZHAO Xiao-xiao (Fuxin Institute for Food and Drug Control,Fuxin 123000,China) Objective To establish the method of microbial limit examination for clotrimazole suppositories.MethodspH 7.0 sterile buffered sodium chloride-peptone solution with 1% tween-80 at 45 ℃ was used to make test solution.Filtration membrane method was used for the examination.ResultsThe recovery rate was more than 70%.ConclusionThis method is effective and feasible,it could be applied to the microbial limit examination for various matrix of clotrimazole suppositories. Clotrimazole suppositories; Micro limit examination; Validation of the method 2014-12-02 阜新市药品检验所,辽宁 阜新123000 10.14053/j.cnki.ppcr.201505023
