中国湖南汉族人群胰岛素样生长因子-1 rs972936位点单核苷酸多态性与阿尔茨海默病的相关性分析
2015-02-16陈丽颖杜小平
陈丽颖 杜小平
1.长沙市第四医院神经内科,湖南长沙410006;2.中南大学湘雅医院神经内科,湖南长沙410008
中国湖南汉族人群胰岛素样生长因子-1 rs972936位点单核苷酸多态性与阿尔茨海默病的相关性分析
陈丽颖1杜小平2▲
1.长沙市第四医院神经内科,湖南长沙410006;2.中南大学湘雅医院神经内科,湖南长沙410008
目的研究部分汉族人群IGF-1 rs972936的单核苷酸多态性与阿尔茨海默病的相关性。方法本研究于2009年4月~2011年12月期间,筛选170例湖南汉族AD患者与147例性别、年龄匹配的健康人群,其IGF-1 rs972936位点的基因型、等位基因采用聚合酶链式反应-限制性内切酶片段长度多态性(PCR-RFLP)方法检测并分析。结果IGF-1 rs972936 GG、AG和AA在两组间的分布频率:AD组48.82%、38.23%、12.94%,对照组20.41%、40.82%、38.78%;等位基因G、A分布频率为:AD组67.94%、32.06%,对照组40.82%、59.18%,以上各频率分布差异均有统计学意义(P<0.05)。结论IGF-1 rs972936的GG基因型、G等位基因可能为湖南汉族人群AD发病的危险因素。
阿尔茨海默病;胰岛素样生长因子-1;单核苷酸多态性;基因
阿尔茨海默病(Alzheimer’s disease,AD)为中枢神经系统退行性疾病,以进行性记忆力丧失及认知功能退化为临床主要表现,多伴有精神症状和人格障碍。AD具有三大特征性病理学改变,包括神经纤维缠结、老年斑、海马锥体细胞颗粒空泡变性,一般病理改变包括脑室扩大(记忆、语言、海马区)、脑沟增宽、皮质广泛萎缩、血管淀粉样变性、星形胶质细胞反应及大量神经元细胞突触缺失[1-3]。较之于研究透彻的病理学改变,AD的病因未明、发病机制复杂,众多复杂的遗传和环境因素参与其中,近年来又以遗传易感基因异常为研究热点,其中早老素1基因、早老素2基因、淀粉样前体蛋白基因、载脂蛋白Eε4基因为已确定的4种AD易感基因。IGF-1具有强大的神经系统保护作用,通过促进细胞增殖与分化等作用,参与神经变性过程,影响AD发病机制。国外已有研究证明IGF-1 rs972936基因多态性能影响AD患者血清中的IGF-1浓度[4,5],影响疾病进程,国内尚无相关报道。本研究通过应用聚合酶链式反应-限制性内切酶片段长度多态性技术(polymerase chain reaction-restriction fragment length polymorphisms,PCR-RFLP)检测IGF-1 rs972936的单核苷酸多态性,从遗传易感基因学角度为AD提供分子遗传学诊断依据,进一步探讨IGF-1与AD病理学机制的相互关联。
1 资料与方法
1.1 临床资料
本课题所选取的研究对象选自中国湖南地区汉族人群,均签署知情同意书。研究资料收集时间段为2009~2012年。170例AD患者选自中南大学湘雅医院附属一医院、湘雅附属二医院、湖南省第二人民医院住院患者及长沙市第三福利院,其中病程≤1年7例,1年<病程<2年28例,2年≤病程<3年26例,3年≤病程<4年27例,4年≤病程<5年16例,5年≤病程<6年24例,6≤病程<10年30例,病程≥10年12例。147例正常健康人群均来自湘雅医院体检中心。两组年龄构成、性别比例均匹配。统计两组间的性别构成比、起病年龄资料,年龄比较采用t检验,性别比较采用χ2检验,差异无统计学意义(P均>0.05),具有可比性。见表1。

表1 性别及年龄在AD组、正常对照组间的匹配检测
1.2 纳入及排除标准
AD筛选标准:采用《精神障碍诊断标准和统计手册》(DSM-IV-R),美国神经病学、言语障碍、卒中研究所(NINCDS),阿尔茨海默病及相关疾病协会工作组(NINCDS-ADRDA)诊断标准。依据诊断方法和把握度分三类:明确的AD、可能性大的AD、可能的AD。对“可能的AD”需通过MMSE量表、CDR痴呆登记量表、Hanchiski缺血量表、画钟试验进一步评判。排除标准:突然发病及卒中样起病;发病或病程早期出现局灶神经功能缺损或癫痫及步态异常;早期锥体外系症状或其他内科疾病引起记忆及相关症状,包括脑血管病、严重抑郁状态、中毒和代谢异常。
正常健康对照组入组标准:①日常生活各项功能良好;②MMSE量表评分≥27分。排除标准:①存在严重躯体疾病、糖尿病、高脂血症及肿瘤的患者;②MMSE量表评分<27分。
1.3 研究方法
1.3.1 DNA提取采集静脉血4~5 mL,充分摇匀,乙二胺四乙酸(ethylene-diaminetetraacetic acid,EDTA)抗凝,采用酚、氯仿法提取DNA。
1.3.2 聚合酶链式反应(PCR)过程①引物设计与检测:目标基因的单核苷酸多态性序列应用Gene Bank检索,Primer Premer 5.0、Blast软件设计并检测引物。IGF-1 rs972936位点上游引物:5’-GTGGTATGTGTAGTTATTCTGACATCCAG-3’下游引物:5’GTGTCTGGCTGTGGCTCTTAG 3’。PCR反应体系(共10μL):10×PCR Buffer 1.0μL,dNTP 0.5μL,gDNA 0.3μL,上、下游引物各0.1 uL,加去离子水补充至10μL。②PCR扩增条件:95℃预变性5 min;95℃30 s,58℃30 s,72℃40 s,共20个循环;最后72℃延伸6min。每次提取4~7μL的PCR扩增产物,均匀点样至2.5%的琼脂糖凝胶筛孔内,设置150 V电压、0.5×TBE电泳缓冲液电泳30 min,扩增的PCR产物条带利用凝胶图像系统观察并分析、照相。
1.3.3 酶切过程IGF-1的rs972936位点的酶切反应体系:内切酶MvaI(10U/μL)0.1μL;PCR扩增产物10μL;缓冲液1.5μL;加双蒸水(ddH2O)至总体积15μL,静置于37℃恒温水浴箱并过夜。
1.3.4 电泳过程每次提取4~7μL的PCR酶切产物均匀点样至3.0%的琼脂糖凝胶筛孔内,0.5×TBE电泳缓冲液,电泳条件设定为150 V电压,时间为30 min,每个电泳条带分别对应的基因型分别呈现于凝胶成像系统,确定并拍照。
1.4 统计学方法
采用SPSS 17.0软件、Excel进行统计学分析及图表绘制。Hardy-Weinberg平衡检测法检测样本的群体代表性。性别资料用正态变量(x±s)表示,t检验用于组间计量资料的比较,χ2检验用于组建计数资料的比较。P值取双侧概率,若P<0.05为差异存在统计学意义。基因计数方法测定IGF-1 rs972936位点的基因型及等位基因频率,等位基因频率=(2×纯合子+杂合子)/(2×受检人数)。
2 结果
2.1 人群代表性检验
应用Hardy-Weinberg平衡法检测,IGF-1 rs972936基因型、等位基因在AD组的基因分布频率检测结果:χ2=2.542,P=1.111,对照组的基因分布频率检测结果:χ2=3.54,P=0.06,符合遗传平衡(P>0.05)。见表2。
2.2 IGF-1 rs972936位点的酶切产物判定
PCR-RFLP检测IGF-1 rs972936位点的PCR产物长度为193 bp。含多态性位点鸟嘌呤(G)的基因型可被限制性内切酶MvaI特异性酶解完全,产生125 bp、68 bp两个片段;含多态性位点腺嘌呤(A)的基因型则不会被酶解。最终电泳后的酶切产物有三种类型:第一型:IGF-1 rs972936位点为AA基因型,仅显示193 bp一条条带,产物完全未被酶切;第二型:IGF-1 rs972936位点为GG基因型,显示125 bp、68 bp两条条带,产物被完全酶切;第三型:IGF-1 rs972936位点为AG基因型,显示193 bp、125 bp、68 bp三条条带,产物被部分酶切。见图1。

图1 IGF-I rs972936位点的PCR酶切产物电泳图
2.3 IGF-1 rs972936位点的基因型和等位基因分布频率
GG、AG和AA三种基因型在AD组和对照组总体分布频率存在统计学意义(χ2=39.102,P=0.000<0.05),G、A等位基因在两组间的总体分布频率亦存在统计学意义(χ2=46.491,P=0.000<0.05)。见表2。AD组与对照组相比:GG基因型、G等位基因分布频率显著增高,AA基因型、A等位基因分布频率显著降低,见封三图1。
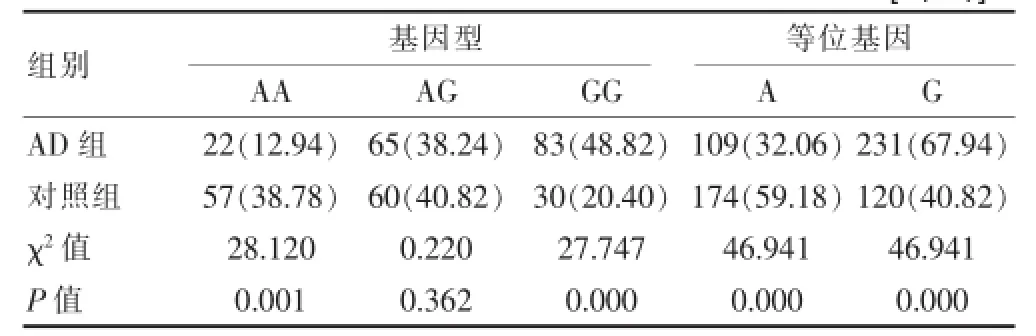
表2 IGF-1 rs972936位点的基因型和等位基因频率分布[n(%)]
3 讨论
人类胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)又称生长介素,为一单链碱性多肽,基因编码产物为IGF-I。IGF-I基因位于第12号染色体,全长90 kb,含有6个外显子、6个内含子[6]。IGF-1信号肽氨基端序列和羧基端分别由外显子1、外显子3的5’端编码;外显子3的剩余部分及外显子4编码成熟的IGF-1肽链段,而翻译终止码包含在外显子5、6内[7]。
IGF-1具有广泛的中枢神经系统保护作用并维持大脑内环境稳定[8-10],它能阻止神经细胞凋亡[11,12]、促进神经元血管再生及重塑、减少缺血缺氧对神经元的损害、促进神经髓鞘合成及存活[13]。国外大量研究表明,IGF-1能干预AD病情进展,维持认知功能[14]。AD的特征性病理改变包括Aβ蛋白沉积及磷酸化tau蛋白形成,IGF-1可通过胰岛素降解酶(IDE)的竞争性抑制作用间接或直接调节大脑中Aβ蛋白的水平,从而对抗Aβ蛋白毒性[15]。IGF-1/胰岛素信号通路可负反馈调节糖原合成激酶-3β(GSK-3β)/磷脂酰肌醇-3激酶(PI3K)-p70 S6K通路,减少tau蛋白磷酸化、增加其与微管结合[16]。Schubert和Carro等在动物实验中证实[17,18],损坏老鼠大脑中该信号通路可致过度磷酸化tau(Hpf-tau)蛋白形成,伴随认知功能障碍。此外,IGF-1对AD的影响还包括能提高海马的神经发生和神经元兴奋性、维持突触可塑性[19]、保护中枢胆碱能系统[20,21],因此,中枢神经系统中IGF-1浓度下降或基因功能异常与AD发病、病情严重程度密切相关。
本研究显示,IGF-1 rs972936的AA、AG、GG三种基因型在AD组及对照组的频率分布显示:12.94%、38.23%、48.82%;38.78%、40.82%、20.41%。A、G等位基因在AD组、对照组的频率分布显示:32.06%,67.94%;59.18%,40.82%,χ2检验显示基因型、等位基因在两组间的分布均存在统计学意义,AD组与对照组相比,GG基因型、G等位基因分布频率显著增高,AA基因型、A等位基因分步频率则显著低于对照组。进一步推论,GG基因型、G等位基因为致AD发病的危险因素,即携带GG基因型、G等位基因人群的AD患病风险显著增高;而携带AA基因型和A等位基因人群的AD患病风险则显著降低,为AD发病的保护因素。
基因多态性产生的原因为单核苷酸变异,其本质是DNA核苷酸排列顺序的差异。基因突变发生于外显子、启动子、编码区内,则可转录产生错误的mRNA片段、或影响转录速度,改变蛋白质活性或合成没有活性的蛋白质。基因非编码区的突变对基因功能无明显改变。
IGF-1 rs972936位点位于基因内含子区域,主要调节基因剪接点部位的活性。Teo Vargas[22]等证实了IGF-1 rs972936基因多态性与外周血循环中的IGF-1浓度相关,AD组高于正常对照组,其中携带GG基因型及G等位基因AD患者血清的IGF-1浓度高于AG、AA基因型及携带A等位基因的患者([GG](143.9± 8.6)ng/m L vs[GA](115.2±9.2)ng/m L P=0.027,[AA](95.8± 14.6)ng/mL,P=0.015)。随年龄增长,血脑屏障及IGF-1信号通路功能下降[23,24],大脑血管、脉络丛的功能受到干扰,致IGF-1敏感性降低[25],表现为外周循环的IGF-1浓度代偿性增高而中枢浓度下降(即IGF-1抵抗),最终导致大脑中Aβ蛋白清除减少、过度磷酸化tau蛋白形成,最终诱发AD。因此,推测IGF-1 rs972936位点的基因多态性可能通过以下途径影响AD的发病:GG基因型、G等位基因能干扰正常基因功能,并通过改变基因剪接位点的活性,致IGF-1信号通路受损,从而产生IGF-1抵抗、IGF-1敏感性降低,导致中枢IGF-1浓度下降而外周循环代偿性增高;信号通路受损后,GSK-3β通路所受的负反馈抑制作用降低,磷酸化tau蛋白增多,中枢的Aβ蛋白清除减少、沉积增多,诱发AD。除此之外,外周循环中的IGF-1透过血脑屏障需借助于IGF载体蛋白(IGFBPS),并同时结合IGF-1R才能作用于中枢神经系统,因而不能排除IGF-1 rs972936位点多态性对IGFBPS、IGF-1R产生的干扰作用,阻碍IGF-1透过血脑屏障,致使其中枢神经系统浓度降低。本实验由于条件限制,未能进一步测定AD患者和正常对照组外周循环中的IGF-1浓度,因此,以上作用机制的推论仅为猜测,关于IGF-1 rs972936位点的单核苷酸多态性究竟如何改变AD的易感性,仍有待深入研究与探讨。
[1]雷春涛,樊映川,张学东.IGF-1系统与糖尿病视网膜病变的研究进展[J].重庆医学,2007,8(36):1554-1556.
[2]Rotwein P,Burgess SK,Milbrandt JD,et al.Differential expression of insulin-like growth factor genes in rat centralnervous system[J].Proc Natl Acad Sci,1988,85(1):265-269.
[3]Duan C,Xu Q.Roles of insulin-like growth factor(IGF)binding proteins in regulating IGF actions[J].Gen Comp Endocrinol,2005,142(1-2):44-52.
[4]Vardy ER,Rice PJ,Bowie PC,et al.Increased circulating insulin-like growth factor-I in late-onset Alzheimer's disease[J].Alzheimers Dis,2007,12(4):285-290.
[5]Salehi Z,Mashayekhi F,Naji M.Insulin like growth factor-1 and insulin like growth factor binding proteins in the cerebrospinal fluid and serum from patients with Alzheimer’s disease[J].Biofactors,2008,33(2):99-106.
[6]Butterfield DA,Reed T,Newman SF,et al.Roles of amyloidβpeptide associated oxidative stress and brain proteinmodifications in the pathogenesis of Alzheimer’s,ease and mild cognitive impairment[J].Free Radic BiolMed,2007,43(5):658-677.
[7]Shi L,Linville MC,Tucker EW,et al.Differential effects of aging and insulin-like growth factor-1 on synapses in CA1 of rat hippocampus[J].Cereb Cortex,2005,15(5):571-577.
[8]Torres-Aleman I.Toward a comprehensive neurobiology of IGF-I[J].Dev Neurobiol,2010,70(5):384-396.
[9]Zhao X,Liu SJ,Zhang J,et al.Combining insulin-like growth factor derivatives plus caffeinol produces robust neuroprotection after stroke in rats[J].Stroke,2005,36(1):129-134.
[10]Calikoglu A,Karayal A,D’Ercola A.Nutritional regulation of IGF-I expression during brain development in mice[J].Pediatr Res,2001,49(2):197-202.
[11]Sell C,Baserga R,Rubin R.Insulin-like growth factor I IGF-Iand the IGF-I receptor prevent etoposide-induced apoptosis[J].Cancer Res,1995,55(2):303-306.
[12]Singleton JR,Randolph AE,Feldman EL.Insulin-like growth factor I receptor prevents apoptosis and enhances neuroblastoma tumorigenesis[J].Cancer Res,1996,(56):4522-4529.
[13]Carro E,Trejo JL,Busiguina S,et al.Circulating insulinlike growth factor-I mediates the protective effects of physicalexercise againstbrain insultsof differentetiology and anatomy[J].JNeurosci,2001,21(5):5678-5684.
[14]Van Dam PS,Aleman A.Insulin-like growth factor-I,cognition and brain aging[J].Eur JPharmacol,2004,490(1-3):87-95.
[15]Reinhardt RR,Bondy CA.Insulin-like growth factors cross the blood-brain barrier[J].Endocrinology,1994,135(5):1753-1761.
[16]Hong M,Lee VM.Insulin and insulin-like growth factor-1 regulate tau phosphorylation in cultured human neurons[J].Biol Chem,2007,272(31):19547-19553.
[17]Schubert M,Brazil DP,Burks DJ,et al.Insulin receptor substrate-2 deficiency impairs brain growth and promotes tau phosphorylation[J].JNeurosci,2003,23(18):7084-7092.
[18]Carro E,Trejo JL,Gerber A,et al.Therapeutic actions of insulin-like growth factor I on APP/PS2 mice with severe brain amyloidosis[J].Neurobiol Aging,2006,27(9):1250-1257.
[19]Nu觡ez A,Carro E,Torres-Aleman I.Insulin-like growth factor I modifies electrophysiological properties of rat brain stem neurons[J].JNeurophysiol,2003,89(6):3008-3017.
[20]Aberg MA,Aberg ND,Hedb覿cker H,et al.Peripheral infusion of IGF-I selectively induces neurogenesis in the adult rat hippocampus[J].JNeurosci,2000,20(8):2896-2903.
[21]Trejo JL,Carro E,Torres-Aleman I.Circulating insulinlike growth factor Imediates exercise-induced increases in the number ofnew neurons in the adulthippocampus[J]. JNeurosci,2001,21(5):1628-1634.
[22]Vargas T,Martinez-Garcia A,Antequera D,et al.IGF-I gene variability is associated with an increased risk for AD[J].Neurobiol aging,2011,32(3):3-11.
[23]Ridley AJ,Schwartz MA,Burridge K,et al.Cell migration:inte-grating signals from front to back[J].Science,2003,302(5651):1704-1709.
[24]Strazielle N,Ghersi-Egea JF.Choroid plexus in the centralnervoussystem:biologyand physiopathology[J].JNeuropathol Exp Neurol,2000,59(7):561-574.
[25]Tham A,Nordberg A,Grissom FE,et al.Insulin-like growth factors and insulin-like growth factor binding proteins in cerebrospinal fluid and serum of patients with dementia of the Alzheimer type[J].JNeural Transm Park Dis Dement Sect,1993,5(3):165-176.
Correlation analysis on insulin-like grow th factor-1 rs972936 single nueleotide polymorphism among Chinese Han population in Hu’nan w ith Alzheimer's disease
CHEN Liying1DU Xiaoping2
1.Department of Neurology,Changsha Fourth Hospital,Changsha 410006,China;2.Department of Neurology,Central South University Xiangya Hospital,Changsha 410008,China
ObjectiveTo investigate the relation between IGF-1 rs972936 single nueleotide polymorphism in some Chinese Han population and Alzheimer's disease.M ethods170 AD patients of Chinese Han population in Hunan and 147 healthy volunteerswith matched genders and ageswere sleeved during April 2009 and December 2011.The genotype and allele of IGF-1 rs972936 were detected and analyzed by PCR-RFLP.ResultsThe distribution frequencies of IGF-1 rs972936 GG,AG,and AA were 48.82%,38.23%,and 12.94%in the AD group,and 20.41%,40.82%,and 38.78%in the control group.The distribution frequencies of alleles G and A were 67.94%and 32.06%in the AD group,and 40.82%and 59.18%in the control group.The above differences in distribution frequencieswere all statistically significant(P<0.05).ConclusionGenotype of GG and allele G of IGF-1 rs972936 are probably risk factors of AD in Chinese Han population in Hunan.
Alzheimer's disease;Insulin-like growth factor-1;Single nueleotide polymorphism;Gene
R346
A
1673-9701(2015)36-0017-04
2015-10-15)
▲通讯作者
