轻度认知障碍及阿尔茨海默病3.0T磁共振波谱成像对照研究
2015-02-16徐运强张江涛
徐运强 张江涛
1.浙江省象山县第三人民医院精神科,浙江象山315711;2.浙江省立同德医院老年科,浙江杭州310012
轻度认知障碍及阿尔茨海默病3.0T磁共振波谱成像对照研究
徐运强1张江涛2
1.浙江省象山县第三人民医院精神科,浙江象山315711;2.浙江省立同德医院老年科,浙江杭州310012
目的研究轻度认知障碍(MCI)和阿尔茨海默病(AD)前额叶、海马和扣带回后部磁共振波谱变化。方法选取2013年9月~2015年6月临床确诊MCI、AD和健康对照组(NG)各30例,均行头颅常规前额叶、海马、后扣带回的单体素磁共振波谱检测,应用SPSS12.0软件对MCI组、AD组与对照组进行统计学分析。结果在前额叶、海马区和后扣带回NG组、MCI组和AD组三组相比NAA/m I逐渐降低,差异有统计学意义(P<0.05)。前额叶、海马区和后扣带回在NG组、MCI组和AD组三组相比,m I/Cr均渐进升高,差异有统计学意义(P<0.05);AD组与NG组的NAA/m I差值海马部显著大于扣带回后部和前额叶;MCI组与NG组的NAA/m I差值海马部显著小于扣带回后部和前额叶。结论磁共振波谱对MCI和AD患者进行前额叶、海马及扣带回后部NAA/m I和m I/Cr的随访监测,对了解病情变化有着良好的客观价值。
磁共振波谱成像;轻度认知功能障碍;阿尔茨海默病;边缘系统
轻度认知功能障碍(mild cognitive function impairment,MCI)是老年痴呆患者轻微认知功能损害的一种进行性发展的状态,据统计每年平均有10%~15%的MCI发展为阿尔茨海默病(Alzheimer'sDisease,AD)[1,2]。AD属于慢性神经系统变性疾病,主要症状往往也表现为进行性痴呆[3]。大量文献报道,MCI最终演变成AD是不争的事实,因此MCI往往被认为是AD前驱症状,即MCI是AD的高危人群[4]。如何进一步的早期诊断MCI并无创的监测MCI与AD的大脑的病理生理指标,尽早采取干预措施将有助于阻止或减缓MCI发展为AD,这无疑已经成为临床医师所迫切要求的目标之一[5,6]。氢质子磁共振波谱(1H-magnetic resonance spectroscopy,1H-MRS)作为一种无创性的活体大脑生化及代谢指标变化的检测方法,可了解脑内病理生理变化,从而为MCI及AD的早期诊断和病程检测带来了希望[7]。本研究选取对正常对照组、MCI组和AD组,对与认知、记忆相关的脑区(包括前额叶、海马和扣带回后部),进行1H-MRS检测,旨在评价MRS对于MCI和AD诊断的价值和意义。
1 资料与方法
1.1 临床资料
选取2013年9月~2015年6月来自我院与合作医院浙江省立同德医院老年科就诊的MCI和AD患者各30例(定义为MCI组和AD组),同时选取按年龄和性别匹配的正常对照组(normalgroup,NG组)30例。MCI组的诊断标准,按照Petersen 1999年提出的诊断标准[8]:①有亲属或(和)知情者证实的,并由患者自述的记忆功能进行性衰退;②简易智能状态检查表(mini-mental state examination,MMSE)24~28分,临床痴呆量表(clinical dementia rating,CDR)≤0.5分);③日常生活能力正常(activities of daily living,ADL)≤16分;④排除其他因素所致的记忆损害Hachiski指数≤4分,汉密顿抑郁量表(Hamilton depression scale,HAMD)≤20分。AD组30例,临床诊断符合美国国立神经病学传染病及卒中研究所与阿尔茨海默病和相关病协会(NINCDS-ADRDA)的诊断标准(1994年)[9]。①简易智能状态量表(MMSE)评分<24分;临床痴呆评定量表(CDR)评分≥1.0分;②日常生活能力正常ADL≤16~100分之间;③排除其他因素所致的记忆损害Haehiski指数≤4分和汉密顿抑郁量表(HAMD)≤20分。NG组均为健康老年志愿者:①无认知功能障碍;②日常生活能力正常ADL≤16分;③MMSE评分为28~30分,CDR评分为0;④无痴呆家族史。NG组30例,来自健康自愿者以及因头晕、头痛等症而就诊的一般患者。常规头颅M RI扫描颅内未见明显脑梗死灶及脑室周围白质变性等。临床检查均不符合MCI及AD。MCI组30例,男18例,女12例,年龄58~81岁,均(68.2±5.4)岁,平均受教育(5.4±1.0)年。AD组30例,男17例,女13例,年龄56~82岁,平均(69.1±4.8)岁,平均受教育(6.2±1.1)年;NG组30例,男19例,女1例,年龄55~83岁,平均(67.2±4.8)岁,平均受教育(5.7±1.2)年。各组间性别、年龄及受教育程度无统计学差异(P>0.05)。检查前均签署知情同意书,并经浙江省立同德医院伦理委员会通过。
1.2 方法
全部病例应用Siemens Trio Tim 3.0T磁共振8通道相控阵颅脑线圈扫描,以海绵垫固定受试者头部。进行常规颅脑MRI横断扫描包括横断面T1加权像(T1WI)、T2加权像(T2WI)、弥散加权像(DWI)、快速自旋回波水抑制序列(Flair序列)排除颅内器质性病变。之后行横断、矢状、冠状位3D-T1WI覆盖全脑的结构像扫描,三平面采集结束后将感兴趣区(VOI)定位在前额叶、海马及后扣带回的皮质区。然后采用点波谱分辨技术(point resolved selective spectroscopy,PRESS),单体素波谱(single voxel spectroscopy,SVSSE-30)序列,进行后前额叶、海马和扣带回后部波谱采集。扫描参数:TR1850ms,TE2.0ms,视野240mm× 240mm,反转角90°,层厚1mm,层间距0,矩阵1024× 1024,体素大小1mm×1mm×1mm水激发BW35MHz,采集BW 1000MHz。感兴趣区外的预饱和和人工手动匀场结束后,在水脂抑制的情况下进行波谱采集,然后在偏转角90°的无水抑制再行扫描。扫描中注意每个谱线与无水抑制扫描谱线进行有效的结合尽量消除涡流的影响,最后对谱线基线校正及相位调节,测量出各代谢产物波峰的峰高波谱,总采集时间范围在8~10min。
1.3 数据后处理
利用SiemensTrio Tim 3.0TMRI机器自带Syngo波谱分析软件[10]。各代谢物的化学频移位置为:肌酸(cre atine,Cr)3.02 ppm、N-乙酰天门冬氨酸(N-acetylaspartate,NAA)2.02 ppm、肌醇(myo-inositol,m I)3.56 ppm,胆碱(choline,Cho)3.22 ppm。以Cr为内参照计算各代谢物的相对浓度。Syngo波谱软件可以自动完成曲线的调整[11]。
1.4 统计学分析
运用SPSS12.0统计学软件包进行处理,对照MCI,AD,NG三组数据前额叶、海马、后扣带回的波谱差异,首先每组数据进行正态分布检验,在几组间进行单因素方差分析后进行Newman-Kuels多重比较检验。计量资料以均数±标准差(x±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 三组受试者前额叶质子波谱情况比较
与NG组前额叶质子波谱相比,AD组和MCI组的NAA/m I比值减小(P<0.05),AD组和MCI组之间比较NAA/m I比值亦减小(P<0.05)。在NG、MCI和AD三组中随病情进展,比值呈逐渐减小趋势;NAA/Cr、m I/Cr和Cho/Cr的变化三组间均未见显著差异,见表1。
2.2 三组受试者海马区质子波谱情况比较
AD组、MCI组与NG组海马区质子波谱相比NAA/ m I、NAA/Cr比值逐渐减小(P<0.05),AD组和MCI组之间比较NAA/m I、NAA/Cr比值亦减小(P<0.05)。在NG、MCI和AD三组中随病情进展,比值呈逐渐减小趋势;而三组m I/Cr比值有逐渐上升的趋势,差异有统计学意义(P<0.05)。而Cho/Cr比值三组差异无统计学意义(P>0.05),见表2。
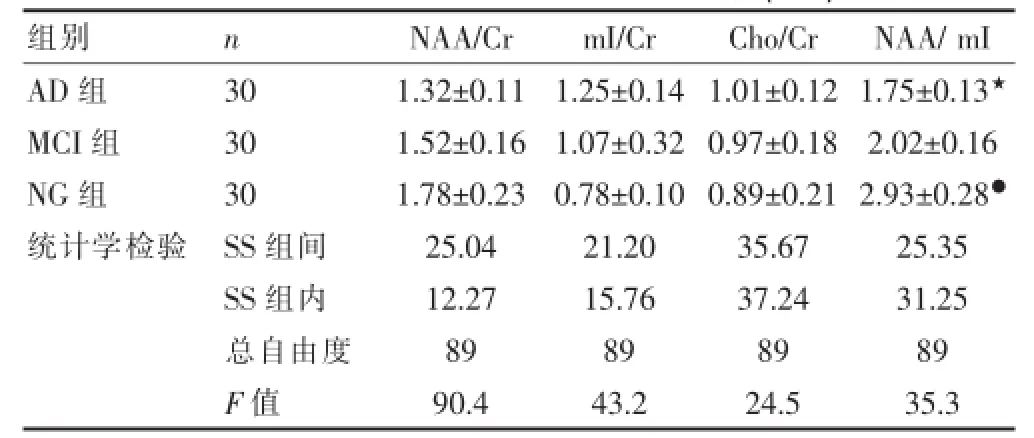
表1 三组受试者前额叶质子波谱比较(x±s)
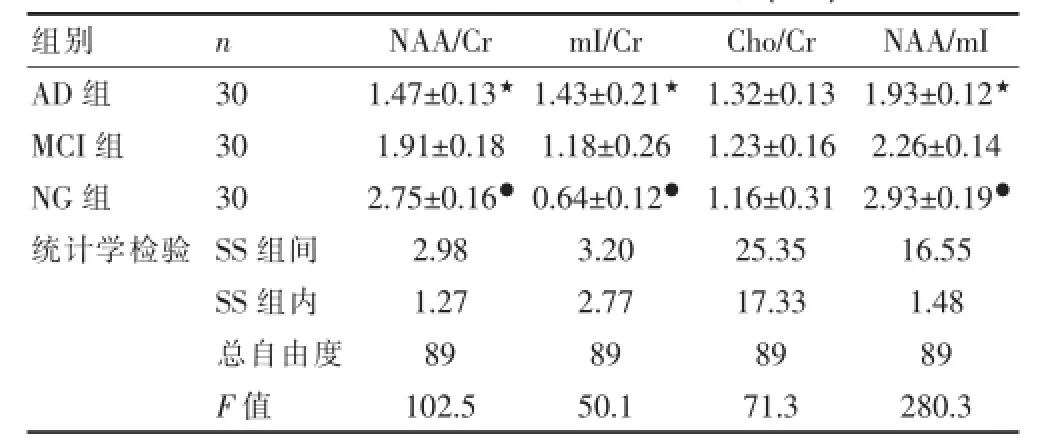
表2 三组受试者海马区质子波谱比较(x±s)
2.3 三组受试者后扣带回质子波谱情况比较
AD组、MCI组与NG组后扣带回质子波谱相比NAA/m I、NAA/Cr比值逐渐减小(P<0.05),AD组和MCI组之间比较NAA/m I、NAA/Cr比值亦减小(P<0.05)。在NG、MCI和AD三组中随病情进展,比值像海马区一样呈逐渐减小趋势;而三组m I/Cr比值有逐渐上升的趋势,差异有统计学意义(P<0.05)。而Cho/Cr比较MCI和AD组较NG组有统计学差异(P<0.05),MCI和AD组间差异无统计学意义(P>0.05),见表3。
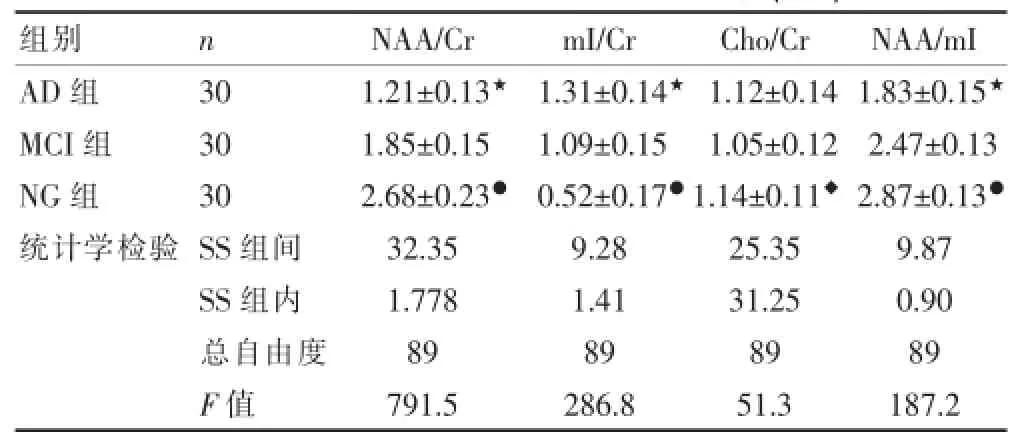
表3 三组受试者后扣带回质子波谱比较(x±s)
3 讨论
MCI是Petesen等人在1999年提出,临床表现缺乏特异性,导致定义和诊断标准并不统一,使得及时发现MCI也成为临床诊断的困境[12]。轻度认知障碍的核心临床表现为认知功能的渐进性的减退,根据大脑发病的部位主要涉及高级语言功能、注意力、视觉空间结构力等能力障碍[13]。临床上常用的神经心理学测验成为MCI的主要筛查手段,如ADL、HAMD、CDR、MMSE量表,目前还没有明确的病理支持MCI[14]。神经心理检测虽然简单便捷,但因受试者主观及客观多种因素影响,仍缺乏客观性。因此对待MCI的客观诊断标准的提出已经成为临床亟待解决的问题之一[15]。以往的研究证实分别利用MRS测量前额叶、后扣带回、海马等边缘系统的化学成分的特征来判断MCI的病情变化。更深入的研究表明MCI患者的纵向认知能力下降者可通过测量代谢产物NAA/Cr的比值降低来预测[16]。但是联合的应用前额叶、后扣带回、海马三者的浓度测量以及与AD的对比研究报道较少[17]。而每年平均有10%~15%的MCI发展为AD,对我们早期做出临床判断,阻止病情进展是亟需解决的问题。
AD是一种神经退行性疾病,主要的临床表现为渐进性遗忘。病理主要表现为老年斑的形成和神经纤维缠结,累及小动脉血管致使其淀粉样变性,从而导致神经元细胞的变性,坏死,存在于神经元的化学物质NAA含量降低。MRS能够较敏感探知脑内这些化学微量元素的相对变化,AD的这些病理改变成为MRS诊断的基础[18]。
磁共振单体素1H-MRS不能直接测得脑内代谢物NAA、Cho及Cr和MI等微量元素的含量的具体数值的大小,但是它能测得三者的相对比值浓度,从而间接反应各中物质在颅脑内的变化情况。反映神经元和轴突活性的特异性指标NAA成为MRS测定主要物质,往往反映病变的特异性最强的指标。Cho主要存在细胞膜上,在细胞膜的损伤时Cho释放,导致其波谱比值的增高。作为体内相对稳定的Cr,常常在波谱测定中当作分数的分母来评价其他各代谢物的变化。神经胶质细胞中特有的成分MI,成为神经细胞损伤再修复的特异性标志,所以被认为是反映细胞毒性水肿神经胶质增生。计算分析NAA/Cr、m I/Cr、NAA/m I和Cho/Cr之间的相对比值,进行颅脑内分子水平的代谢研究成为磁共振波谱分析的重点[19]。
前额叶和边缘系统的海马、后扣带回对人的思维活动与行为表现有着重要的作用,以上均和智力密切相关的重要脑区,成为AD研究的热点区域[20]。AD和MCI患者往往局限在海马区,有研究证实海马区形态学改变晚于生化代谢改变,因此大部分研究都对海马进行了深入的解读。学习、记忆在后扣带回皮质区具有重要作用,有研究证实后扣带回的生化水平变化最早,所以近几年来成为研究的热点[21]。
本研究发现前额叶、海马、后扣带回的MCI组、AD组NAA/m I与NG组比较,均递减趋势,存在显著统计学差异,说明MCI发展至AD的细胞膜逐渐得到一定的损害;MCI和AD组患者的m I/Cr比值增高,与对照组存在显著统计学差异,表明三区的神经胶质细胞增生活跃,神经元的破坏,神经胶质的增生是互相因果的,这往往是病情进展的标志,这两点与以往的报道基本一致。以往的研究中MCI和AD患者的PCC区域的Cho/Cr变化尚存在较大争议。Cho/Cr比值的高低各项报道不一,但MCI组和AD组的比值降低仍占主流[22]。本研究显示,与正常对照组相比,MCI组和AD组Cho/Cr比值升高,差异有统计学意义,但是由于资料数量有限,仍不能得出较为确切的结论。
总之,具有非创性,客观性诊断价值的MRS来说,对MCI和AD提供有效的方法。NAA的渐进性降低,m I的逐步升高,导致两者比值的降低,预示着神经元细胞的退行性改变的加速。研究发现对于通过不同脑区的NAA/m I测定更能反映MCI进展到AD的病理变化程度。Petersen提出的诊断标准目前在诊断MCI的金标准中我们不禁有些怀疑,因为主观因素是随着时间和场所的改变会得到不同的评分的,这也毋庸置疑缺乏客观的指标。本研究对三组的三个敏感部位的测量进一步证明MCI患者额叶、海马区及扣带回后部NAA/m I较NG组显著下降,而且三组呈渐渐下降趋势,充分证明了已经能用1H-MRS可以检测到MCI患者的神经细胞的代谢变化。磁共振的波谱分析能够以非创性特性对MCI患者定期进行前额叶,海马及扣带回后部NAA/m I的随访监测,了解其病情发展变化,以便及时采取适时的干预措施,延缓其向AD进一步发展的方向。本研究仍存在于样本量不足,对MCI和AD诊断的NAA/m I和m I/Cr比值定量指标的确立,还需要进一步扩大样本量开展进一步研究。
[1]Modrego PJ,Fayed N,Pina MA.Conversion from mild cognitive impairment to probable Alzheimer’s disease pre dicted by brainmagnetic resonance spectroscopy[J].Biological psychiatry,2014,68(15):314-317.
[2]Westman E,Aguilar C,Muehlboeck J-S,et al.Regional magnetic resonance imaging measures for multivariate analysis in Alzheimer’s disease and mild cognitive impairment[J].Brain topography,2013,26(5):19-23.
[3]Kato T,InubushiTKato N.Magnetic resonance spectroscopy in affective disorders[J].Medical Clinicsof North America,2014,85(12):221-223.
[4]Graff-Radford JKantarci K.Magnetic resonance spectroscopy in Alzheimer’s disease[J].Neuropsychiatric disease and treatment,2013,9(3):687.
[5]Teipel SJ,Grothe M,Lista S,et al.Relevance ofmagnetic resonance imaging for early detection and diagnosis of Alzheimer disease[J].Medical Clinics of North America,2013,97(12):399-424.
[6]O'BRIEN J.Role of imaging techniques in the diagnosis of dementia[J].Magnetic Resonance in Medicine,2013,56(17):883-885.
[7]Tumati S,Martens S,Aleman A.Magnetic resonance spectroscopy in mild cognitive impairment:Systematic review and meta-analysis[J].Neuroscience&Biobehavioral Reviews,2013,37(9):2571-2586.
[8]Ryan NS,Keihaninejad S,Shakespeare TJ,et al.Magnetic resonance imaging evidence for presymptomatic change in thalamus and caudate in familial Alzheimer’s disease[J]. Brain,2013,136(12):1399-1414.
[9]Sheline YI,Raichle ME.Resting state functional connectivity in preclinical Alzheimer’s disease[J].Biological Psychiatry,2013,74(17):340-347.
[10]Annweiler C,Beauchet O,Bartha R,et al.Motor cortex and gait in mild cognitive impairment:A magnetic resonance spectroscopy and volumetric imaging study[J].Brain,2013,136(21):859-871.
[11]Haris M,Nath K,Cai K,et al.Imaging of glutamate neurotransmitter alterations in Alzheimer's disease[J].NMR in Biomedicine,2013,26(7):386-391.
[12]Kantarci K.Magnetic resonance spectroscopy in common dementias[J].Neuroimaging clinicsofNorth America,2013,23(12):393-406.
[13]Jeurissen B,Leemans A,Tournier JD,et al.Investigating the prevalence of complex fiber configurations in white matter tissuewith diffusionmagnetic resonance imaging[J]. Human brain mapping,2013,34(4):2747-2766.
[14]Forster D,Davies K,Williams S.Magnetic resonance spectroscopy in vivo of neurochemicals in a transgenicmodel of Alzheimer's disease:A longitudinal study of metabolites,relaxation time,and behavioral analysis in TASTPM and wild-typemice[J].Magnetic Resonance in Medicine,2013,69(15):944-955.
[15]Menezes TL,Andrade-Valença LPA,Valença MM.Magnetic resonance imaging study cannot individually distinguish individuals with mild cognitive impairment,mild Alzheimer's disease,and normal aging[J].Arquivos de neuro-psiquiatria,2013,71(18):207-212.
[16]Konstandin S,Nagel AM.Measurement tec hniques for magnetic resonance imaging of fast relaxing nuclei[J]. Magnetic Resonance Materials in Physics,Biology and Medicine,2014,27(7):5-19.
[17]Kantarci K.Proton MRS in mild cognitive impairment[J]. Journal of Magnetic Resonance Imaging,2013,37(13):770-777.
[18]Hye A,Riddoch-Contreras J,Baird AL,etal.Plasma proteins predict conversion to dementia from prodromal disease[J].Alzheimer's&Dementia,2014,10(3):799-807.
[19]Falahati F,Westman E,Simmons A.Multivariate data analysis and machine learning in Alzheimer's disease with a focus on structuralmagnetic resonance imaging[J]. Journal of Alzheimer's Disease,2014,41(5):685-708.
[20]Liu YY,Yang ZX,Shen ZW,et al.Magnetic resonance spectroscopy study of amnestic mild cognitive impairment and vascular cognitive impairmentwith no dementi a[J].American journal of Alzheimer's disease and other dementias,2014,29(8):474-481.
[21]Baumann B,Danos P,Krell D,et al.Reduced Volume of Limbic System-Affiliated Basal Ganglia in Mood Disor ders[J].Magnetic Resonance Materials in Physics,Biology and Medicine,2014,68(17):521-523.
[22]Neuner I,Arrubla J,Felder J,et al.Simultaneous EEG-fMRI acquisition at low,high and ultra-high magnetic fields up to 9.4 T:Perspectives and challenges[J].Neu roimage,2014,102(34):71-79.
Com parative study of single-voxel proton-m agnetic resonance spectroscopy between A lzheimer’s disease(AD)and m ild cognitive im pairment(MCI)patients
XU Yunqiang1ZHANG Jiangtao2
1Department of Psychiatric,the Third People’s Hospital of Xiangshan County in Zhejiang Province,Xiangshan,315711,China;2.Department of Geriatrics,Tongde Hospital of Zhejiang Province,Hangzhou 310012,China
ObjectiveTo compare the characteristics of prefrontal lobe,hippocampus,posterior cingulate cortex(PCC)changes between Alzheimer’s disease(AD)and mild cognitive impairment(MCI)patients,single-voxel proton-magnetic resonance spectroscopywas applied.M ethodsThirty MCI,AD and matched healthy control group from September 2013 to June 2015 were inspected with single-voxel 1H-MRS in prefrontal lobe,hippocampus,posterior cingulate cortex(PCC),by using the Siemens 3.0 T Trio MR scanner.Statistical analysis was applied by using SPSS12.0 among these groups.ResultsCompared with normal group,the ratio of NAA/m Iand Cho/Cr of prefrontal lobe,hippocampus,posterior cingulate cortex(PCC)in MIC,AD group were significantly decreased and the ratio ofm I/Cr was significantly increased in AD group(P<0.05).The NAA/m I differencial value of hippocampus between AD and NG groups was remarkably greater than that of prefrontal lobe,PCC.While the NAA/m I differencial value of hippocampus between MIC and NG groupswas remarkably less than thatof prefrontal lobe,PCC.ConclusionSignificant different levels of NAA/m I and m I/Cr of prefrontal lobe,hippocampus,PCC for MIC and AD patients provides a good diagnostic basis to understand the state of MIC and AD.
Proton-magnetic resonance spectroscopy;Mild cognitive impairment(MCI);Alzheimer’s disease;Limbic system
R749.1;R445.2
A
1673-9701(2015)36-0005-04
2015-08-28)
浙江省中医药科技计划(2015ZA018)
