RNA干扰Fbxw8基因对人结肠癌细胞增殖能力的影响
2015-02-16冯金发张浩梁金龙杨泽利
冯金发 戴 猛 张浩梁 金龙 杨 勇 杨泽利 孙 侃
黑龙江省医院普外科,黑龙江哈尔滨150000
RNA干扰Fbxw8基因对人结肠癌细胞增殖能力的影响
冯金发 戴 猛 张浩梁 金龙 杨 勇 杨泽利 孙 侃▲
黑龙江省医院普外科,黑龙江哈尔滨150000
目的探讨靶向抑制Fbxw8基因对结肠癌SW 480细胞增殖的影响。方法RNA干扰(RNAi)方法下调SW 480细胞中Fbxw8的表达。通过Real-time PCR、western blotting方法分别检测Fbxw8mRNA和蛋白表达变化;CCK-8、细胞克隆形成实验及BrdU掺入法检测下调Fbxw8对SW 480细胞的增殖、DNA合成能力的影响。Western blotting检测下调Fbxw8对SW480细胞增殖相关基因表达的影响。结果Fbxw8 siRNAs显著降低SW480细胞Fbxw8 mRNA和蛋白的表达,CCK-8结果显示:与对照组(0.78±0.11)相比,两对Fbxw8 siRNAs均可显著抑制细胞的生长(0.46±0.07、0.49±0.03,P<0.05);细胞克隆形成实验显示与对照组相比,Fbxw8 siRNAs组细胞的克隆形成数目及大小显著降低。BrdU掺入实验显示与对照组(0.83±0.12)相比,Fbxw8 siRNAs均能显著下调DNA的合成能力(0.47±0.06、0.56±0.09,P<0.05);同时伴随着细胞周期蛋白cyclin E的下调而p27的表达升高。结论Fbxw8 siR NA可以通过下调cyclin E、上调p27的表达而有效抑制SW480细胞增殖,为结肠癌的基因治疗提供新的候选靶点。
结肠癌;SW 480;Fbxw8;细胞增殖;Cyclin E;p27
结肠癌是消化系统常见的恶性肿瘤之一,每年在世界范围内占新发肿瘤的第3位[1]。近年来,我国的发病率也呈逐年上升的趋势[2]。大多数结肠癌患者就诊时已有转移病灶,术后必须辅以化疗。但迄今为止,由于结肠癌细胞对化疗药物易产生耐药性,而使大多数化疗药物的疗效有限。因此临床上急需寻找结肠癌基因治疗的靶点。肿瘤细胞的恶性增殖在癌症进程过程中具有重要作用,而结肠癌细胞的恶性增殖机制目前尚不完全明确[3]。Fbxw8作为F-box蛋白,可与Skp1、Cullin7及ROC1形成CUL7/Fbxw8 E3连接酶,特异性识别并降解胰岛素受体底物-1(IRS-1),从而成为调控生长的重要分子[4-7]。研究表明,下调Fbxw8表达可显著抑制绒癌细胞JEG-3及胰腺癌细胞的增殖功能,但Fbxw8对结肠癌细胞增殖功能的影响未见报道[8]。本研究将以结肠癌细胞SW480为研究对象,通过靶向抑制此细胞中Fbxw8的表达,观察Fbxw8对SW480细胞增殖的影响,阐明Fbxw8对结肠癌细胞SW 480细胞增殖的影响之一是通过调控细胞增殖相关分子cyclin E和p27基因表达实现的。
1 材料与方法
1.1 材料
人结肠癌细胞株SW480购自ATCC,RPMI1640液体培养基及胎牛血清为Gibco公司产品,Cell Counting Kit-8为日本株式会社同仁化学研究所产品;BrdUrd试剂盒购自Roche公司,Fbxw8 siRNA,lipofectamineTM2000,Trizol为Invitrogen公司产品,逆转录、real-time PCR反应系统、SYBY荧光定量试剂盒购于TakaRa公司,基因引物为上海生工生物工程有限公司提供,Fbxw8抗体为Abcam公司产品、cyclin E抗体、p27抗体、β-actin抗体购自Santa Cruz公司,羊抗兔、羊抗鼠IgG/HRP及western blotting相关试剂购于普利莱公司。Invitrogen公司设计合成为2对由25个碱基组成的Fbxw8 StealthTM siRNA序列:Fbxw8 siRNA1:5′-CCGAAACUGGUUCAGUACCUUGAAA-3′;Fbxw8 siRNA2:5′-CAGUAGCAGCUUAUGAGGAUGGGUU-3′。
1.2 方法
1.2.1 细胞培养及转染结肠癌SW480细胞常规培养于RPMI1640培养液,其中含有10%胎牛血清、青霉素100μg/mL、链霉素100μg/mL。细胞在37℃、5% CO2培养箱中培养。对数生长期细胞接种于35mm或60 mm培养皿培养24 h,细胞汇合度达到30%~50%时,应用无血清RPMI1640培养液配制终浓度为50 nM的Fbxw8 siRNA,按照Lipo fectamineTM2000说明书进行转染操作,转染6 h后弃去转染液换为正常培养液。细胞转染实验分三组:阴性对照组(CTL),Fbxw8 siRNA1组,Fbxw8 siRNA2组。
1.2.2 Rea l-t ime PCR检测Fbxw8 mRNA表达水平细胞转染后48 h,应用Trizol提取各组细胞总RNA,紫外分光光度计测定总RNA浓度。根据逆转录试剂盒说明书操作合成cDNA后进行real-time PCR反应。检测Fbxw8的引物序列为:5′-GGATCCAGTAGATGCGTATGG-3′(Forword),5′-CAGGAGTGTCTGGAATTGTC-3′(Reverse);β-actin的引物序列为:5′-TACCTCATGAAGATCCTCACC-3′(Forword),5′-TTT CGTGGATGCCACAGGAC-3′(Reverse)。反应条件:预变性95℃30 s,然后95℃5 s,60℃30 s,反应40个循环,实验数据通过CT值法(2-△△CT)进行相对定量分析。
1.2.3 Wes t e r n b l o t检测Fbxw8蛋白表达水平细胞转染后72 h,RIPA细胞裂解液抽提各组细胞总蛋白,BCA法定量。12%SDS-PAGE电泳分离蛋白质后将产物转移到硝酸纤维薄膜上,5%脱脂奶粉封闭1 h,分别加入一抗Fbxw8(1∶500)、cyclinE(1∶1 000)、P27(1∶1 000)和β-actin(1∶2000),4℃反应过夜,TBST充分洗膜后加入辣根过氧化物酶标记的二抗,1∶2000稀释。室温孵育1 h,TBST洗膜后加入发光底物ECL,在暗室内曝光显影固定。
1.2.4 CCK-8法检测细胞存活能力对数生长期SW480细胞以1×103个/孔密度接种于96孔培养板,37℃,5%的CO2中培养过夜,然后分别转染CTL或Fbxw8 siRNAs。转染后48 h每孔分别加入10μLCCK8溶液,继续培养2 h,应用酶标仪于450 nm光波检测每孔吸光度。
1.2.5 克隆形成实验对数生长期SW480细胞1×103接种于96孔板中,按前述方法进行细胞转染。转染24 h后,消化细胞,分别接种于6孔板中(100个/孔),使细胞分散均匀,将6孔板移到培养箱中,静置培养2周,直到孔板中出现肉眼可见的克隆时终止培养。应用甲醇溶液固定细胞,结晶紫溶液染色,将6孔板放在倒置光学显微镜下观察结果。
1.2.6 Br dU比色法检测细胞DNA合成能力对数生长期SW480细胞1×103接种于96孔板中,按前述方法进行细胞转染。转染后72 h用BrdUrd标记,37℃孵育3 h;应用试剂盒带有的缓冲液冲洗3遍;应用抗BrdUrd的抗体在25℃孵育1.5 h;加入substrate solution作用0.5 h;加入封闭溶液(1M硫酸);应用酶标仪检测各组细胞的OD450 nm可吸收光度值。
1.3 统计学方法
用SPSS 13.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,P<0.05为差异具有统计学意义。
2 结果
Fbxw8 siRNAs显著降低SW480细胞Fbxw8mRNA和蛋白的表达,CCK-8结果显示:与对照组(0.78± 0.11)相比,两对Fbxw8 siRNAs均可显著抑制细胞的生长(0.46±0.07、0.49±0.03,t=2.532,t=2.643,P<0.05);细胞克隆形成实验显示:与对照组相比,Fbxw8 siRNAs组细胞的克隆形成数目及大小显著降低。BrdU掺入实验显示:与对照组(0.83±0.12)相比,Fbxw8 siRNAs均能显著下调DNA的合成能力(0.47±0.06、0.56±0.09,t=2.632,t=2.236,P<0.05);同时伴随着细胞周期蛋白cyclin E的下调而p27的表达升高。
2.1 SW 480细胞中转染Fbxw8 siRNAs后Fbxw8的mRNA和蛋白的表达
Fbxw8 siRNA 1,2分别转染SW480细胞。Realtime PCR和western blotting结果表明,与转染阴性对照(CTL)siRNA细胞相比,两对Fbxw8 siRNAs都可显著抑制SW 480细胞中Fbxw8 mRNA及蛋白表达水平(图1 A、B和C)。
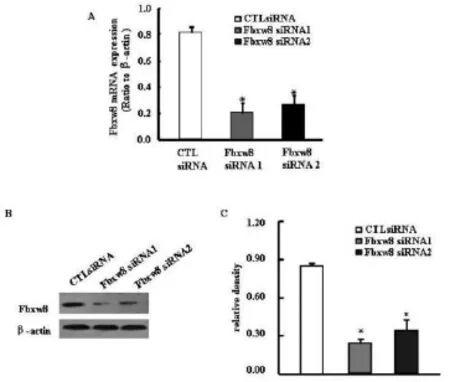
图1 Real-time PCR和western blotting法检测转染Fbxw8siRNAs对Fbxw8 m RNA和蛋白表达的影响
2.2 靶向抑制Fbxw8表达对SW 480细胞生存活力的影响
我们利用CCK-8法检测下调Fbxw8的表达对SW 480细胞生存活力的影响,结果表明,与对照组相比,两对Fbxw8 siRNAs均可显著抑制SW480细胞的存活能力(图2)。
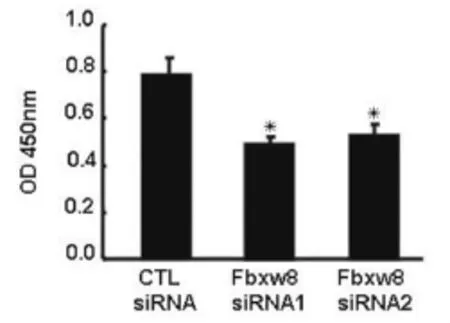
图2 靶向Fbxw8基因siRNAs对SW 480细胞生存活力的影响
2.3 靶向抑制Fbxw8表达对SW 480细胞克隆形成能力的影响
我们利用克隆形成实验评价下调Fbxw8表达对SW 480细胞增殖能力的影响。结果显示,与对照组相比,Fbxw8 siRNA转染组细胞集落显著减少,而且集落相对较小(图3)。

图3 靶向Fbxw8基因siRNAs对SW 480细胞克隆形成能力的影响
2.4 靶向抑制Fbxw8表达对SW 480细胞DNA合成能力的影响
为了进一步探讨Fbxw8对细胞增殖的影响,我们利用BrdU掺入实验检测下调Fbxw8的表达对SW 480细胞DNA合成能力的影响,结果表明,与对照组相比,两对Fbxw8 siRNAs均可显著抑制SW 480细胞的DNA的合成,从而降低细胞的增殖能力(图4)。
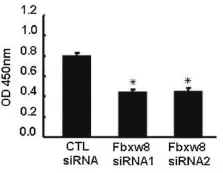
图4 靶向Fbxw8基因siRNAs对SW 480细胞DNA合成能力的影响
2.5 靶向抑制Fbxw8表达对SW 480细胞增殖相关基因表达的影响
我们利用western blotting方法检测下调Fbxw8表达对SW480细胞cyclinE和p27表达的影响。结果表明,与对照组相比,两对Fbxw8 siRNAs均可降低cyclinE的表达,而p27的表达明显升高(图5)。
3 讨论
结肠癌作为癌症相关疾病死亡的主要疾病之一,近年来,我国结肠癌的发病率及死亡率均呈逐年上升趋势。结直肠癌细胞的增殖在肿瘤进展中具有重要作用,从分子水平探寻癌细胞生长的机制,有助于发现新的治疗靶点。

图5 靶向Fbxw8基因siRNAs对SW 480细胞cyc linE及p27蛋白表达的影响
Fbxw8是SCF-like泛素E3连接酶(SCF Skp1-Cul7-Fbxw8)的重要组分,其可识别并将底物蛋白泛素化,进而泛素化蛋白质在蛋白酶体中降解[9]。基因敲除Fbxw8小鼠表现为胎盘异常及生长受限,提示其与生长相关[6,10]。研究表明,靶向抑制绒毛膜癌JEG-3细胞Fbxw8表达可显著抑制细胞的增殖能力,MiR-218也可通过靶向调控Fbxw8的表达进而调节绒毛膜癌细胞的生长[11]。本实验选择结肠癌细胞SW480,应用siRNA干扰技术下调Fbxw8表达,利用CCK-8法、BrdU掺入法及细胞克隆形成能力试验表明靶向抑制Fbxw8的表达可抑制SW480细胞的增殖。研究表明,p27是与肿瘤细胞增殖密切相关的蛋白,作为细胞周期依赖性激酶的抑制蛋白(cyclin-dependent kinase inhibitors,CDIs),可与细胞周期蛋白/细胞周期蛋白激酶(CDK)复合体结合,从而抑制复合体活性,进而抑制细胞增殖[12,13]。在许多肿瘤细胞中,发现p27的表达下调,且此种改变与肿瘤细胞的恶性增殖密切相关[14,15]。为了明确靶向抑制Fbxw8下调结直肠癌细胞的机制,我们在Fbxw8表达下调的SW480细胞中检测p27的表达,结果显示p27的表达明显升高。研究表明,p27蛋白是通过泛素-蛋白酶体途径降解的。E3连接酶Skp2可识别并泛素化降解p27[16]。本研究显示,在结直肠癌细胞SW480细胞中,下调Fbxw8表达可增加p27蛋白的表达,那么作为E3连接酶,Fbxw8下调p27是否为蛋白酶体依赖,还需进一步的实验研究。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J]. CA:ACancer Journal For Clinicians,2015,65:5-29.
[2]王宁,孙婷婷,郑荣寿,等.中国2009年结直肠癌发病和死亡资料分析[J].中国肿瘤,2013,22(7):515-520.
[3]Liu K,Zhao H,Yao H,et al.MicroRNA-124 regulates the proliferation of colorectal cancer cellsby targeting iASPP[J]. Bio Med Research International,2013.
[4]Xu X,Sarikas A,Dias-Santagata DC,et al.The CUL7 E3 ubiquitin ligase targets insulin receptor substrate 1 for ubiquitin-dependent degradation[J].Mol Cell,2008,30:403-414.
[5]Ponyeam W,Hagen T.Characterization of the Cullin7 E3 ubiquitin ligase-heterodimerization of cullin substrate receptors as a novelmechanism to regulate cullin E3 ligase activity[J].Cell Signal,2012,24:290-295.
[6]Tsunematsu R,Nishiyama M,Kotoshiba S,et al.Fbxw8 is essential for Cul1-Cul7 complex formation and for placentaldevelopment[J].Molecularand CellularBiology,2006,26(16):6157-6169.
[7]Jin J,Cardozo T,Lovering RC,et al.Systematic analysis and nomenclature ofmammalian F-box proteins[J].Genes Dev,2004,18:2573-2580.
[8]Lin P,Fu J,Zhao B,et al.Fbxw8 is involved in the proliferation of human choriocarcinoma JEG-3 cells[J].Molecular Biology Reports,2011,38(3):1741-1747.
[9]Okabe H,Lee SH,Phuchareon J,et al.A critical role for FBXW8 and MAPK in cyclin D1 degradation and cancer cell proliferation[J].Plo SOne,2006,1(1):e128.
[10]Tsutsumi T,Kuwabara H,Arai T,et al.Disruption of the Fbxw8 gene results in pre-and postnatal growth retardation in mice[J].Molecular and Cellular Biology,2008,28(2):743-751.
[11]Shi D,Tan Z,Lu R,et al.Micro RNA-218 inhibits the proliferation of human choriocarcinoma JEG-3 cell line by targeting Fbxw8[J].Biochem Biophys Res Commun,2014,450:1241-1246.
[12]Cai K,Dynlacht BD.Activity and nature of p21(WAF1)complexes during the cell cycle[J].Proc Natl Acad Sci U SA,1998,95:12254-12259.
[13]Ogryzko VV,Wong P,Howard BH.WAF1 retards S-phase progression primarily by inhibition of cyclin-dependent kinases[J].Mol Cell Biol,1997,17:4877-4882.
[14]EgilmezR,Elagoz S,Kanik EA.Cdk1/P34Cdc2 and P21waf expression in colorectal adenomas and carcinomas[J].J Exp Clin Cancer Res 20:549-552,2001.
[15]Stein JP,Ginsberg DA,Grossfeld GD,et al:Effect of p21WAF1/CIP1 expression on tumor progression in bladder cancer[J].JNatl Cancer Inst,1998,90:1072-1079.
[16]Carrano AC,Eytan E,Hershko A,et al.SKP2 is required for ubiquitin-mediated degradation of the CDK inhibitor p27[J].Nature Cell Biology,1999,1(4):193-199.
Effect of siRNA targeted against Fbxw8 on cell proliferation of colon cancer cells
FENG Jinfa DAIMeng ZHANG Hao LIANG Jinlong YANG Yong YANG Zeli SUN Kan
Department of General Surgery,Heilongjiang Hospital,Haerbin 150000,China
ObjectiveTo study the effect of siRNA targeted against Fbxw8 on cell proliferation of colon cancer SW480 cells.M ethodssiRNAs targeting Fbxw8 were transfected into SW 480 cells by lipofectaminemethod.The expression of Fbxw8mRNA and protein were detected by real-time PCR and western blotting respectively.Changes in cell proliferation and DNA synthesisweremeasured by CCK-8 and clone formation assay,bromodeoxyuridine(BrdU)incorporation. In addition,changes in expression of proliferation associated genes were studied by western blotting.ResultsTwo Fbxw8 siRNAs decreased the expression of Fbxw8 mRNA and protein level,compared with the control group(0.78± 0.11),knockdown of Fbxw8 caused inhibation of cell proliferation(0.46±0.07,0.49±0.03,P<0.05).Fbxw8 knockdown cells generated less numbers of colonies and formed significantly smaller colonies than the control group.BrdU test showed that compared the control group(0.83±0.12),Fbxw8 siRNAs downregulated the DNA synthesis(0.47±0.06,0.56±0.09,P<0.05).Westren blotting showed that cyclin E was down-regulating and p27 was up-regulating.ConclusionKnockdown of Fbxw8 can reduce proliferation of SW 480 cells through down-regulation of cyclin E and up-regulation of p27 protein,Fbxw8 hasa potential value in gene therapy of colon cancer.
Colon cancer;SW480;Fbxw8;Cell proliferation;Cyclin E;p27
R735.3+5
A
1673-9701(2015)36-0025-04
2015-11-13)
黑龙江省留学归国科学基金(LC2012C30);黑龙江省卫生厅科研课题(2012-374)
▲通讯作者
