正交试验优选盆炎康栓提取工艺
2015-02-14王聪颖曹蕾贺宝莹宋英
王聪颖,曹蕾,贺宝莹,宋英
·炮制制剂·
正交试验优选盆炎康栓提取工艺
王聪颖1,曹蕾1,贺宝莹1,宋英2
目的:优选盆炎康栓的提取工艺。方法:采用正交试验法,以绿原酸、丹酚酸B及干膏收率作为水提评价指标,以延胡索乙素和干膏收率为醇提评价指标,优选盆炎康栓提取工艺。结果:水提工艺中,提取次数对水提效果有显著影响,而加水量和提取时间无显著影响。最佳水提工艺为:8倍加水量,提取2次,每次提取1 h。醇提工艺中,乙醇浓度对提取效果有较大影响,而提取时间、加醇量无显著影响。醇提最佳工艺为:60%乙醇,6倍量,每次1.5 h,提取2次。结论:优选的提取方法稳定、合理、可行。
盆炎康栓;提取;绿原酸;丹酚酸B;延胡索乙素;正交试验
盆炎康栓由大血藤、败酱草、蒲公英、丹参、醋延胡索等7味中药组成,具有清热解毒除湿,行气活血止痛,消癥散结等功效。用于慢性盆腔炎,子宫内膜异位症所致的下腹及腰骶部疼痛,盆腔包块,痛经,不孕等症。本方为成都中医药大学附属医院经验方,该方以灌肠剂形式在临床上使用多年,疗效确切。以保证疗效、用药方便为前提,再结合栓剂比口服吸收干扰因素少、吸收度高等特点[1],将本处方开发成栓剂。根据处方药物的药效成分及预试结果,对方中除延胡索外其他药材进行水提,延胡索以醇提方式进行提取,其中水提工艺以主要药效成分绿原酸、丹酚酸B及干膏收率为考察指标,醇提工艺采用延胡索乙素和干膏收率为指标,采用正交试验优选提取工艺,为本制剂的开发研究提供工艺技术参数。
1 材料
HP1100 系列高效液相色谱仪(美国惠普公司);BP211D 电子分析天平(十万分之一,德国赛多利斯公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);RE-S2C 型旋转蒸发器(上海亚荣生化仪器厂)。甲醇和乙腈为色谱纯,水为重蒸馏水,其余试剂均为分析纯。
大血藤、丹参等药材由四川新荷花中药饮片股份有限公司提供,经成都中医药大学附属医院药剂科鉴定,均符合2010年版《中华人民
共和国药典》(一部)及地方标准的规定;绿原酸(批号:110753-200413)、丹酚酸B(批号:111562-201212,95.4%)、延胡索乙素(批号:110726-201112,99.6%)对照品均购自中国药品生物制品检定所。
2 方法与结果
2.1 水提工艺研究
2.1.1 试验设计 根据预试验结果,以加水量(A)、提取时间(B)和提取次数(C)为考察因素,采用正交试验法,以绿原酸含量、丹酚酸B含量和干膏收率为考察指标。根据因素水平表,按L9(34)正交表进行试验。因素水平见表1。

表1 提取工艺因素水平表L9(34)
2.1.2 样品提取液的制备 按处方比例称取9 份混合药材,按拟定的正交试验方案进行试验,分别加入各自规定量的水,浸泡30分钟后,按规定的提取时间和次数进行操作,过滤,合并滤液,滤液减压浓缩至400 mL,备用。
2.1.3 绿原酸含量测定[2]色谱条件 C18色谱柱(Comatex ODS,4.6 mm×150 mm,5 μm);流动相:甲醇-0.1%磷酸溶液(18∶82);流速:1 mL.min-1;检测波长:327 nm;柱温:30 ℃。理论塔板数按绿原酸计算应不低于1000。
对照品溶液制备:精密称取绿原酸对照品3.21 mg,置25 mL 棕色量瓶中,加50%甲醇溶解并定容至刻度,制成绿原酸含量为0.1284 mg.mL-1的对照品溶液。
供试品溶液制备:分别精密吸取“2.1.2”项下浓缩液各10 mL,置25 mL棕色量瓶中,用甲醇稀释并定容至刻度,摇匀,用0.45μm 微孔滤膜滤过,作为绿原酸供试品溶液。
2,方差分析见表3。
线性关系考察:分别精密吸取绿原酸对照品溶液1、2、5、10、15、20 μL注入液相色谱仪,按上述色谱条件测定绿原酸峰面积,以峰面积为纵坐标、进样量为横坐标绘制标准曲线,计算得回归方程Y=1873.2X-3.1543,r=0.9999,结果表明,绿原酸进样量在0.1284~2.568 μg范围内与峰面积线性关系良好。
含量测定:取上述对照品溶液和供试品溶液,按上述色谱条件测定,记录峰面积,采用外标法计算绿原酸含量。
2.1.4 丹酚酸B含量测定[3]色谱条件C18色谱柱(Comatex ODS,4.6 mm×150 mm,5 μm);流动相:1%甲酸-甲醇-乙腈(66:20:14);流速:1 mL.min-1;柱温:30 ℃;检测波长:286 nm。理论塔板数不低于2000。
对照品溶液制备:精密称取丹酚酸B对照品3.52 mg置10 mL量瓶中,加75%甲醇溶解并定容至刻度,摇匀,制成丹酚酸B含量为0.3358 mg.mL-1(纯度为95.4%) 的对照品溶液。
供试品溶液制备:分别精密量取“2.1.2”项下浓缩液5 mL,置25 mL量瓶中,加75%甲醇稀释并定容至刻度,摇匀,用0.45 μm微孔滤膜滤过,作为丹酚酸B供试品溶液。
线性关系考察:分别精密吸取丹酚酸B对照品溶液1、3、5、10、15、20 μL按上述色谱条件测定丹酚酸B峰面积,以峰面积为纵坐标、进样量为横坐标绘制标准曲线,计算得回归方程Y=676.84X-13.212,r=1.0000,结果表明,丹酚酸B进样浓度在0.3358~6.716 μg范围内与峰面积线性良好。
含量测定:取上述对照品溶液和供试品溶液,按上述色谱条件测定,记录峰面积,采用外标法计算丹酚酸B含量。
2.1.5 结果与分析 以绿原酸含量、丹酚酸B含量及干膏收率三者综合评分为指标,考察各因素对提取工艺的影响。综合评分=(绿原酸含量/绿原酸含量最大值)×40+(丹酚酸B含量/丹酚酸B含量最大值)×40+ (干膏收率/干膏收率最大值)×20。正交试验结果见表

表2 水提工艺条件正交试验结果

2 2.231 22.417 19.169 75.06 3 1 3 3 3 1.943 23.666 20.186 73.46 1 2 2 2 4 2.868 29.220 24.649 97.05 5 2 2 3 1 2.418 25.005 25.705 85.74 2 1 2 3 6 2.489 26.772 25.537 89.03 7 3 1 3 2 2.545 26.630 25.562 89.63 2 3 1 2 8 2.396 25.585 26.895 87.05 9 3 3 2 1 2.310 25.631 28.912 87.30 3 2 1 3 K1 225.81 263.97 253.37 250.33 K2 271.82 247.85 259.41 253.72 K3 263.98 249.79 248.83 257.56 R 15.34 5.37 3.53 2.41

表3 方差分析表
由表2 直观分析可知,影响提取效果的因素顺序为提取次数(A)>加水量(B)>提取时间(C),最佳提取工艺为A2B1C2。由表2和表3方差分析可知,提取次数(A)对提取效果有统计学意义,有显著影响,为主要因素;加水量(B)、提取时间(C)对提取效果的影响无统计学意义,为次要因素。直观分析、方差分析及生产实际情况综合考虑,将提取时间调整为1 h简化工艺。因此,最优提取工艺为A2B1C1,即煎煮2次,8倍加水量,每次煎煮1 h。
2.1.6 验证试验 为验证优选的提取工艺是否稳定、合理、可行,按上述最优提取工艺A2B1C1,按处方比例放大4 倍,进行3 批次重复提取试验,结果见表4。

表4 水提工艺验证试验结果表
结果:绿原酸、丹酚酸B含量均值分别为2.778 mg.g-1、30.314 mg.g-1,且RSD值均小于3.0%,表明该工艺稳定可行,故确定优选的工艺为A2B1C1。
2.2 醇提工艺研究[4]
2.2.1 试验设计 根据预试验结果,以加醇量(A)、提取时间(B)和乙醇浓度(C)为考察因素,共提取2次。采用正交试验法,以延胡索乙素含量和干膏收率为考察指标。根据因素水平表,按L9(34)正交表进行试验。因素水平见表5。

表5 提取工艺因素水平表L9(34)
2.2.2 样品提取液的制备 称取9份延胡索,每份50 g,按拟定的正交试验方案进行试验,分别加入各自规定量的溶剂,浸泡半个小时后,按规定的提取时间和次数进行操作,过滤,合并滤液,滤液减压浓缩至300 mL,备用。
2.2.3 延胡索乙素含量测定 色谱条件 C18色谱柱(Hypersil BDS,4.6 mm×150 mm,5 μm);流动相:甲醇-0.1%磷酸溶液(三乙胺调pH值至6.0)(55:45);流速:1 mL.min-1;柱温:30 ℃;检测波长:280 nm。理论塔板数不低于3000。
对照品溶液制备 精密称取延胡索乙素对照品0.74 mg,置10 mL 棕色量瓶中,加甲醇溶解并定容至刻度,制成延胡索乙素含量为0.074 mg.mL-1的对照品溶液。
供试品溶液制备 分别精密吸取“2.2.2”项下浓缩液各5 mL,置10 mL棕色量瓶中,用甲醇稀释并定容至刻度,摇匀,用0.45 μm 微孔滤膜滤过,作为延胡索乙素供试品溶液。
线性关系考察 分别精密吸取延胡索乙素对照品溶液1、3、5、10、15、20 μL注入液相色谱仪,按上述色谱条件测定峰面积,以峰面积为纵坐标、
进样量为横坐标绘制标准曲线,计算得回归方程Y=792.36X-2.0038,r=1.0000,结果表明,延胡索乙素进样量在0.074~1.48 μg范围内与峰面积线性关系良好。
含量测定 取上述对照品溶液和供试品溶液,按上述色谱条件测定,采用外标法计算延胡索乙素含量。
2.2.4 结果与分析 以延胡索乙素含量及干膏收率综合评分为指标,考察各因素对提取工艺的影响。综合评分=(延胡索乙素含量/延胡索乙素含量最大值)×70+(干膏收率/干膏收率最大值)×30。正交试验结果见表6,方差分析见表7。
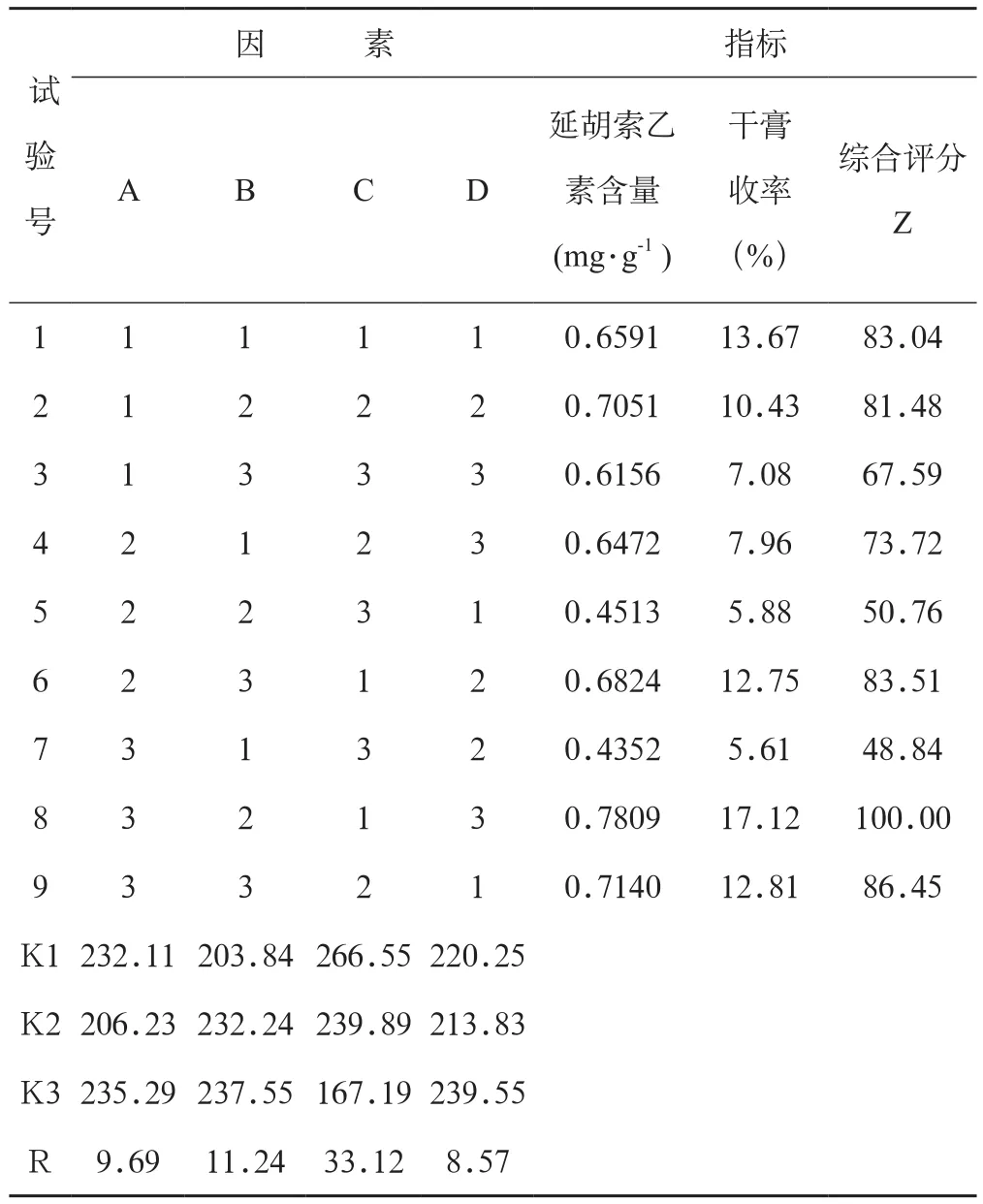
表6 醇提工艺条件正交试验结果

表7 方差分析表
由表6 分析可知,影响提取效果的因素顺序为乙醇浓度(C)>提取时间(B)>加醇量(A),最佳提取工艺为A3B3C1。由表6 和表7 方差分析可知,乙醇浓度(C)对提取效果影响较大,为主要因素;加醇量(A)、提取时间(B)对提取效果无明显影响,为次要因素。直观分析、方差分析及生产实际情况综合考虑,将加醇量调整为6倍,提取时间调整为1.5 h 简化工艺。因此,最优提取工艺为A2B2C1,即提取2次,60%乙醇,6倍加醇量,每次提取1.5 h。
2.2.5 验证试验 为验证优选的提取工艺是否稳定、合理、可行,按上述最优提取工艺A2B1C1,按处方比例放大4 倍,进行3 批次重复提取试验。

表8 醇提工艺验证试验结果表
三批样品中延胡索乙素含量和干膏收率的均值分别为0.7577 mg.g-1、18.02%,且RSD值小于3.0%,表明该工艺稳定可行,故确定优选的工艺为A2B2C1。
3 讨论
预试验中对全方水提和醋延胡索单独醇提进行了比较。结果表明,全方水提时,延胡索乙素含量极低,提取率约5%,而醋延胡索单独醇提时,提取2次,延胡索乙素提取率可达65%。参考相关文献,延胡索乙素有较好的镇痛效果[5-6]。因此确定提取工艺为延胡索醇提,其他药材采用水提工艺。
绿原酸具有较广泛的抗菌作用[7],处方中大血藤、败酱草、蒲公英均含有绿原酸。在实验前期,曾对方中大血藤、败酱草、蒲公英中绿原酸含量进行测定,分别为6.47 mg.g-1,3.07 mg.g-1,0.16 mg.g-1。因此,在选择指标时将绿原酸作为评价指标之一。方中药材成分水溶性强,出膏率大,因而将干膏收率作为评价指标之一,并在综合加权评分时赋予干膏收率20%的比重;同时本指标的考察也为后期浓缩和成型工艺研究提供试验依据。
[1] 张兆旺.中药药剂学.第4版.北京:中国中医药出版社,2007:288.
[2] 国家药典委员会.中华人民共和国药典.一部[S].北京:中国医药科技出版社,2010:306.
[3] 薛静,叶正良,李德坤,等.HPLC同时测定丹参多酚酸中丹酚酸D、迷迭香酸、紫草酸、丹酚酸B的含量[J].中国实验方剂学杂志,2013,19(3):70.
[4] 苏健,王宝琴,林瑞超.含延胡索乙素成分的药材和制剂含量测定方法研究进展[J].中国中医药信息杂志,2010,17(12): 110.
[5] 邹薇,张鹤,包永睿,等.延胡索提取工艺的优化及化学成分与药效指标相关性分析[J].中草药,2012,43(4):694.
[6] 贺凯,高建莉,赵光树,等.延胡索化学成分、药理作用及质量控制研究进展[J].中草药,2007,38(12):1909.
[7] 吴卫华,康桢,欧阳冬生.绿原酸的药理学研究进展[J].天然产物研究与开发,2006,18(4):691.
(责任编辑:何瑶)
Optimization of extraction technology for Penyankang suppository by orthogonal test/
WANG Cong-ying1, CAO Lei1, HE Bao-ying1, SONG Ying2//(1.Pharmacy college, Chengdu University of Traditional Chinese Medicine, Chengdu 610075, Sichuan; 2. The Affliated Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, Sichuan)
Objective:To optimize the extracting process of Penyankang suppository.Method:Orthogonal test was adopted in the experiment. The content of chlorogenic acid, salvianolic acid B and dry extract rate were used as indexes to optimize water extraction technology of Penyankang suppository. The content of tetrahydropalmatine and dry extract rate were regard as indexes to optimize ethanol extraction technology.Result:Extraction times had signifcant infuence on water extraction effect, but the amount of water and extraction time had no signifcant infuence. Optimum water extraction technology of Penyankang suppository was as following: extract two times with eight times of water, one hour each time. In the ethanol extraction process, the ethanol concentration influenced the extraction in some extent, but extraction time and ethanol volume had not significant influence. Optimum ethanol extraction technology of Penyankang suppository was as following:extract two times with six times 60% ethanol, one hour and a half each time.Conclusion:This optimized extraction process is stable, rational and feasible, which can be applied in the industrial production of Penyankang suppository.
Penyankang suppository; extraction; chlorogenic acid; salvianolic acid B; tetuahydroplmatine; orthogonal test
R 283.6
A
1674-926X(2015)02-009-04
1.成都中医药大学,四川 成都 610075;
2.成都中医药大学附属医院,四川 成都 610072
王聪颖,女,硕士研究生,研究方向:中药新制剂研究 Email:congying761@126.com
宋英,男,主任药师,硕士生导师,研究方向:中药炮制与制剂
Tel:028-87783735 Email:songying624@163.com
2014-11-03
