异丙酚改善氯胺酮诱发幼年大鼠脑损伤的蛋白组学研究
2015-02-08周赤忠潘德锐
付 伟,周赤忠,潘德锐
(湖北省武汉市普仁医院,湖北 武汉 430081)
异丙酚改善氯胺酮诱发幼年大鼠脑损伤的蛋白组学研究
付 伟,周赤忠,潘德锐
(湖北省武汉市普仁医院,湖北 武汉 430081)

目的探讨异丙酚复合氯胺酮麻醉引起幼年大鼠海马神经元以及认知功能损害后海马组织蛋白组学的变化,了解异丙酚脑保护作用的机制。方法将出生后7d幼鼠80只随机分为生理盐水组、氯胺酮组、氯胺酮+异丙酚低剂量组、氯胺酮+异丙酚高剂量组,除生理盐水组外,其余组均每隔2h给予相应药物腹腔注射1次,连续给药3次后,每组处死10只大鼠进行大脑海马组织切片及海马蛋白提取,应用MALDI-TOF指纹图谱检测系统进行蛋白组学差异研究。各组剩余的10只大鼠进行水迷宫实验,之后处死进行海马蛋白检测。结果在3d时,氯胺酮组潜伏期显著高于生理盐水组,穿环次数显著低于生理盐水组;氯胺酮+异丙酚低剂量组和氯胺酮+异丙酚高剂量组潜伏期明显低于氯胺酮组,氯胺酮+异丙酚高剂量组明显低于氯胺酮+异丙酚低剂量组;氯胺酮+异丙酚低剂量组和氯胺酮+异丙酚高剂量组穿环次数显著高于氯胺酮组, 氯胺酮+异丙酚高剂量组与生理盐水组和氯胺酮+异丙酚低剂量组比较差异均无统计学意义。氯胺酮组海马神经元凋亡指数明显高于生理盐水组,氯胺酮+异丙酚低剂量组和氯胺酮+异丙酚高剂量组均明显低于氯胺酮组,但氯胺酮+异丙酚低剂量组仍明显高于生理盐水组,氯胺酮+异丙酚高剂量组与生理盐水组比较差异无统计学意义。氯胺酮组海马组织蛋白浓度明显低于生理盐水组,氯胺酮+异丙酚低剂量组和高剂量组与氯胺酮组相比差异均无统计学意义。氯胺酮+异丙酚组在末次给药后检测海马组织蛋白,发现上调蛋白并鉴定为PD1A3、NDUFB10、HSPA8、ATP5JD、PSMA1、isoform-CRA-c,下调蛋白为PPIA、PKM2、GFAP、NSE、SYN1;21d后检测结果表达上调蛋白为FUBP3、PRDX5,下调蛋白为GAPDH、AKR1A1、VCP、TUBULINA1B。结论本实验中蛋白质组学技术初步筛选了异丙酚及氯胺酮麻醉后海马组织蛋白的差异表达,为预防和改善海马神经元变化后认知功能损害提供了理论基础。
异丙酚;大鼠脑;损伤;蛋白组学
氯胺酮是临床常用的静脉麻醉药,镇痛效果较好,呼吸抑制较轻,常用于儿科和全身基础麻醉[1]。异丙酚常作为麻醉诱导剂,具有起效快、无蓄积、苏醒完全等优点[2]。许多研究表明氯胺酮麻醉可造成发育期脑损伤,导致认知功能障碍,而异丙酚具有脑保护作用,术后患者意识恢复迅速,并能够减轻氯胺酮对幼儿神经元的损伤,减轻认知功能损害,但其具体机制尚不十分明确[3]。本实验采用双向凝胶电泳蛋白分离手段和高效率蛋白质谱鉴定技术,系统地分析了幼年大鼠用氯胺酮联合异丙酚麻醉后海马组织蛋白组学的变化,从而更深入了解异丙酚脑保护作用的机制,为临床合理、安全使用静脉麻醉药物,特别是小儿静脉麻醉提供理论指导。
1 实验资料
1.1实验动物 出生后7d的SD幼年大鼠80只,雌雄不拘,体质量13~19 g,母幼鼠SPF饲养。
1.2主要试药及器材 生理盐水,异丙酚(北京费森尤斯卡比医药有限公司生产,H20040300),氯胺酮(山西金源通制药有限公司生产,国药准字H14021800);双向凝胶电泳标准蛋白质;蛋白考马斯亮蓝染色试剂盒、细胞凋亡检测试剂盒。倒置相差显微镜,固相pH梯度等电聚焦仪,ETTAN ImageMaster 2D Elite 4.01凝胶图像分析软件,MALDT-TOF指纹图谱检测系统(Alllersham Pharmaeia Biotech公司),Morris水迷宫(成都泰盟科技有限公司)。
1.3方法
1.3.1分组及模型建立 将80只SD幼鼠随机分为生理盐水组、氯胺酮组、氯胺酮+异丙酚低剂量组、氯胺酮+异丙酚高剂量组,每组20只。异丙酚及氯胺酮配置浓度均为80 mg/kg。氯胺酮组给予氯胺酮1 mL腹腔注射麻醉,氯胺酮+异丙酚低剂量组给予氯胺酮1 mL+异丙酚0.5 mL腹腔注射麻醉,氯胺酮+异丙酚高剂量组给予氯胺酮1 mL+异丙酚1 mL腹腔注射麻醉,均每隔2 h给药1次,连续给药3次。
1.3.2样品制备 麻醉结束后从各组随机选10只幼鼠断头处死,迅速取出脑组织,分离皮质取出海马区,进行石蜡包埋,制作石蜡切片,用于神经元细胞凋亡检测,并进行海马蛋白检测。各组余下幼鼠麻醉结束后饲养21 d,进行水迷宫实验,之后处死进行海马蛋白样品制备:取新鲜脑组织,迅速分离皮层和海马,用0~2 ℃蒸馏水清洗,并用滤纸吸取的多余水分,转入液氮中保存。将样本取出低温匀浆,并加入裂解液提取总蛋白,蛋白样品溶液小量分装,-80 ℃保存备用。
1.3.3检测指标 采用细胞凋亡检测试剂盒进行海马神经元细胞凋亡检测;用2D Quant蛋白定量试剂盒测定总蛋白样品的蛋白浓度;2-DE凝胶电泳分离蛋白质点,并采用MALDI-TOF指纹图谱检测系统及数据库查询及Wester-blot验证进行蛋白差异定点鉴定。
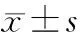
2 结 果
2.1水迷宫实验结果 在3d时,氯胺酮组潜伏期显著高于生理盐水组(P<0.01),穿环次数显著低于生理盐水组(P<0.01);氯胺酮+异丙酚低剂量组和氯胺酮+异丙酚高剂量组潜伏期明显低于氯胺酮组(P均<0.05),氯胺酮+异丙酚高剂量组明显低于氯胺酮+异丙酚低剂量组(P<0.05);氯胺酮+异丙酚低剂量组和氯胺酮+异丙酚高剂量组穿环次数显著高于氯胺酮组(P均<0.05), 氯胺酮+异丙酚高剂量组与生理盐水组和氯胺酮+异丙酚低剂量组比较差异均无统计学意义(P均>0.05)。见表1。
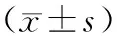
表1 水迷宫实验结果
注:①与生理盐水组比较,P<0.01;②与氯胺酮组比较,P<0.05;③与氯胺酮+异丙酚低剂量组比较,P<0.5。
2.2幼鼠海马神经元细胞凋亡情况 生理盐水组海马神经元凋亡指数为(2.71±2.12)%,氯胺酮组为(14.98±5.65)%,氯胺酮+异丙酚低剂量组为(10.23±4.82)%,氯胺酮+异丙酚高剂量组为(6.79±6.48)%。氯胺酮组海马神经元凋亡指数明显高于生理盐水组(P<0.01),氯胺酮+异丙酚低剂量组和氯胺酮+异丙酚高剂量组均明显低于氯胺酮组(P均<0.05),但氯胺酮+异丙酚低剂量组仍明显高于生理盐水组(P<0.05),氯胺酮+异丙酚高剂量组与生理盐水组比较差异无统计学意义(P>0.05)。
2.3幼鼠海马组织蛋白浓度 生理盐水组海马组织蛋白浓度为(2.11±0.32)μg/μL,氯胺酮组为(1.78±0.28)μg/μL,氯胺酮+异丙酚低剂量组为(1.88±0.27)μg/μL,氯胺酮+异丙酚高剂量组为(1.93±0.21)μg/μL。氯胺酮组海马组织蛋白浓度明显低于生理盐水组(P<0.05),氯胺酮+异丙酚低剂量组和氯胺酮+异丙酚高剂量组与氯胺酮组相比差异均无统计学意义(P均>0.05)。
2.4氯胺酮+异丙酚组不同时间点差异表达蛋白的上调及下调结果 末次给药后检测海马组织蛋白,发现上调蛋白并鉴定为PD1A3、NDUFB10、HSPA8、ATP5JD、PSMA1、isoform-CRA-c,下调蛋白为PPIA、PKM2、GFAP、NSE、SYN1;21d后检测结果表达上调蛋白为FUBP3、PRDX5,下调蛋白为GAPDH、AKR1A1、VCP、TUBULINA1B。
3 讨 论
大脑中的海马是神经系统中参与认知功能的重要组织[4]。NMDA受体是大脑中广泛分布的受体,大脑皮质和海马中分布最多,而氯胺酮是NMDA受体的非竞争性拮抗剂,影响NMDA受体介导的CaMKs-ERK-EIKI/CREB-LTP信号转导通路,从而影响机体的学习记忆功能[5-6];并且可通过下调NMDA受体通道亚单位NR2BmRNA的表达,改变NMDA受体的构成从而损害认知功能,可以通过诱导神经元细胞凋亡的方式造成脑损害,从而导致近期或远期认知功能障碍[7]。其对认知功能的影响是一个复杂的过程,涉及多种蛋白质的表达和变化,并引起生物学信号或通路的改变。而异丙酚可在一定程度上抑制氯胺酮所致caspase-3表达上调,从而抑制氯胺酮诱发的神经元凋亡[8-10],并降低脑氧代谢率及颅内压,同时具有抗脂质过氧化作用,可阻断谷氨酸的传导路径,抑制钙超载,防止由此引起的细胞损伤[11],减少自由基的生成[12]等。本研究结果显示,氯胺酮组海马神经元凋亡指数明显高于生理盐水组,氯胺酮+异丙酚低剂量组和氯胺酮+异丙酚高剂量组均明显低于氯胺酮组,但氯胺酮+异丙酚低剂量组仍明显高于生理盐水组,氯胺酮+异丙酚高剂量组与生理盐水组比较差异无统计学意义。氯胺酮组海马组织蛋白浓度明显低于生理盐水组,氯胺酮+异丙酚低剂量组和高剂量组与氯胺酮组相比差异均无统计学意义。
蛋白组学分析不仅可以证实靶点多肽或蛋白质存在与否, 而且可以对上调或下调的蛋白表达进行定量分析, 对疾病的发病机制与治疗学研究具有广泛的应用价值[13]。本研究结果显示,氯胺酮+异丙酚组末次给药后检测海马组织蛋白,发现上调蛋白6个并鉴定为PD1A3、NDUFB10、HSPA8、ATP5JD、PSMA1、isoform-CRA-c,下调蛋白9个确定为PPIA、PKM2、GFAP、NSE、SYN1;21d后检测结果表达上调蛋白为FUBP3、PRDX5,下调蛋白为GAPDH、AKR1A1、VCP、TUBULINA1B。氯胺酮麻醉后导致突触囊泡转运的蛋白(SYN1和DNMr)表达下调,而SYNI表达下调可以导致囊泡到达活性区较少,影响突触传递效率,而21d后VCP表达下调,不仅影响UPP系统的蛋白降解,还可能抑制NF-κB凋亡活性,这些都会影响海马的功能恢复[14]。海马特异性钙结合蛋白(HPCA)主要存在于海马椎体神经元,属于钙离子传感器家族一员,可以调控海马神经元突触可塑性的信号通路,影响神经细胞骨架元件的产生、稳定等正常生理功能[15]。NDUFB10上调,NSE、PKM2和AfPSB下调影响蛋白微管聚合,不利于能量代谢。异丙酚和氯胺酮麻醉药都存在机体代偿性修复,异丙酚主要表现在HSPA8、TUBLIN,而氯胺酮通过HSPA8和PSMA1进行蛋白质量控制。麻醉后21d异丙酚组抗氧化能力增强,大多数蛋白恢复正常,主要表现为GAPDH、ATPSB等表达上调,而氯胺酮VCP、TUBULINa表达下调,不利于蛋白稳定,甚至引起神经元凋亡。
综上所述,本实验中蛋白质组学技术只初步筛选了异丙酚及氯胺酮麻醉后海马组织蛋白的差异表达,但是不能直接反映检定的差异表达蛋白在本研究中所发挥的具体机制,有待进一步探讨。
[1] 张子江,刘丽妹. 异丙酚复合氯胺酮恒速静脉注射用于小儿表浅手术麻醉的临床观察[J]. 中国医药指南,2013,11(3):511-512
[2]FredrikssonA,ArcheLT,AimH,etal.NeurofunctionaldeficitsandpotentiatedapoptosisbyneonatalNMDAantagonistadministration[J].BehavBrainRes,2004,153(2):367-376
[3]GelbAW,BayonaNA,WilsonJX,etal.Pmpofolanesthesiacomparedtoawakereducesinfarctsizeinrats[J].Anesthesiology,2002,96(5):1183
[4]ZhaoH,LiQ,ZhangZ,etal.Long-termginsenosideeonsumptionPreventsmemorylossinAgedSAMP8mieebydecreasingoxidativestressandup-regulatingthePlastieity-relatedProteinsinhipocampus[J].BrainRes,2009,1256:111-122
[5]OzturkE,DemirbilekS,KadirButA,etal.Antioxidantpropertiesofpropofolanderythropoietinafterclosedheadinjuryinrats[J].ProgNeuroschopharmacolBiolPsychiatry,2005,29(6):922-927
[6]RichardJS,DonnaSD.CancerProteomics:fromsignalingnetworkstotumormarkers[J].TrendBiotechnol,2001,19(10): 40-47
[7]HaskinsWE,KobeissyFH,WolperRA,etal.RapiddiscoveryofputativeproteinbiomarkersoftraumaticbraininjurybySDS-PAGE-capillaryliquidchromatography-tandemmassspectrometry[J].JNeurotrauma,2005,22(6):629-644
[8] 伍佳莉,苏松,段晓霞,等. 异丙酚对氯胺酮诱发新生大鼠脑损伤的影响[J]. 中华麻醉学杂志,2011,31(6):717-719
[9] 周淑敏,伍佳莉,徐陶,等. 异丙酚对氯胺酮致老龄大鼠认知功能障碍的影响[J]. 中华麻醉学杂志,2010,30(9):729-730
[10]ChenL,XueZ,JiangH.Effectofpropofolonpathologictime-courseandapoptosisaftercerebralischemia-reperfusioninjury[J].ActaAnaesthesiolScand,2008,52(3):413-419
[11]GrasshoffC,GillessenT.EfectsofpropofolonN-methyl-D-aspartatereceptor-mediatedcalciumincreaseinculturedratcerebrocorticalneurons[J].EurJAnaesthesiol,2005,22(6):467-470
[12]ChengYJ,WangYP,ChienCT,etal.Small-dosepropofolsedationattenuatestheformationofreactiveoxygenspeciesintourniquet-inducedischemia-reperfusioninjuryunderspinalanesthesia[J].AnesthAnalg,2002,94(6):1617-1620
[13]CidC,Garcia-BonillaL,CamafeitaE,etal.Proteomiccharacterizationofproteinphosphatase1complexesinischemia-reperfusionandischemictolerance[J].Protepmics,2007,7(17):3207-3218
[14]MaurerMH,HauxD,SakowitzOW,etal.Identificationofearlymarkersforsymptomaticvasospasminhumancerebralmicrodialysateaftersubarachnoidhemorrhage:preliminaryresultsofaproteome-widescreening[J].JCerebBloodFlowMetab,2007,27(10):1675-1683
[15]BairdAE.Bloodgenomicsinhumanstroke[J].Stroke,2007,38(2Suppl):694-698
Research on proteomics improved by propofol in the brain injury of new born rats induced by ketamine anesthesia
FU Wei, ZHOU Chizhong, PAN Derui
(Puren Hospital of Wuhan City, Wuhan 430081, Hubei, China)
Objective It is to investigate the cause of propofol combined with ketamine anesthesia juvenile rat hippocampal neurons and cognitive dysfunction in hippocampal tissue proteomic changes, revealing changes in the pathogenesis of hippocampal neurons, providing guidance for improving clinical anesthesia safety. Methods 80 rats after birth 7d were divided into saline group (N group), ketamine group (K group), propofol+ketamine group (P+K group) low and high dose group children anesthesia simulation and carried hippocampus and hippocampal slices protein extraction, two-dimensional electrophoresis applications and matrix assisted laser desorption/ionization-time of flight mass spectrometry (MALDI-TOF) proteomic differences between studies. Results The water maze reaction spell cognitive function; N hippocampal neuronal apoptosis index, K group, compared with the N group (P<0.01), significant statistical significance, while the P + K group and K group was significantly lower compared to the significantly reduced apoptosis (P<0.05), but the low-dose group P + K is still high compared with the N group, the difference was significant (P<0.05), and P + K high dose groups was not significant. K hippocampal tissue protein concentration, and the NS group, compared with a significant difference. P + K and K group compared with the group with an increasing trend compared with the N -group difference was not significant. K + P group to detect protein in the hippocampus 6h, raised protein found and identified as PD1A3, NDUFB10, HSPA8, ATP5JD, PSMA1, reduced protein PPIA, PKM2, GFAP, NSE, PPIA, PKM2, GFAP and other test results after expressing 21d regulated protein FUBP3, PRDX5, down protein GAPDH, AKR1A1, VCP. Conclusion In this study, a preliminary screening technique in proteomics propofol and ketamine anesthesia differentially expressed in hippocampal tissue protein, in order to improve the prevention and changes in cognitive function in hippocampal neurons provide a theoretical basis for damages.
propofol; brain injury; rats; proteomics
付伟,男,主治医师,主要从事神经外科临床工作。
10.3969/j.issn.1008-8849.2015.28.007
R-332
A
1008-8849(2015)28-3098-03
2015-06-15
