瑞舒伐他汀对脑缺血再灌注损伤大鼠神经细胞凋亡及Caspase-3表达的影响
2015-02-07张俊华苏建华陈玉芳薛建琴耿瑜睿
张俊华,苏建华,陈玉芳,薛建琴,耿瑜睿
(1. 江苏大学附属金坛医院(金坛市人民医院),江苏 金坛 213200;2. 江苏省常州市第四人民医院,江苏 常州 213000)
瑞舒伐他汀对脑缺血再灌注损伤大鼠神经细胞凋亡及Caspase-3表达的影响
张俊华1,苏建华1,陈玉芳2,薛建琴1,耿瑜睿1
(1. 江苏大学附属金坛医院(金坛市人民医院),江苏 金坛 213200;2. 江苏省常州市第四人民医院,江苏 常州 213000)

目的 观察瑞舒伐他汀对大鼠脑缺血再灌注损伤神经细胞凋亡及Caspase-3表达的影响,探讨其神经保护作用机制。方法 将健康雄性Wistar大鼠随机分为假手术组、模型组、瑞舒伐他汀组,余假手术组外,其余2组制作缺血再灌注损伤大鼠模型。分别在脑缺血再灌注后12 h、24 h、72 h取各组大鼠脑组织,检测神经细胞凋亡数及Caspase-3阳性表达细胞数。结果 与假手术组比较,模型组和瑞舒伐他汀组神经细胞凋亡数和Caspase-3阳性表达细胞数均明显增加(P均<0.01),瑞舒伐他汀组神经细胞凋亡数和Caspase-3阳性表达细胞数均明显低于模型组(P均<0.01);随缺血再灌注时间延长,各组神经细胞凋亡数和Caspase-3阳性表达细胞数均逐渐减少,组内再灌注各时间点比较差异均有统计学意义(P均<0.01)。结论 瑞舒伐他汀对脑缺血再灌注损伤有神经保护作用,其作用机制可能与下调Caspase-3的表达、对抗细胞凋亡有关。
瑞舒伐他汀;脑缺血再灌注损伤;神经细胞凋亡;Caspase-3
随着现代医学的不断发展,证实凋亡和坏死共同导致脑缺血再灌注后的神经元死亡。缺血后神经元死亡分别涉及主动和被动细胞死亡机制,主要表现为坏死和凋亡2种形式。有研究表明,急性缺血性脑损伤后,在梗死的中心区细胞出现坏死,而在半暗带区以凋亡为主,这种凋亡是梗死灶扩大的关键因素[1]。在脑缺血后程序性细胞死亡过程中激活了Caspase-3,Caspase-3直接参与了脑缺血再灌注损伤的病理生理过程,导致细胞骨架蛋白、DNA修复蛋白及其他Caspase相关底物蛋白的裂解,最终发生细胞凋亡[2]。本研究探讨了瑞舒伐他汀对大鼠脑缺血再灌注损伤脑组织神经细胞凋亡及Caspase-3表达的影响,旨在为其临床应用提供依据。
1 实验资料
1.1实验动物 健康雄性Wistar大鼠(SPF级)54只,体质量220~250 g,由东南大学动物中心提供,合格证号为SYXK(苏)2010-0004。屏障环境普通颗粒饲料和自来水喂养,实验室室温维持在(21±2) ℃,湿度控制在50%~70%,每天更换垫料。
1.2 主要药品和试剂 羊抗大鼠Caspase-3多克隆抗体,TUNEL凋亡试剂盒(武汉博士德公司),S-P免疫组化染色试剂盒,DAB显色试剂盒(福州迈新公司),其他试剂为国产分析纯。
1.3 实验方法
1.3.1 实验动物分组 54只Wistar成年大鼠在实验室适应1周,按随机化原则分为假手术组、模型组、瑞舒伐他汀组,每组18只。每组又按再灌注时间分为再灌注12 h、24 h和72 h 3个亚组,每组6只。
1.3.2 给药方法 假手术组和模型组用0.9%氯化钠20 mL/kg每天1次灌胃。瑞舒伐他汀组预先4周给予瑞舒伐他汀(南京正大天晴制药有限公司国药准字)4 mg/(kg·d)每天1次灌胃,再灌注期间继续瑞舒伐他汀4 mg/(kg·d)每天1次灌胃。
1.3.3 大鼠脑缺血再灌注模型的建立 大鼠禁食24 h,采用腹腔内注射3%戊巴比妥1.6 mL/kg进行麻醉。取颈前左旁25 mm的纵向切口,钝性游离左侧颈总动脉(CCA),结扎颈外动脉(ECA)和同侧CCA近心端,用动脉夹夹闭颈内动脉(ICA);在CCA结扎的远心端剪一小口并插入A4号栓塞线,松开动脉夹,栓塞线进入左侧颈内动脉,并延伸到大脑中动脉的起始部,然后用缝合线系住栓塞线,确认无活动性出血后缝合皮肤;在缺血3 h时将栓塞线拔出10 mm形成再灌注。假手术组手术步骤同手术组,但是术中不插入栓塞线。制作缺血再灌注损伤大鼠模型后,待每只大鼠麻醉清醒后,立即给予判定。实验大鼠不能伸展对侧前爪或者向对侧转圈或者向对侧倾倒即为成功模型[3]。
1.3.4 大鼠脑组织标本取样及制备 分别在脑缺血再灌注后12 h、24 h、72 h取大鼠脑组织。取样方法:用3%戊巴比妥1.6 mL/kg对大鼠进行麻醉,开胸经左心室插管至主动脉并固定,剪开右心耳,先快速灌注100 mL冰生理盐水,然后灌注400~600 mL 4 ℃的4%多聚甲醛磷酸缓冲液,直至肝脏、四肢发白和僵硬。断头取脑,取左侧大脑顶叶皮质置于4%多聚甲醛磷酸缓冲液中固定后用于细胞凋亡及免疫组化的检测。
1.3.5 观察指标和图像分析 用TUNEL法检测神经细胞凋亡情况;用免疫组织化学染色方法按S-P试剂盒说明书操作步骤检测Caspase-3蛋白阳性表达细胞数。各组在各时间点分别进行神经细胞凋亡和Caspase-3蛋白表达检测,每张切片400倍高倍镜下任取5个视野分别计数相应的细胞凋亡数和Caspase-3阳性表达数,取其平均值。凋亡细胞呈棕褐色或棕黄色,颗粒深染,胞核固缩;Caspase-3阳性表达时胞质和/或核着色为棕黄色。

2 结 果
2.1神经细胞凋亡情况 见表1。

表1 各组神经细胞凋亡数比较个)
注:①与假手术组比较,P<0.01;②与模型组比较,P<0.01;③与再灌注12 h比较,P<0.01;④与再灌注24 h比较,P<0.01。
2.2 Caspase-3蛋白阳性表达情况 再灌注 12 h、24 h、72 h,模型组和瑞舒伐他汀组Caspase-3蛋白阳性数均明显高于假手术组(P均<0.01),瑞舒伐他汀组明显低于模型组(P均<0.01);随缺血再灌注时间延长,各组Caspase-3蛋白阳性数均逐渐减少,组内再灌注各时间点比较差异均有统计学意义(P均<0.01)。见表2及图1~9。

表2 各组Caspase-3蛋白阳性表达细胞数比较个)
注:①与假手术组比较,P<0.01;②与模型组比较,P<0.01;③与再灌注12 h比较,P<0.01;④与再灌注24 h比较,P<0.01。
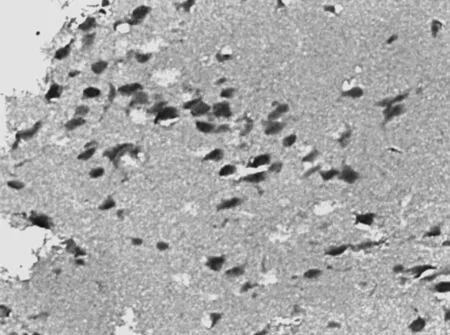
图1 假手术组12 h Caspase-3阳性细胞表达情况(×400)

图2 假手术组24 h Caspase-3阳性细胞表达情况(×400)
3 讨 论
细胞凋亡与脑缺血再灌注损伤密切相关,在脑缺血再灌注损伤的病理生理过程中,细胞凋亡及多种基因表达的改变和互相调控起重要作用[4],脑损伤范围的大小与神经凋亡细胞的数量相关[5]。凋亡存在2种主要的相互关联途径,即内源性途径(线粒体途径)和外源性途径(细胞表面死亡受体途径)。目前已发现14种Caspase蛋白[6],Caspase家族中的某些成员具有重要的调控和效应作用,参与了凋亡的信号传导,Caspase-3作为其中一个重要成员,其表达和活化水平的异常升高则是启动凋亡的关键环节[7]。正常状态的脑细胞中,存在无活性的以休眠状态的酶原形式存在的Caspase-3,以上2条途径可将其激活。PARP、actin、fodrin、lamin等不同底物被活化的Caspase-3切割,从而导致蛋白酶级联放大,最终使细胞走向凋亡[8]。活化的Caspase-3通过水解特异性蛋白,一方面直接导致凋亡,另一方面破坏细胞骨架蛋白及其调节蛋白、参与DNA修复的酶等,抑制修复DNA,协助完成凋亡的过程。在脑组织缺血、损伤的凋亡过程中,可检测到活性增强的Caspase-3蛋白因子[9]。

图3 假手术组72 h Caspase-3阳性细胞表达情况(×400)
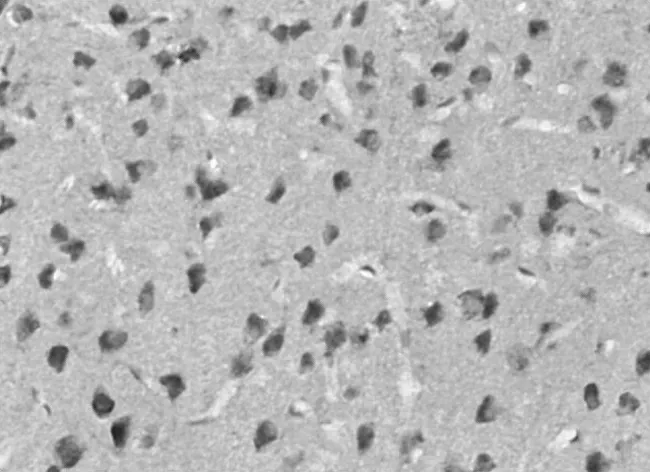
图4 模型组12 h Caspase-3阳性细胞表达情况(×400)

图5 模型组24 h Caspase-3阳性细胞表达情况(×400)

图6 模型组72 h Caspase-3阳性细胞表达情况(×400)
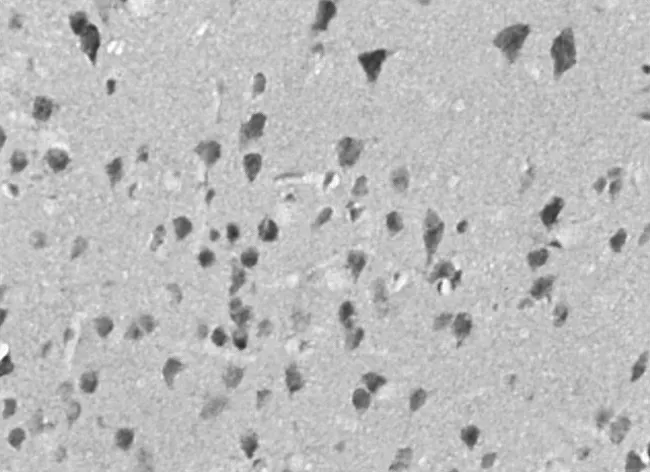
图7 瑞舒伐他汀组12 h Caspase-3阳性细胞表达情况(×400)

图8 瑞舒伐他汀组24 h Caspase-3阳性细胞表达情况(×400)

图9 瑞舒伐他汀组72 h Caspase-3阳性细胞表达情况(×400)
Caspase-3是细胞凋亡的关键蛋白酶,多种因素促使Caspase-3的激活和释放,在凋亡过程中起着最后的枢纽作用。范磊等[10]研究报道,去除Caspase-3基因的大鼠和正常大鼠相比,脑缺血2 h再灌注48 h后,TUNEL阳性细胞数降低了36%,梗死体积下降了55%,这说明Caspase-3在脑缺血再灌注细胞损伤中发挥了重要作用。在脑组织缺氧缺血过程中及缺血再灌注损伤中,应用Caspase-3抑制剂可使脑缺血后神经元凋亡的数量明显减少,脑缺血病灶范围缩小,从而有效地保护脑细胞。以上研究结果说明Caspase-3参与了脑缺血性损伤,促进了神经元的凋亡,在神经元凋亡过程中发挥重要作用。
他汀类药物是3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA) 还原酶抑制剂[11],可能通过多种途径、多种机制发挥抗氧化作用,从而挽救缺血半暗带,保护缺血脑细胞[12]。本研究结果显示,模型组和瑞舒伐他汀组缺血再灌注后神经细胞凋亡数及Caspase-3蛋白阳性表达数均明显高于假手术组,再灌注12 h达高峰,然后逐渐下降。与模型组比较,瑞舒伐他汀组神经细胞凋亡数及Caspase-3蛋白阳性表达数明显降低。可见,脑缺血再灌注损伤引起了神经细胞凋亡和Caspase-3阳性表达的增加,但是用瑞舒伐他汀预处理能减少神经细胞凋亡和Caspase-3的表达,从而减轻脑缺血再灌注损伤。
脑缺血再灌注后神经细胞凋亡是造成再灌注损伤的主要因素之一,改善脑缺血再灌注损伤的有效方法是阻断再灌注后的神经细胞凋亡[13]。本研究发现,瑞舒伐他汀对脑缺血再灌注损伤有神经保护作用,其作用机制可能与下调Caspase-3表达、对抗细胞凋亡有关,本研究为临床应用瑞舒伐他汀治疗缺血性卒中提供了理论依据。
[1] 臧召霞,刘志强,梁庆成. 神经节苷脂对大鼠脑缺血再灌注后Caspase-3表达的影响[J]. 中国实用医药,2010,5(8):27-29
[2] 闫凤霞,高维娟. Caspase-3与脑缺血再灌注损伤[J]. 中国老年学杂志,2009,29(16):2119
[3] Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without cranicetomy in rats[J]. Stroke,1989,20(1):84-91
[4] Fried lander RM. Apoptosis and caspases in neurodegenerative diseases[J]. N Eng l J Med,2003,348(14):1365-1375
[5] 李小刚,朱克,李楠,等. 谷氨酸对神经细胞钙离子内流和凋亡的影响及谷氨酸受体拮抗剂保护作用的研究[J]. 中华老年心脑血管疾病杂志,2001,3(2):122-125
[6] Faubel S,Edelstein CL. Caspases as drug targets in ischemic organ injury[J]. Curr Drug Targets Immune Endocr Metabol Disord,2005,5(3):269-287
[7] Dingman A,Lee SY,Derugin N,et al. Aminoguanidine inhibitscaspase-3 and calpain activation without affectingm icroglial act-ivation following neonatal transient cerebral ischemia[J]. J Neurochem,2006,96(5):1467-1479
[8] 张慧,尹琳,刘丽梅. 脑缺血后处理对大鼠海马Caspase-3表达的影响[J]. 中国实用神经疾病杂志,2010,13(9):8-10
[9] Espinosa-García C,Vigueras-Villaseor RM,Rojas-Castaeda JC,et al. Post-ischemic administration of progesterone reduces caspase-3 activation and DNA fragmentation in the hippocampus following global cerebral ischemia[J]. Neurosci Lett,2013,550:98-103
[10] 范磊,杨金升,张明磊,等. 人尿激肽原酶对大鼠脑缺血再灌注后神经细胞凋亡的影响[J]. 中风与神经疾病杂志,2010,27(3):233-236
[11] 闫涛,孟林. 瑞舒伐他汀与辛伐他汀治疗缺血性脑卒中的疗效比较[J]. 中国药房,2012,23(4):327-329
[12] 谢坤,李勇. 他汀类药物的多效性研究[J]. 世界临床药物,2005,26(10):589-591
[13] 王旭刚,高政. 预防性应用阿托伐他汀对SD大鼠局部脑缺血再灌注脑组织Caspase-3表达的影响[J]. 中国实用神经疾病杂志,2011,14(16):20-21
Effects of Rosuvastatin on neural cell apoptosis and Caspase-3 expression of rats with cerebral ischemia reperfusion injury
ZHANG Junhua1, SU Jianhua1, CHEN Yufang2, XUE Jianqin1, GENG Yurui1
(1. Affiliated Jintan Hospital of Jiangsu University, Jintan 213200, Jiangsu, China; 2. The Forth People’s Hospital of Changzhou, Changzhou 213000, Jiangsu, China)
Objective It is to observe the influence of rosuvastatin on nerve cell apoptosis and Caspase-3 expression of rats with cerebral ischemia reperfusion injury, and investigate the mechanism of neuroprotection. Methods The healthy male Wistar rats were randomly divided into sham operation group, model group and rosuvastatin group, the ischemia reperfusion injury rat model were made in model group and rosuvastatin group respectively. The brain tissue of rats were obtain after cerebral ischemia-reperfusion in 12 h, 24 h, and 72 h, and then the number of the apoptosis of neural cells and Caspase-3 positive cells were measured. Results Compared with the sham operation group, the number of nerve cell apoptosis and Caspase-3 positive cells of the model group and rosuvastatin group were increased significantly (P<0.01). Compared with the model group, rosuvastatin significantly reduced the number of Caspase-3 positive cells, there is significant statistically significant difference (P<0.01). Conclusion Rosuvastatin on cerebral ischemia reperfusion injury has neuroprotective effect, and the mechanism may be associated with the down-regulation of Caspase-3 expression, against cell apoptosis.
Rosuvastatin; cerebral ischemia reperfusion injury; neuronal apoptosis; Caspase-3
张俊华,男,副主任医师,主要从事神经内科临床和科研工作。
苏建华,E-mail:sjh2385225@163.com
金坛市科学技术局计划项目(JT2013064)
10.3969/j.issn.1008-8849.2015.12.002
R-332
A
1008-8849(2015)12-1257-04
2014-12-02
