金纳多注射液对脂多糖致急性肺损伤大鼠肺组织中核因子-κB表达的影响
2015-02-01刘子宸李永刚刘少斌张献彩
刘子宸,吴 棣,王 刚,李永刚,刘少斌,张献彩
(1.邢台医学高等专科学校解剖教研室;2.邢台市第三医院妇产科,河北 邢台 054000)
金纳多注射液对脂多糖致急性肺损伤大鼠肺组织中核因子-κB表达的影响
刘子宸1,吴棣2,王刚1,李永刚1,刘少斌1,张献彩1
(1.邢台医学高等专科学校解剖教研室;2.邢台市第三医院妇产科,河北 邢台054000)
摘要:目的探讨金纳多注射液对脂多糖致急性肺损伤(ALI)大鼠肺组织中核因子-κB(NF-κB)表达的影响。方法 采用随机法将24只Wistar大鼠分为3组:对照组(Control)、脂多糖组(LPS)和金纳多处理组(GBE)。采用尾静脉注射脂多糖(LPS)的方法建立急性肺损伤模型,光学显微镜下观察每组大鼠的肺组织病理学改变;检测血清中肿瘤坏死因子-αB(TNF-αB)和肺组织中核因子-κB(NF-κB)的表达变化。结果与对照组相比,脂多糖组大鼠血清中TNF-αB含量升高(P<0.05),肺组织中NF-κB表达增加(P<0.05);与脂多糖组相比,金纳多处理组大鼠血清中TNF-αB含量减少(P<0.05),肺组织中NF-κB表达减少(P<0.05)。结论 金纳多注射液可有效减轻ALI时肺组织的炎症反应,其机制可能与其降低大鼠体内TNF-α含量、减少NF-κB表达有关。
关键词:急性肺损伤;金纳多;脂多糖;肿瘤坏死因子-α;核因子-κB
急性肺损伤(acute lung injury,ALI)是指由心源性以外的各种肺内外致病因素所导致的肺泡上皮细胞及肺毛细血管内皮细胞屏障功能丧失,从而导致的缺氧性呼吸衰竭,是机体炎症反应失控导致的自身破坏性反应的结果。ALI时,大量富含蛋白的渗出液流入到肺泡腔,严重影响肺的换气功能,导致顽固性低氧血症和进行性呼吸衰竭,可诱发肺炎、胰腺炎、败血症等多种严重并发症,是临床常见的危急重症[1-5]。在众多病因中,重症感染为其原因之一,脂多糖(lipopolysaccharide,LPS)是革兰阴性菌细胞壁的主要成分,是引起感染性疾病的主要因素。ALI发病机制十分复杂,迄今为止尚未阐明,目前仍无有效的特异性的治疗方法[6-8]。研究发现:众多细胞因子和炎性介质参与了ALI的发生发展过程。肿瘤坏死因子-α(tumor necrosis factor,TNF-α)为ALI时的炎症启动因子,降低体内TNF-α的含量可显著缓解肺损伤;核因子-κB(NF-κB)的激活在ALI中起着关键作用,NF-κB受到脂多糖及炎性细胞因子刺激活化后可加重ALI时的肺部损伤,减少NF-κB的表达可有效抑制ALI时炎症反应,减轻肺组织的损伤程度[9-11]。
银杏是银杏科植物的一种,银杏叶主要为银杏干燥叶,其主要成分为萜内酯类、黄酮类、少量生物碱及多酚类化学物质。银杏叶提取物(GBE,金纳多)主要含有黄酮苷和银杏内酯等有效成分,具有清除自由基、抗脂质过氧化、保护血管内皮及改善微循环等作用,临床上多用来保护心脑血管、改善心肌缺血、缓解心绞痛、降低血清甘油三酯和低密度脂蛋白胆固醇的含量等。目前针对银杏叶提取物的研究大多数为其防治缺血再灌注损伤性疾病,但关于其防治ALI的研究较少[12-16]。因此,本实验采用尾静脉注射脂多糖(LPS)的方法复制大鼠ALI模型,旨在观察银杏叶提取物对ALI的作用,探讨其可能的对抗机制,为临床抗ALI的药物治疗提供一定的实验依据。
1材料与方法
1.1实验动物、所用试剂和仪器健康雄性SPF级Wistar大鼠24只,体质量210~240 g,由河北省实验动物中心提供,动物合格证编号:1308046。金纳多注射液(德国威玛舒培博士药厂,规格:每支5 mL,含GBE 17.5 mg,其中银杏黄酮苷4.2 mg);脂多糖(LPS,美国Sigma公司);TNF-α检测试剂盒(北京博奥森生物技术有限公司);NF-κB抗体及免疫组化试剂盒(武汉博士德生物工程有限公司);切片机(型号:RM2135,德国Leica公司);光学显微镜(日本Olympus公司);其他试剂为国产分析纯。
1.2 动物分组及ALI模型制备领取实验大鼠后,鼠笼内覆盖洁净垫料,给予充足的饲料和水,适应性饲养3 d。室内环境:温度24℃左右,相对湿度40%~60%。将24只大鼠随机分为3组:对照组(Control)、脂多糖组(LPS)和金纳多处理组(GBE)。对照组每只大鼠于尾静脉注射0.9%氯化钠溶液,注射剂量为0.1 mL·kg-1;脂多糖组每只大鼠于尾静脉注射LPS,注射剂量为0.1 mL·kg-1(浓度为50 g·L-1);金纳多处理组每只大鼠于尾静脉注射LPS,注射剂量为0.1 mL·kg-1(浓度为50 g·L-1),并于注射LPS前30 min腹腔注射金纳多,注射剂量为50 mg·kg-1。所有大鼠于注射相应溶液3 h后处死取材。
1.3肺组织病理形态学观察大鼠经10%水合氯醛(使用剂量为3 mL·kg-1)麻醉后,迅速打开胸腔,取部分右肺下叶组织,常规甲醛固定、乙醇梯度脱水(70%、90%乙醇各60 min→95%乙醇Ⅰ过夜、95%乙醇Ⅱ 30 min→100%乙醇Ⅰ、 Ⅱ各60 min)、二甲苯透明(二甲苯Ⅰ、Ⅱ各20 min)、石蜡包埋(石蜡Ⅰ 30 min、 石蜡Ⅱ 2.5 h)、切片(厚度5 μm),行普通HE染色,光学显微镜下观察肺组织病理学改变。
1.4血清中TNF-α含量的检测大鼠经腹主动脉采血,离心(4℃,2 000 r·min-1)10 min后取上清。采用酶联免疫吸附法(ELISA法)测定血清中TNF-α(ng·L-1)的浓度变化。严格按照试剂盒说明书操作。
1.5免疫组织化学染色技术观察肺组织中NF-κB的表达变化常规石蜡包埋切片,脱蜡水化,经0.01 mol·L-1PBS清洗→3 %甲醇—过氧化氢,室温下孵育15 min→0.01 mol·L-1PBS清洗→0.1 mol·L-1枸橼酸钠缓冲液(pH 6.0),微波抗原修复,98℃ 15 min→冷却至室温后0.01 mol·L-1PBS清洗→正常山羊血清孵育,37℃ 30 min→滴加一抗(1 ∶100),37℃下1.5 h →0.01 mol·L-1PBS清洗→加入生物素标记的二抗及辣根过氧化物酶标记的链酶卵白素→0.01 mol·L-1PBS清洗→DAB显色→梯度乙醇脱水、二甲苯透明、中性树胶封片。光镜下观察,以细胞浆或细胞核中出现棕黄色颗粒为阳性信号。为了排除非特异性染色,在阴性对照实验中,用PBS代替一抗或者二抗后,未见阳性染色。每组随机选取5张切片,每张切片随机选取5个不重叠的视野,光学显微镜下进行观察,应用图像分析系统软件进行平均吸光度(OD值)的测量,以平均OD值代表该张切片NF-κB的表达水平。
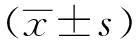
2结果
2.1肺组织形态学观察Control组大鼠肺组织结构完整、清晰,肺泡隔壁薄光滑,均匀一致,肺泡腔内无渗出液;LPS组肺间质大量炎细胞浸润,肺泡腔内大量红细胞;GBE组肺组织炎细胞浸润及肺泡腔出血减少,肺损伤程度减轻,见图1。
Control组LPS组GBE组
图1各组大鼠肺组织病理形态学改变(HE×400)
2.2血清中TNF-α含量检测与Control组相比,LPS组肺组织中TNF-α含量显著升高(P<0.05),与LPS组相比,GBE组TNF-α含量明显降低(P<0.05),但仍高于Control组(P<0.05),见表1。
2.3肺组织中NF-κB免疫组织化学染色结果Control组肺组织NF-κB表达的棕黄色阳性信号较弱;LPS组NF-κB阳性信号明显增强(P<0.05),胞核与胞浆均呈阳性表达;GBE组NF-κB阳性信号减弱,阳性表达的胞核显著减少(P<0.05,见表1,图2)。
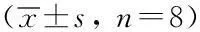
表1 TNF-α含量及NF-κB表达检测结果
注:与Control组相比*P<0.05;与LPS组相比#P<0.05。
Control组 LPS组GBE组
图2各组大鼠肺组织NF-κB表达结果 (×400)
3讨论
急性肺损伤(acute lung injury, ALI)是由感染、创伤、休克、酸中毒等原因引起的机体过度炎症反应并导致弥漫性肺实质损伤,其特征性病理改变是肺实质炎症反应所导致的弥漫性肺泡上皮和肺微血管内皮的严重损伤。ALI严重阶段称为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),是临床重症监护患者主要的死亡原因,病死率达到30%~50%。ALI时,肺泡上皮细胞及毛细血管内皮细胞损伤,导致弥漫性肺间质及肺泡水肿,肺顺应性降低、通气/血流比例失调,临床上表现为进行性低氧血症和呼吸窘迫。ALI不仅是单纯意义上的肺部疾病,而是一种全身系统性疾病的肺部表现,是机体严重炎症反复的结果,调控炎症反应可以防止ALI的发生发展,降低死亡率。ALI的发病包括氧化损伤、中性粒细胞的活化、促炎细胞因子的大量释放等多种机制,最终产生炎性“瀑布”样反应,目前专家们对其发病机制尚未完全进行阐释[17-22]。本实验通过大鼠静脉注射LPS建立ALI模型,20 min后大鼠精神萎靡,反应迟钝,毛发耸立,呼吸急促,摄食饮水极少。病理学检查发现:注射LPS后大鼠肺泡壁大量炎细胞浸润、肺泡腔出血,提示成功复制了ALI模型;应用金纳多注射液后,以上病理改变有效缓解,说明金纳多注射液可有效对抗ALI时肺组织的炎症反应。
研究发现TNF-α主要由被激活的巨噬细胞产生,是机体遭受感染或创伤后最早产生的促炎性细胞因子之一,是ALI发生和发展的始动因素。TNF-α能够诱导IL-1、IL-6、IL-8等炎症因子的分泌,促发炎症反应,其水平可反应ARDS患者肺部损伤的严重程度。TNF-α对肺有强烈的毒性,能诱导肺内皮细胞活化、白细胞迁移、中性粒细胞脱颗粒和毛细血管渗漏,肺泡内积聚的水肿液进一步阻碍肺泡细胞的血流灌注和氧气交换,加重低氧血症。TNF-α能增加白细胞表面的黏附分子,使淋巴细胞功能相关抗原-1(LFA-1)增加,巨噬细胞抗原-1(MAC-1)增加;通过检测ARDS病人和对照组的血清TNF-α含量发现:ARDS患者TNF-α明显升高,且与肺损伤程度密切相关;通过减少TNF-α的水平,有利于减轻ALI时的炎症反应[23-25]。本实验显示: LPS组较Control组大鼠血清中TNF-α含量增加(P<0.05),证实TNF-α及NF-κB参与了ALI进程;应用金纳多处理后,血清中TNF-α含量降低(P<0.05),提示金纳多可有效降低TNF-α含量,抑制炎症反应。
NF-κB是一类能与多种细胞因子及黏附分子基因启动子部位的κB位点发生结合并增强基因转录的蛋白质,是炎症病理过程中多种炎性介质表达调控的关键转录因子,在启动、放大和延续炎症反应过程中起中枢性调控作用。当细胞受到氧化、应激等因素的刺激后,NF-κB在细胞核内与DNA特定序列结合,调节炎性细胞因子、细胞增殖等基因的转录,参与体液免疫、固有免疫、炎症调节等,在ALI的发生发展过程中发挥着重要的作用。未受刺激时,NF-κB处于未活化状态,其与抑制蛋白IκB结合在一起;当受到LPS等刺激时,IκB发生磷酸化和降解,NF-IκB与IκB解离,获得自由的NF-IκB迅速从细胞质移位到细胞核,与基因上κB位点发生特异性结合,从而促进有关基因的转录。研究发现,NF-κB调节的靶基因蛋白包括细胞因子(IL-1、IL-2、IL-3、IL-6)、趋化因子(IL-8、巨噬细胞趋化蛋白-1、巨噬细胞炎性蛋白-1A)、黏附分子(ICAM-1、VCAM-1)等。实验表明:内毒素导致,TNF-α等血清促炎细胞因子水平的升高,单核细胞或外周单核细胞及肺泡巨噬细胞NF-κB活性的增强。内毒素进入机体后,可激活NF-κB核易位启动TNF-α表达,释放的TNF-α与LPS进一步激活效应细胞的NF-κB活化,进而启动其他细胞因子和黏附分子的炎症分子的表达,抑制NF-κB的激活可有效降低肺损伤的发生[26-30]。本实验显示: LPS组较Control组大鼠肺组织NF-κB表达增多(P<0.05),证实NF-κB参与了ALI进程;应用金纳多处理后,肺组织NF-κB表达减少(P<0.05),提示金纳多可有效抑制NF-κB表达,保护肺组织。
综上所述,金纳多可能通过降低TNF-α的含量、抑制NF-κB的表达发挥对ALI时肺组织的保护作用。
参考文献:
[1]罗康.脂多糖诱导大鼠急性肺损伤的机制研究进展[J].临床合理用药,2014,7(2):166-167.
[2]郭海峰,岳辉,李铁灵.p38MAPK抑制剂对重症胰腺炎大鼠急性肺损伤的保护作用[J]. 安徽医药,2014,18(6):1304-1307.
[3]杜成,孙思庆,王润丰,等.瑞芬太尼对兔油酸性急性肺损伤的影响[J].东南大学学报(医学版),2015,34(1):40-43.
[4]Matthay MA,Zemans RL.The acute respiratory distress syndrome:pathogenesis and treatment[J].Annu Rev Pathol,2011,6:147-163.
[5]曹征,朱健,陆平,等.HSP70与TLR-NF-κB信号途径在急性肺损伤大鼠发病机制中作用的实验研究[J].临床与病理杂志,2015,35(3):406-411.
[6]金发光.急性肺损伤的诊治研究现状及进展[J/CD].中华肺部疾病杂志(电子版),2013,6(1):1-3.
[7]张建初,白明,吴研雯,等.吸入一氧化氮对急性肺损伤大鼠肺组织炎症的影响[J].中国呼吸与危重监护杂志,2010,9(2):150-153.
[8]范玉丽,盛净,朱健,等.L-精氨酸对大鼠脂多糖致急性肺损伤的影响及机理[J].临床与病理杂志,2015,35(4):642-647.
[9]吴春艳,张智,刘子宸.葛根素对油酸致急性肺损伤大鼠的保护作用研究[J].中国医药,2013,8(12):1700-1702.
[10] 李君,王阳,胡孔友,等.PDTC对大鼠急性肺损伤肿瘤坏死因子-αB表达的影响[J].辽宁医学院学报,2013,34(4):1-3.
[11] 张智,高磊,丁春华,等.褪黑素对油酸致大鼠急性肺损伤的防护作用及其机制研究[J].中国应用生理学杂志,2011,27(4):480-483.
[12] 李静玲,林小凤,冯鹏,等.银杏叶提取物保护心肌缺血再灌注损伤的研究进展[J].临床合理用药,2013,6(9):180-181.
[13] 宋文秀,卢飞艳,王艳萍,等.银杏叶对新生鼠缺氧缺血性脑损伤后Nestin蛋白表达的影响[J].中国中医基础医学杂志,2014,20(12):1635-1636.
[14] 郑晓铸,刘凯,夏燕飞,等.银杏叶提取物在体外循环心内直视手术中对心肌缺血再灌注损伤的保护作用[J].中国现代医生,2010(28):26-27.
[15] 秦智刚,艾玲,罗爱林,等.右美托咪定对体外循环下心肌缺血再灌注损伤的保护效应[J].华中科技大学学报(医学版),2013,42(5):551-554.
[16] 邓永超,刘煜敏.银杏叶提取物后处理对大鼠局灶性脑缺血再灌注损伤保护作用的研究[J].卒中与神经疾病,2014,21(4):219-221.
[17] 张彦芬,唐思文,王海荣,等.连花清瘟胶囊对急性肺损伤小鼠炎症因子的影响[J].食品与药品,2015,17(2):96-99.
[18] 刘海林,钱燕宁.丙泊酚联合乌司他丁对内毒素所致大鼠急性肺损伤的保护作用[J].中国应用生理学杂志,2013,29(1):56-62.
[19] 龚艺,赖晓霏.IL-27在小鼠CLP-急性肺损伤模型中的作用[J].免疫学杂志,2015,31(6):467-475.
[20] 赵刚,赵玉莲,胡海.大量维生素C辅助金纳多对小鼠急性肺损伤的保护作用[J].包头医学院学报,2015,31(4):8-12.
[21] 张荣,彭单伊,夏耘秋,等.脂多糖诱导急性肺损伤小鼠中E-cadherin和Brg1的表达及意义[J].免疫学杂志,2015,31(5):391-395.
[22] 戴丽,端莉梅,姚志清.木犀草素对脂多糖诱导下的小鼠急性肺损伤的保护作用及其机制研究[J].河北医药,2015,37(3):339-342.
[23] 陈宇清,荣令,周新.三七总皂苷对急性肺损伤大鼠血清和支气管肺泡灌洗液肿瘤坏死因子α、白介素6和白介素10水平的影响[J].实用心脑肺血管病杂志,2013,21(2):89-92.
[24] 姜远旭,徐世元,张雪萍,等.右美托咪定联合乌司他丁减轻脂多糖诱导的大鼠急性肺损伤[J].中国病理生理杂志,2014,30(1):96-101.
[25] 徐永芳,陈刚,徐长青,等.穿心莲内酯对内毒素诱导急性肺损伤大鼠炎症介质的影响[J].中华中医药学刊,2015,33(1):159-161.
[26] 石计朋,闫建国,韩金芬,等.ω-3PUFAs对LPS诱导急性肺损伤大鼠前炎症因子TNF-αB、IL-1β、IL-6的影响[J].中国儿童保健杂志,2014,22(1):35-40.
[27] Akira S,Takeda K.Toll-like receptor signalling[J].Nat Rev Immunol,2004,4(7):499-511.
[28] 李锦师,白建文.Toll受体与急性肺损伤研究进展[J].上海交通大学学报(医学版),2007,27(7):894-897.
[29] 常秀娟,张帅,江益平,等.从细胞因子风暴探讨热毒宁注射液抗大鼠急性肺损伤作用机制[J].中草药,2015,46(2):236-239.
[30] 白静慧,朱相宇,郑丽媛,等.槲皮素对脓毒症急性肺损伤大鼠肺组织NF-κB表达的影响[J].解剖科学进展,2014,20(1):31-34.
基金项目:邢台市科学技术研究发展计划自筹经费项目(No 2013ZC179)
通信作者:张献彩,女,副教授,研究方向:糖尿病消化系统症状的研究,E-mail:zhangxiancai2004@163.com
doi:10.3969/j.issn.1009-6469.2015.12.011
(收稿日期:2015-07-29,修回日期:2015-09-07)
Effect of Ginaton injection on the expression of NF-κB
in rats with acute lung injury induced by LPS
LIU Zi-Chen1, WU Di2,WANG Gang1,et al
(1.XingtaiMedicalCollege;2.TheThirdHospitalofXingtai,Xingtai,Hebei054000,China)
Abstract:Objective To explore the effect of Ginaton injection on the expression of NF-κB in rats with acute lung injury. Methods Twenty-four male Wistar rats were randomized into three groups:control group, LPS group and GBE group. Model of acute lung injury was established by tail-vein injection with LPS. Morphological changes of lung tissues were observed under light microscope. The content of TNF-α in serum and the expression of NF-κB in lung tissues were detected in each group. Results Compared with control group, the content of TNF-α in serum increased (P<0.05) and the expression of NF-κB in lung tissues increased (P<0.05) in LPS group; Compared with LPS group, the content of TNF-α in serum decreased (P<0.05) and the expression of NF-κB in lung tissues decreased (P<0.05) in GBE group. Conclusion Ginaton injection could reduce inflammation reaction in lung tissues during ALI, the mechanism of which was probably related to the decrease in the content of TNF-α and the expression of NF-κB.
Key words:acute lung injury;ginaton;LPS;TNF-α;NF-κB
