多肽介导的核酸药物递送系统研究进展
2015-02-01丁晓然王升启
丁晓然,王升启
(军事医学科学院放射与辐射医学研究所,北京 100850)
多肽介导的核酸药物递送系统研究进展
丁晓然,王升启*
(军事医学科学院放射与辐射医学研究所,北京 100850)
核酸药物作为新型基因治疗药物备受关注,但生物学稳定性差、易被体内核酸酶降解、生物利用度低、靶组织内聚集浓度低等是制约其发展的主要因素。新的药物递送技术的快速发展在一定程度上解决了核酸药物的稳定性及靶向递送问题,极大地推动了核酸药物的研发进展。尤其是多肽蛋白类递送载体,已成为核酸药物递送系统研究领域的热点之一。介绍核酸药物递送载体多肽修饰的两种主要方式——共价缀合和非共价络合,重点综述近年来多肽缀合物和复合物以及多肽修饰的载体在核酸药物递送系统中的应用研究,探讨多肽介导的核酸药物递送系统在应用中存在的问题,为新型核酸药物递送系统研发提供参考。
多肽载体;核酸药物;药物递送系统
核酸药物(nucleic acid drug)是目前国际上重点关注的一类新型生物技术药物,具有设计方便、特异性强、不易产生耐药、利于快速反应等特点,可用于治疗病毒感染性疾病、心血管系统疾病、代谢类疾病以及肿瘤等多种疾病[1]。自1998年第1个核酸类药物VitraveneTM被美国FDA批准上市后,多个核酸药物相继进入临床试验[2-3]。然而,核酸药物存在生物学稳定性差、易被体内核酸酶降解、生物利用度低、靶组织内聚集浓度低等缺点,其临床应用进展缓慢。近年来,天然核酸药物的化学修饰(如硫代修饰、混合骨架核酸等)、新型核酸类似物(如肽核酸)等可提高核酸药物稳定性的新技术以及核酸药物靶向递送技术的快速发展,极大地推动了核酸药物的研发进展。2013年1月29日,在时隔15年之后,第3个也是首个全身给药的核酸药物KynamroTM被美国FDA批准上市,掀起了新一轮核酸药物研究热潮。
利用载体技术和给药体系提高核酸药物生物学活性,改善其体内分布,增强其对细胞的靶向性以及被细胞摄取能力,提高靶组织中药物的浓度和生物利用度,是核酸药物研发的重点和趋势所在。目前最为常见的核酸药物递送载体主要有以下几类:脂质体(如普通阳离子脂质双层、脂质体DOTAP、Lipofectine、pH敏感脂质体等)、阳离子多聚复合物[如聚乙烯亚胺(PEI)、聚酰胺-胺(PAMAM)等]、树枝状高聚物(DEN)和各类多聚物的微粒体(如聚氰基丙烯酸酯纳米粒、聚乳酸纳米粒等)、基于特异性受体的配体介导的核酸分子靶向递送系统和多肽蛋白类递送载体以及利用唾液酸蛋白、多糖、表皮生长因子、叶酸、转铁蛋白、甾体激素、单克隆抗体等靶向分子修饰而具有主动靶向作用的纳米粒[4-5]。随着新载体技术和给药体系的不断发展,一些核酸药物研发公司相继构建了各具特色的递送技术平台,其中具有代表性的核酸药物递送系统包括Arrowhead Research公司的动态多价偶联递送系统(dynamic polyconjugates,DPC)[6]和转铁蛋白靶向的环糊精纳米粒递送系统(RONDELTM)[7]、Silence公司基于脂质的siRNA递送系统(AtuPLEXTM)[8]、Tekmira公司的脂质纳米粒(LNP)技术[9]以及Alnylam Pharmaceuticals公司的GalNAc-siRNA(N-乙酰半乳糖胺与siRNA的结合体)肝靶向递送系统[10]等。基于上述递送系统,已有多个核酸药物相继进入临床研究阶段(见表1),并有多个相关药物处于申报临床研究或临床前研究的不同阶段。
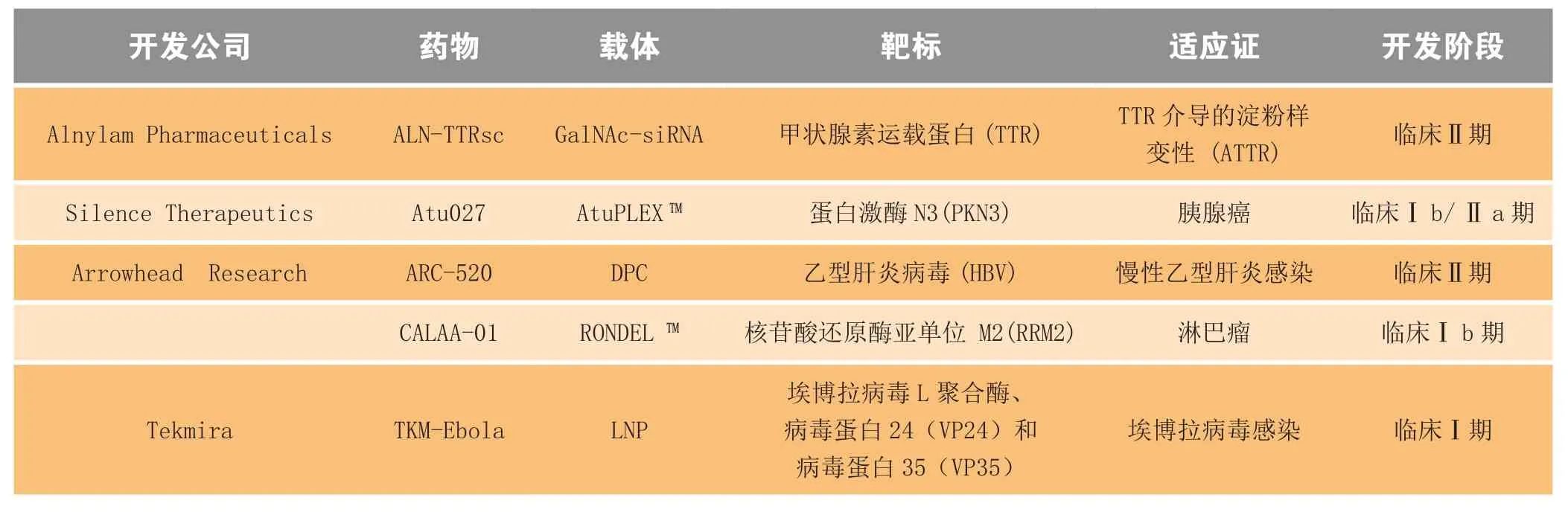
表1 基于新型递送系统的临床在研核酸药物Table1 Nucleic acid drugs based on the new delivery system in clinical development
在众多靶向递送技术当中,多肽蛋白类递送载体是目前研究的热点之一。其中较为简单的一种递送系统是以阳离子肽即细胞穿膜肽(cell-penetrating peptides,CPP)或蛋白转导域(protein transduction domains,PTD)为递送载体,而CPP不仅可用来提高核酸药物的细胞摄取率,还能靶向特定细胞表面受体或组织。自1994年第1条CPP被Fawell等发现以来,一系列新的CPP相继被报道。目前,尽管多肽介导的核酸药物转运机制尚未完全阐明,但该递送载体发展迅速,已经成为核酸药物研发的重点领域[11-12]。
1 核酸药物递送载体的多肽修饰策略
核酸药物递送载体的多肽修饰主要采用共价缀合和非共价络合两种方式。
1.1 共价缀合
共价缀合是通过二硫键、硫醚键、硫醇马来酰亚胺、磷酸二酯键等共价键而将多肽共价缀合到寡核苷酸分子或其他载体上[13],这种缀合可经固相合成法或液相合成法完成,通常反应效率较高。连接多肽与寡核苷酸分子的连接臂需要具有一定的化学稳定性,从而使肽-寡核苷酸缀合物在进入体内和随后的转运过程中保持稳定,而在靶细胞中连接臂可被特定蛋白水解酶降解,从而释放核酸药物。例如,二硫键已被证明可用于多肽介导的核酸药物递送系统[14]。研究发现,二硫键在缀合物到达内涵体或细胞质后才会断裂,这种断裂使多肽不会在细胞内影响寡核苷酸分子对其靶标的抑制作用。但最近的体内实验结果表明,这种断裂不是必须的。二硫键以及巯基可能会增加核酸药物的胞内摄取率,其作用机制尚不清楚[15-16]。
共价缀合的优点在于可以得到结构明确、单一的化合物,简化了药物研发过程。但这种修饰方法也存在一定的局限性,如强阳离子多肽与带负电荷的寡核苷酸缀合和纯化存在一定的难度,限制了用于缀合的多肽类型;此外,共价键修饰可能会影响带电荷核酸分子的生物活性。因此,这种策略更适用于中性的磷酸二酰胺吗啉代寡核苷酸(phosphorodiamidate morpholinooligomers,PMO)(Summerton等, Antisense Nucleic Acid Drug Dev, 1997年)和肽核酸(peptide nucleic acids,PNA)的修饰(Nielsen, Methods Enzymol, 1996年)。
1.2 非共价络合
非共价络合是通过非共价键将多肽及其衍生物与带负电荷的寡核苷酸分子络合,形成复合物。一些肽载体含有疏水性基团(如疏水性氨基酸及脂肪酸、胆固醇等),这些疏水性基团可与中性及带负电荷的分子络合形成复合物,这种络合形成的复合物能够更好地携带寡核苷酸分子透过质膜,将其高效地递送至靶部位[17]。非共价键连接时,不需要对寡核苷酸进行末端修饰,仅通过简单的混合即可形成复合物,同时这种方法还能有效防止核酸酶对寡核苷酸的降解,因此该方法应用更为广泛。
近年来,随着递送技术的不断发展,还有多种修饰策略相继被提出。如Futaki等采用新一代非共价结合化学修饰多肽载体技术,将十八烷酰基化的阳离子多聚精氨酸肽用作质粒DNA的转运载体获得成功[18]。而且,一些肽相关纳米载体、阳离子聚合物以及多肽复合体/脂质体等也被用于寡核苷酸递送研究。
2 多肽缀合物和复合物在核酸药物递送系统中的应用
20世 纪90年 代Bongartz等(Nucleic Acids Res, 1994年)首次报道了多肽介导的反义核酸在细胞内的递送过程,即将CPP通过与反义核酸共价连接形成缀合物,介导核酸进入细胞。这一方法随后被广泛用于PNA、PMO、不同修饰的反义核酸以及siRNA等核酸药物的修饰。Pooga及其研究团队在体内外实验中发现,CPP与靶向甘丙肽受体Ⅰ型mRNA的PNA共价缀合后,可有效地提高PNA在人黑色素瘤细胞中的摄取率;多肽共价修饰可提高PNA对体内甘丙肽受体的抑制作用(Pooga等, Nat Biotechnol, 1998年)。另有研究人员将F-3肽与经不同化学修饰的反义核酸共价缀合后发现,这种共价缀合可显著提高核酸药物在体内对转录因子ld1的抑制作用[19]。Meng等[20]经实验研究发现,将Tat(47-57)肽与siRNA缀合后,可有效介导siRNA进入细胞。南方医科大学的季爱民教授及其研究团队将可特异性结合整合素αvβ3受体的环肽cRGD与靶向血管内皮生长因子受体2(VEGFR2)的siRNA分子进行共价缀合后发现,cRGD-VEGFR2 siRNA可特异性进入整合素αvβ3受体阳性的新生血管内皮细胞——人脐静脉血管内皮细胞(HUVEC),并抑制VEGFR2表达;cRGD-VEGFR2 siRNA显微注射入斑马鱼体内后,能够抑制斑马鱼新生血管的形成;在小鼠体内实验中,cRGD-VEGFR2 siRNA不会诱导先天的免疫反应,且可特异性靶向肿瘤组织,具有显著的抗肿瘤作用[21]。
CPP与PMO的缀合物PPMO近年来被广泛应用于抗病毒、抗细菌以及治疗遗传性疾病等领域。PMO最早由AVI生物制药公司(现更名为Sarepta Therapeutics公司)开发[22],具有诸多优点,如不被酶降解、在细胞内稳定性强、对细胞无毒副作用、且不会激活细胞分泌干扰素及免疫应答等。但是,由于PMO的分子结构中不带有任何电荷,使其无法被细胞表面受体识别,也无法通过转染方式导入细胞内,极大地阻碍了其实际应用。而PPMO技术的发展则有力地推进了PMO的应用研究,研究人员利用该递送技术确证了PMO在多种病毒感染性疾病中均具有较好的抗病毒作用,如卡波济肉瘤相关疱疹病毒、单纯疱疹病毒、日本脑炎病毒、麻疹病毒、登革热病毒、柯萨奇病毒、埃博拉病毒、马尔堡病毒、西尼罗河病毒以及冠状病毒等[23]。另外,有研究表明,相应的多肽-PMO缀合物可干扰血凝素激活蛋白酶TMPRSS2 pre-mRNA的剪接,有效降低甲型流感病毒的滴度[24]。在人呼吸道合胞病毒感染的细胞和小鼠模型中,相应的多肽-PMO缀合物均可有效阻断病毒复制;且在感染早期给药,可显著降低小鼠肺组织的病毒滴度[25]。另有研究表明,对于感染猪生殖和呼吸综合征病毒的猪,无论是感染前还是感染后给予相应的多肽-PMO缀合物治疗均可有效降低病毒血症和间质性肺炎的发生[26]。
在抗细菌感染方面,Sarepta公司与其合作者近期研究发现,靶向金葡菌促旋酶A mRNA的PPMO在动物体内显示出良好的抗菌作用,其可特异性结合靶基因,抑制细菌蛋白质表达,还可避免传统抗生素的耐药问题。目前,该公司的这一抗菌新药正处于临床前研发阶段。PPMO抗菌剂的开发将为细菌感染性疾病提供新的治疗策略[27]。另外,Sarepta公司一直致力于遗传性疾病——杜氏肌肉萎缩症(Duchenne muscular dystrophy, DMD)治疗药物的开发,PPMO技术也被证实可提高PMO对DMD的治疗效果[28-29]。尽管PMO的安全性已经得到证实,但是PPMO技术引入缀合肽链后,其安全性有待进一步评价。
3 多肽修饰的载体在核酸药物递送系统中的应用
核酸递送载体修饰策略的另一方向是利用合成或天然的阳离子多聚复合物作为核酸分子的递送载体,这些线性或分枝状的多聚复合物主要包括聚-L-赖氨酸(PLL)、PEI等。这些多聚复合物可将寡核苷酸聚集成小颗粒(DNA复合物),通过内吞作用使核酸分子进入细胞。但是,PEI等阳离子聚合物的非生物降解特性使得其潜在的安全性问题备受关注[30];另外,PEI会与血清中的一些蛋白相互作用,导致其体内递送效率降低[31]。研究人员尝试用聚乙二醇(PEG)修饰PEI聚合物以提高其在血清中的稳定性,但实验显示,这种修饰方法并没有显著增加核酸的细胞摄取率以及胞内释放[32]。而进一步利用多肽修饰这类阳离子聚合物,则能提高核酸分子的组织靶向性、细胞透膜率以及生物活性。研究人员发现,将Tat肽与PEG化PEI形成的共聚物和2′-Ome修饰寡核苷酸混合并给予mdx小鼠后,能改善抗肌肉萎缩蛋白pre-mRNA的外显子跨读(exon-skipping)[33]。Schiffelers等[34]将整合素结合肽RGD修饰的PEG化PEI用于靶向VEGFR-siRNA的转运,获得成功。而将转铁蛋白多肽修饰PEG化PEI后,也能将siRNA高效特异性地转运至神经细胞瘤移植模型的肿瘤细胞中[35]。此外,借助叶酸与其受体的特异性相互作用,叶酸-PEG-siRNA与固定结构聚阳离子复合物可沉默目标基因[36]。浙江大学的梁文权研究团队近期还报道了一种CPP修饰的甘露糖基化PEI衍生物(Man-PEI1800-CPP),并将其成功用于DNA分子的体内递送[37]。
多肽分子与LNP结合而形成的复合物是核酸药物的另一递送载体。目前常用的阳离子脂质体存在着与血清蛋白非特异性结合以及毒性等问题,只能用于寡核苷酸分子的体外转染,并不适用于体内递送,如lipofectin或lipofectamine等。采用亲水聚合物(如PEG等)对脂质体表面进行功能化修饰,则能将其改造为核酸分子的体内递送载体[38]。但PEG修饰后的脂质体载体与细胞膜的相互作用减弱,降低了核酸分子的细胞摄取率,且修饰后的载体还不利于核酸分子的胞内释放[39]。为了提高脂质体载体的核酸递送效率,研究人员在新的脂质体载体中引入了多肽分子。当富含精氨酸的CPP结合到脂质体载体表面后,可显著提高载体的递送效率[38],且安全性可控[40]。另一组研究人员将阳离子脂质体用含16个赖氨酸残基和靶向肽Y的嵌合肽进行修饰后,成功用于递送靶向荧光素酶等目标基因的siRNA[41]。
多功能信封式纳米装置(multifunctional envelopetype nanodevices, MEND)是由Harashima和Futaki团队研发的一种基于脂质体的核酸分子胞内递送载体系统[42]。该系统将寡核苷酸与多聚阳离子鱼精蛋白聚合后用一种含阴阳离子和辅助脂质[如二油酰磷脂酰乙醇胺(DOPE)]的脂质信封包裹,其中辅助脂质DOPE的作用是增加核酸分子的胞内释放。除了表面修饰PEG外,该系统还可利用十八烷基化肽自发插入脂质膜的特点将多肽结合到脂质体表面。为了增加核酸分子递送过程中的靶向性以及胞内释放,此研究团队在新型MEND系统中引入了可断裂的PEG连接键以及靶向特定受体的多肽或融合肽,并利用此载体将未修饰的反义寡核苷酸和siRNA递送入细胞内[43]。MEND系统已被报道成功用于siRNA对肿瘤组织的靶向递送[44]。
由于多数递送载体都会引发机体免疫反应或全身性毒性,因此有研究人员提出另一种生物衍生递送载体——外泌体。外泌体是由大多数细胞和体液分泌而自然产生的膜囊泡,能携带多种蛋白质、mRNA和miRNA,参与细胞通讯和迁移、血管新生、肿瘤发生发展等生理过程。这种外泌体是从内体-溶酶体途径衍生而来,直径40~120 nm,在转运RNA至靶细胞的过程中发挥着重要作用[45],同时它还具备将miRNA转运至靶细胞并诱导基因沉默的能力[46]。因此,外泌体适合作为核酸分子递送载体。Alvarez-Erviti等[47]利用外泌体成功将外源性siRNA转运至小鼠大脑,其间,选用的外泌体来源于未成熟的树突状细胞,并将表达脑靶向肽RVG的质粒转染至树突状细胞,使RVG与外泌体表面结合,以增强外泌体的脑靶向性;随后借助电穿孔技术导入靶向目的基因的siRNA,再将此RVG-外泌体系统给小鼠静注,致使所载siRNA靶向递送至小鼠大脑,特异性敲除小鼠大脑皮质和纹状体组织中的目的基因。为进一步验证这种RVG-外泌体系统的递送能力,在小鼠实验中,该系统还被用于递送靶向β-分泌酶的siRNA,结果,在小鼠大脑皮质中可观察到靶基因显著被抑制,胞外β淀粉样蛋白1-42(Aβ1-42)的蓄积减少,而值得注意的是,RVG-外泌体递送系统重复给药后,并没有观察到明显的毒性或免疫原性反应。
4 多肽介导的核酸药物递送系统在应用中存在的问题
大量研究表明,多肽载体在体内外均具有良好的递送效果,但其脱靶效应、体内分布、不同给药途径对分布的影响以及毒副作用还有待进一步考察。
肽类载体的体内分布数据可以通过评价其诱导的生物学效应、检测直接标记的递送载体、使用转基因动物及报告基因系统等方法来获取,但这些方法各自都有一定的局限性。比如,肽类载体诱导的生物学效应检测只能局限在表达靶基因的组织中开展,不表达靶基因的组织中检测不到相应生物学效应的改变;荧光分子或放射性同位素虽然已成功应用于标记和示踪肽类载体[48],但载体-核酸分子存在血清稳定性等问题,只对肽类载体进行标记并不能真实反映核酸分子的分布情况[49];EGFP-654转基因小鼠模型可被用来检测PPMO的体内分布,但是该模型无法反应PPMO对疾病病理过程的影响[50]。
为了优化药物分布模式,获得合理的安全曲线,需要对肽类载体的给药途径(静脉、腹腔、皮下、口服或鼻腔等)作进一步考察[51]。给药方式的选择不仅要考虑多肽的性质和疾病模型的靶向需求,还应充分考虑肽类载体的毒理学特征。目前直接比较不同给药途径间肽类载体递送效率的报道较少,Fucharoen研究小组在对PPMO缀合物的研究过程中发现该载体系统静脉注射的递送效率优于皮下注射[50]。
虽然肽类载体对核酸药物的递送作用已被多项研究证实,但对其所致毒性和免疫刺激性缺乏系统性研究。已有研究显示,Penetratin-siRNA缀合物气管内给药可诱发先天免疫反应[52],而其腹腔内给药则不会引起免疫反应,在小鼠模型实验中,其100 mg·kg-1腹腔内给药表现出良好的耐受性[53]。尽管CPP具有潜在的免疫刺激性,但其与PMO的缀合物在动物体内并未观察到有明显的免疫刺激性[54],且肽-PNA复合物也未见报道会诱导免疫反应。
由于PMO不带有任何电荷,毒副作用低,在动物体内及临床试验中具有良好的安全性[55],因此引入的多肽序列和临床使用剂量对于PPMO缀合物的安全性评价至关重要。Amantana等[56]在大鼠体内合理评价了可抑制c-myc表达的PPMO缀合物的安全性,结果显示,低剂量(15 mg·kg-1)时,PPMO具有良好的耐受性;但在高剂量(150 mg·kg-1)组中,大鼠出现了如嗜睡、体质量下降、血尿素氮和血清肌酐升高等现象;致死剂量为400 mg·kg-1。AVI生物制药公司发表的PPMO缀合物在非人灵长类动物模型中的安全性评价报告显示,健康猕猴以9 mg·kg-1剂量静注PPMO(每周1次,共4次)后,出现剂量依赖的肾脏肾小管变性;而mdx小鼠接受更高剂量PPMO给药后,并没有观察到明显的毒副作用[57]。提示,PPMO在不同物种中毒性阈值存在显著差异。类似地,一种缀合了含有赖氨酸、亮氨酸、丙氨酸残基两亲肽的PNA也表现出严重的肾毒性,健康小鼠接受其40 mg·kg-1剂量全身给药后,出现深度近端肾小管坏死,而在相同剂量条件下,PNA与含有精氨酸或精氨酸残基的两亲肽的缀合物却没有显现相同毒性[58]。
5 结语与展望
多肽介导的核酸药物递送系统能显著提高药物的透膜性和靶向性,减少其毒副作用,增强疗效,在药物靶向递送系统中具有广阔的应用前景。目前,Sarepta公司基于PPMO递送技术而开发的用于治疗结核杆菌感染的PMO药物正处临床前研发阶段。加拿大BiOasis生物技术公司最新研发的多肽载体Transcendpep经实验证实能有效递送siRNA跨越血脑屏障进入脑细胞,特异性抑制靶基因,该项目已进入临床研究申报阶段。可以预见,在不久的将来,会有更多基于多肽递送载体的核酸新药品种有望进入临床研究。
不过,肽类载体的制备工艺、脱靶效应及毒副作用是其在核酸药物递送系统应用研究领域中亟需解决的问题。
[1]Kurreck J.Antisense technologies.Improvement through novel chemical modifcations[J].Eur J Biochem, 2003, 270(8): 1628-1644.
[2]Rayburn E R, Zhang R.Antisense, RNAi, and gene silencing strategies for therapy: mission possible or impossible?[J].Drug Discov Today, 2008, 13(11/12): 513-521.
[3]Ricotta D N, Frishman W.Mipomersen: a safe and effective antisense therapy adjunct to statins in patients with hypercholesterolemia[J].Cardiol Rev, 2012, 20(2): 90-95.
[4]Ibraheem D, Elaissari A, Fessi H.Gene therapy and DNA delivery systems[J].Int J Pharm, 2014, 459(1/2): 70-83.
[5]Yang J, Liu H, Zhang X.Design, preparation and application of nucleic acid delivery carriers[J].Biotechnol Adv, 2014, 32(4): 804-817.
[6]Rozema D B, Lewis D L, Wakefield D H, et al.Dynamic PolyConjugates for targeted in vivo delivery of siRNA to hepatocytes[J].Proc Natl Acad Sci U S A, 2007, 104(32): 12982-12987.
[7]Davis M E.The frst targeted delivery of siRNA in humans via a selfassembling, cyclodextrin polymer-based nanoparticle: from concept to clinic[J].Mol Pharm, 2009, 6(3): 659-668.
[8]Santel A, Aleku M, Keil O, et al.A novel siRNA-lipoplex technology for RNA interference in the mouse vascular endothelium[J].Gene Ther, 2006, 13(16): 1222-1234.
[9]Li L, Wang R, Wilcox D, et al.Tumor vasculature is a key determinant for the efficiency of nanoparticle-mediated siRNA delivery[J].Gene Ther, 2012, 19(7): 775-780.
[10]Liu J, Zhou J, Luo Y.SiRNA delivery systems based on neutral crosslinked dendrimers[J].Bioconjug Chem, 2012, 23(2): 174-183.
[11]Lehto T, Kurrikoff K, Langel Ü.Cell-penetrating peptides for the delivery of nucleic acids[J].Expert Opin Drug Deliv, 2012, 9(7): 823-836.
[12]El Andaloussi S A, Hammond S M, Mäger I, et al.Use of cellpenetrating-peptides in oligonucleotide splice switching therapy[J].Curr Gene Ther, 2012, 12(3):161-178.
[13]Lu K, Duan Q P, Ma L, et al.Chemical strategies for the synthesis of peptide-oligonucleotide conjugates[J].Bioconjug Chem, 2010, 21(2):187-202.
[14]Lundin P, Johansson H, Guterstam P, et al.Distinct uptake routes of cellpenetrating peptide conjugates[J].Bioconjug Chem, 2008.19(12): 2535-2542.
[15]Torres A G, Gait M J.Exploiting cell surface thiols to enhance cellular uptake[J].Trends Biotechnol, 2012, 30(4): 185-190.
[16]Ezzat K, Helmfors H, Tudoran O, et al.Scavenger receptormediated uptake of cell-penetrating peptide nanocomplexes with oligonucleotides[J].FASEB J, 2012, 26(3): 1172-1180.
[17]Konate K, Crombez L, Deshayes S, et al.Insight into the cellular uptake mechanism of a secondary amphipathic cell-penetrating peptide for siRNA delivery[J].Biochemistry, 2010, 49(16): 3393-3402.
[18]Del Vecchio C A, Li G, Wong A J.Targeting EGF receptor variant III:tumor-specifc peptide vaccination for malignant gliomas[J].Expert Rev Vaccines, 2012, 11(2): 133-144.
[19]Henke E, Perk J, Vider J, et al.Peptide-conjugated antisense oligonucleotides for targeted inhibition of a transcriptional regulator in vivo[J].Nat Biotechnol, 2008, 26(1): 91-100.
[20]Meng S, Wei B, Xu R, et al.TAT peptides mediated small interfering RNA delivery to Huh-7 cells and effciently inhibited hepatitis C virus RNA replication[J].Intervirology, 2009, 52(3): 135-140.
[21]Liu X, Wang W, Samarsky D, et al.Tumor-targeted in vivo gene silencing via systemic delivery of cRGD-conjugated siRNA[J].Nucleic Acids Res, 2014, 42(18): 11805-11817.
[22]Moulton H M, Nelson M H, Hatlevig S A, et al.Cellular uptake of antisense morpholino oligomers conjugated to arginine-rich peptides[J].Bioconjug Chem, 2004, 15(2): 290-299.
[23]Moulton H M.In vivo delivery of morpholino oligos by cell-penetrating peptides[J].Curr Pharm Des, 2013, 19(16): 2963-2969.
[24]Böttcher-Friebertshäuser E, Stein D A, Klenk H D, et al.Inhibition of infuenza virus infection in human airway cell cultures by an antisense peptide-conjugated morpholino oligomer targeting the hemagglutininactivating protease TMPRSS2[J].J Virol, 2011, 85(4): 1554-1562.
[25]Lai S H, Stein D A, Guerrero-Plata A, et al.Inhibition of respiratory syncytial virus infections with morpholino oligomers in cell cultures and in mice[J].Mol Ther, 2008, 16(6): 1120-1128.
[26]Opriessnig T, Patel D, Wang R, et al.Inhibition of porcine reproductive and respiratory syndrome virus infection in piglets by a peptideconjugated morpholino oligomer[J].Antiviral Res, 2011, 91(1): 36-42.
[27]Geller B L, Greenberg D E.Peptide-conjugated phosphorodiamidate morpholino oligomers: a new strategy for tackling antibiotic resistance[J].Ther Deliv, 2014, 5(3): 243-245.
[28]Shabanpoor F, McClorey G, Saleh AF, et al.Bi-specifc splice-switching PMO oligonucleotides conjugated via a single peptide active in a mouse model of Duchenne muscular dystrophy[J].Nucleic Acids Res, 2015, 43(1): 29-39.
[29]O'Donovan L, Okamoto I, Arzumanov A A, et al.Parallel synthesis of cell-penetrating peptide conjugates of PMO toward exon skipping enhancement in Duchenne muscular dystrophy[J].Nucleic Acid Ther, 2015, 25(1): 1-10.
[30]Nimesh S.Polyethylenimine as a promising vector for targeted siRNA delivery[J].Curr Clin Pharmacol, 2012, 7(2): 121-130.
[31]Merkel O M, Librizzi D, Pfestroff A, et al.Stability of siRNA polyplexes from poly(ethylenimine) and poly(ethylenimine)-g-poly(ethylene glycol) under in vivo conditions: effects on pharmacokinetics and biodistribution measured by Fluorescence Fluctuation Spectroscopy and Single Photon Emission Computed Tomography (SPECT) imaging[J].J Control Release, 2009, 138(2): 148-159.
[32]Wagner E.Polymers for siRNA delivery: inspired by viruses to be targeted, dynamic, and precise[J].Acc Chem Res, 2012, 45(7): 1005-1013.
[33]Sirsi S R, Schray R C, Guan X, et al.Functionalized PEG-PEI copolymers complexed to exon-skipping oligonucleotides improve dystrophin expression in mdx mice[J].Hum Gene Ther, 2008, 19(8):795-806.
[34]Schiffelers R M, Ansari A, Xu J, et al.Cancer siRNA therapy by tumor selective delivery with ligand-targeted sterically stabilized nanoparticle[J].Nucleic Acids Res, 2004, 32(19): e149.
[35]Tietze N, Pelisek J, Philipp A, et al.Induction of apoptosis in murine neuroblastoma by systemic delivery of transferrin-shielded siRNA polyplexes for downregulation of Ran[J].Oligonucleotides, 2008, 18(2):161-174.
[36]Dohmen C, Wagner E.Multifunctional CPP polymer system for tumortargeted pDNA and siRNA delivery[J].Methods Mol Biol, 2011, 683:453-463.
[37]Hu Y, Xu B, Ji Q, et al.A mannosylated cell-penetrating peptide-graftpolyethylenimine as a gene delivery vector[J].Biomaterials, 2014, 35(13): 4236-4246.
[38]Torchilin V P.Tat peptide-mediated intracellular delivery of pharmaceutical nanocarriers[J].Adv Drug Deliv Rev, 2008, 60(4/5):548-558.
[39]Ambegia E, Ansell S, Cullis P, et al.Stabilized plasmid-lipid particles containing PEG-diacylglycerols exhibit extended circulation lifetimes and tumor selective gene expression[J].Biochim Biophys Acta, 2005, 1669(2): 155-163.
[40]Hayashi Y, Yamauchi J, Khalil I A, et al.Cell penetrating peptidemediated systemic siRNA delivery to the liver[J].Int J Pharm, 2011, 419(1/2): 308-313.
[41]Tagalakis A D, He L, Saraiva L, et al.Receptor-targeted liposomepeptide nanocomplexes for siRNA delivery[J].Biomaterials, 2011, 32(26): 6302-6315.
[42]Nakase I, Akita H, Kogure K, et al.Effcient intracellular delivery of nucleic acid pharmaceuticals using cell-penetrating peptides[J].Acc Chem Res, 2012, 45(7): 1132-1139.
[43]Nakamura Y, Kogure K, Futaki S, et al.Octaarginine-modified multifunctional envelope-type nano device for siRNA[J].J ControlRelease, 2007, 119(3): 360-367.
[44]Hatakeyama H, Akita H, Ito E, et al.Systemic delivery of siRNA to tumors using a lipid nanoparticle containing a tumor-specifc cleavable PEG-lipid[J].Biomaterials, 2011, 32(18): 4306-4316.
[45]Valadi H, Ekström K, Bossios A, et al.Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J].Nat Cell Biol, 2007, 9(6): 654-659.
[46]Montecalvo A, Larregina A T, Shufesky W J, et al.Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes[J].Blood, 2012, 119(3): 756-766.
[47]Alvarez-Erviti L, Seow Y, Yin H, et al.Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J].Nat Biotechnol, 2011, 29(4): 341-345.
[48]Maier M A, Esau C C, Siwkowski A M, et al.Evaluation of basic amphipathic peptides for cellular delivery of antisense peptide nucleic acids[J].J Med Chem, 2006, 49(8): 2534-2542.
[49]Du L, Kayali R, Bertoni C, et al.Arginine-rich cell-penetrating peptide dramatically enhances AMO-mediated ATM aberrant splicing correction and enables delivery to brain and cerebellum[J].Hum Mol Genet, 2011, 20(16): 3151-3160.
[50]Jearawiriyapaisarn N, Moulton H M, Buckley B, et al.Sustained dystrophin expression induced by peptide-conjugated morpholino oligomers in the muscles of mdx mice[J].Mol Ther, 2008, 16(9): 1624-1629.
[51]Heemskerk H, de Winter C, van Kuik P, et al.Preclinical PK and PD studies on 2'-O-methyl-phosphorothioate RNA antisense oligonucleotides in the mdx mouse model[J].Mol Ther, 2010, 18(6):1210-1217.
[52]Moschos S A, Jones S W, Perry M M, et al.Lung delivery studies using siRNA conjugated to TAT(48-60) and penetratin reveal peptide induced reduction in gene expression and induction of innate immunity[J].Bioconjug Chem, 2007, 18(5): 1450-1459.
[53]Chaubey B, Tripathi S, Pandey V N.Single acute-dose and repeatdoses toxicity of anti-HIV-1 PNA TAR-penetratin conjugate after intraperitoneal administration to mice[J].Oligonucleotides, 2008, 18(1):9-20.
[54]Wu B, Moulton H M, Iversen P L, et al.Effective rescue of dystrophin improves cardiac function in dystrophin-deficient mice by a modified morpholino oligomer[J].Proc Natl Acad Sci U S A, 2008, 105(39):14814-14819.
[55]Cirak S, Arechavala-Gomeza V, Guglieri M, et al.Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study[J].Lancet, 2011, 378(9791):595-605.
[56]Amantana A, Moulton H M, Cate M L, et al.Pharmacokinetics, biodistribution, stability and toxicity of a cell-penetrating peptidemorpholino oligomer conjugate[J].Bioconjug Chem, 2007, 18(4): 1325-1331.
[57]Moulton H M, Moulton J D.Morpholinos and their peptide conjugates:therapeutic promise and challenge for Duchenne muscular dystrophy[J].Biochim Biophys Acta, 2010, 1798(12): 2296-2303.
[58]Wancewicz E V, Maier M A, Siwkowski A M, et al.Peptide nucleic acids conjugated to short basic peptides show improved pharmacokinetics and antisense activity in adipose tissue[J].J Med Chem, 2010, 53(10): 3919-3926.

[专家介绍] 丁晓然:中国人民解放军军事医学科学院放射与辐射医学研究所助理研究员。2003年毕业于北京大学药学院,2006年获中国人民解放军军事医学科学院硕士学位,2013年获得中国人民解放军军事医学科学院博士学位,主要从事抗病毒反义核酸药物设计以及核酸药物靶向递送技术研究。近年来在以病毒颗粒为载体的核酸药物靶向递送领域取得突破,将病毒表面蛋白特异性结合配体作为靶向分子,通过其与病毒表面蛋白的特异性结合,在病毒感染细胞的过程中将与其缀合在一起的核酸药物靶向递送入被感染细胞,实现核酸药物的靶向递送,发挥抗病毒作用。该研究为抗病毒核酸药物研发提供了新策略。作为课题负责人承担军用特需药专项课题1项,作为主要完成人参加国家863、973、重大科技专项及自然科学基金等项目6项;获得军队科技进步一等奖1项;发表SCI论文16篇;获授权发明专利6项。
Advances in Peptide-mediated Nucleic Acid Drug Delivery System
DING Xiaoran, WANG Shengqi
(Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China)
Nucleic acid drugs (NAs) as new gene therapies have been more concerned.However, the biological instability, susceptibility to nuclease degradation in vivo, low bioavailability and low concentration within the target tissue are the major factors restricting the development of NAs.The rapid development of new drug delivery technologies has solve the problem of NA’s stability and targeting delivery to a certain extent and greatly promoted the research progress of NAs.Especially, the peptide-based delivery vectors have become one of research hotspots in the feld of NA delivery system.The two main ways to modify NA delivery vectors with peptides——covalent conjugation and non-covalent complexation were introduced, the applications of peptide-based conjugates and complexes and peptide-modifed vectors in NA delivery system in recent years reviewed emphatically and the existing issues in the application of peptide-mediated NA delivery system were discussed to provide the reference for research and development of the novel NA delivery system.
peptide-mediated vector; nucleic acid drug; drug delivery system
R945
A
1001-5094(2015)02-0105-08
接受日期:2015-01-17
*通讯作者:王升启,研究员,博士生导师;
研究方向:传染病核酸检测新技术及核酸药物研究;
Tel:010-66932211;E-mail:sqwang@nic.bmi.ac.cn
