2015年值得关注的药物预测
2015-02-01汤森路透
汤森路透
·业界关注·
IMPORTANT AFFAIRS IN PHARMACEUTICAL WORLD
2015年值得关注的药物预测
汤森路透
回顾2014年值得关注的3种药物(Sovaldi、Anoro Ellipta和Zydelig)的上市和销售情况。重点介绍2015年值得关注药物的适应证、上市申请、临床开发情况以及市场前景展望等。
重磅药物;适应证;上市申请;临床开发;市场前景
1 2014年值得关注的药物回顾
2014年1月,汤森路透Cortellis竞争情报对3种值得关注的药物(Sovaldi、Anoro Ellipta和Zydelig)进行了预测:这3种药物将于2014年获准上市,且其销售额在5年内将超过10亿美元。现在看来,这3种药物均已按预期上市,虽然与2014年预测的销售额相比有所变动,但其实际销售额均超过了10亿美元(见图1)。
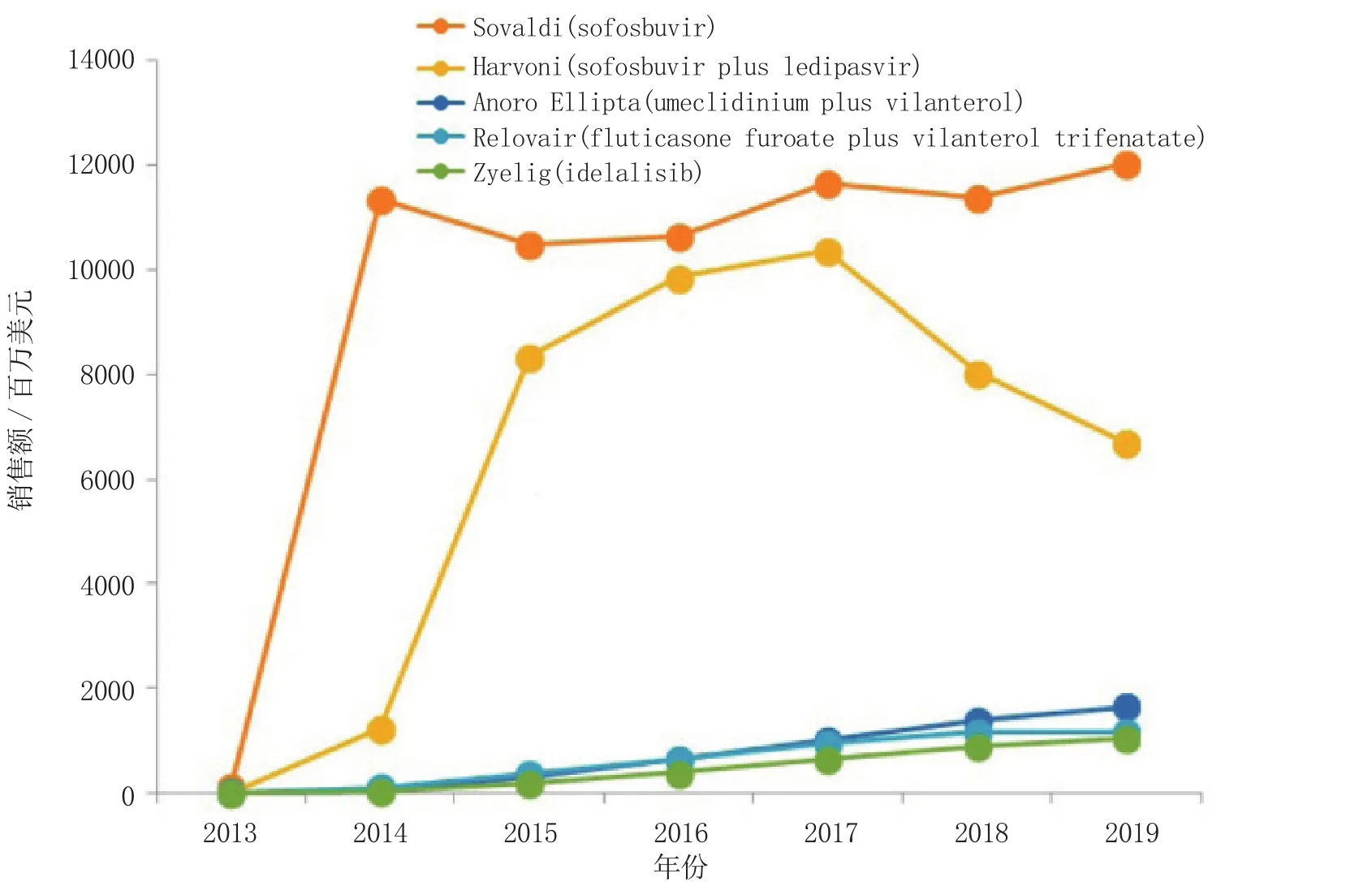
图1 2014年值得关注药物的预测销售额(数据截至日期为2015年2月)Figure 1 Sales forecast for drugs-to-watch in 2014
吉利德科学公司(Gilead Sciences,Inc.)的丙肝病毒(HCV)感染治疗药物Sovaldi(sofosbuvir)已于2013年年末和2014年1月分别在美国和欧盟上市,且于2014年6月向日本提交了上市申请。2014年1月据Consensus预测,Sovaldi的2014年销售额为24.03亿美元,2017年最高达91.21亿美元, 2019年将降至75.18亿美元。当前该药的预测销售额将大幅提高,虽然该药2014年全年销售额尚未公布,但其在2014年前三个季度的销售总额已达85.51亿美元,故其2014年预测销售额为113.52亿美元。2015年Sovaldi的预测销售额可能稍降至105.07亿美元, 2019年将再次上升至120.22亿美元。因该药的价格过高(每疗程的价格为84 000美元),故其市场定价饱受各方争议。吉利德公司的用于丙肝治疗的sofosbuvir+ledipasvir混合制剂Harvoni也引发同样争议,该药2014年10月在美国获批上市,每疗程的价格为94 500美元。2014年以来,Harvoni的预测销售额也有所上升,预测2017年销售额达峰值103.67亿美元。
葛兰素史克(GSK)和Theravance公司合作开发的慢性阻塞性肺病(COPD)治疗药物Anoro Ellipta(umeclidinium+vilanterol)分别于2014年4月、7月和9月在美国、欧盟和日本上市。2014年1月据Consensus预测,该药的2019年预测销售额为30.81亿美元,但当前该药的预期值将明显降低至16.40亿美元。然而,Anoro Ellipta的预测销售额仍将超过既往热销药物Relovair(fluticasone furoate +vilanterol trifenatate),后者在2019年的预测销售额为11.76亿美元。
2014年预测的另一热销药为吉利德公司的慢性淋巴细胞白血病(CLL)和惰性非霍奇金淋巴瘤[包括滤泡型B细胞霍奇金淋巴瘤(FL)和小淋巴细胞性淋巴瘤(SLL)]治疗药Zydelig(idelalisib)。2014年7月,该药在美国获批上市用于治疗CLL、FL和SLL,且于2014年9月向欧盟提交了该药用于治疗CLL和FL适应证的申请;截至2015年1月,该药在欧盟的上市申请正在审评中。2014年1月预测该药2017年的销售额为12.18亿美元, 2019年将降至11亿美元。当前预测该药的销售额将不断上升,虽然2017年的预测销售额仅为6.494亿美元, 但2019年将升至10.41亿美元。
2 2015年值得关注的新药展望
预计2015年将有更多有潜力的重磅药物上市。其中多数药物2019年的预测销售额介于10~30亿美元,但有3种药物2019年的预测销售额将突破30亿美元,分别是:百时美施贵宝公司(BMS)的黑色素瘤治疗药Opdivo(nivolumab)为56.84亿美元、再生元制药/赛诺菲公司的高胆固醇血症治疗药Praluent (alirocumab)为44.14亿美元以及诺华公司的慢性心力衰竭治疗药LCZ-696(sacubitril和valsartan)为37.31亿美元(见表1)。
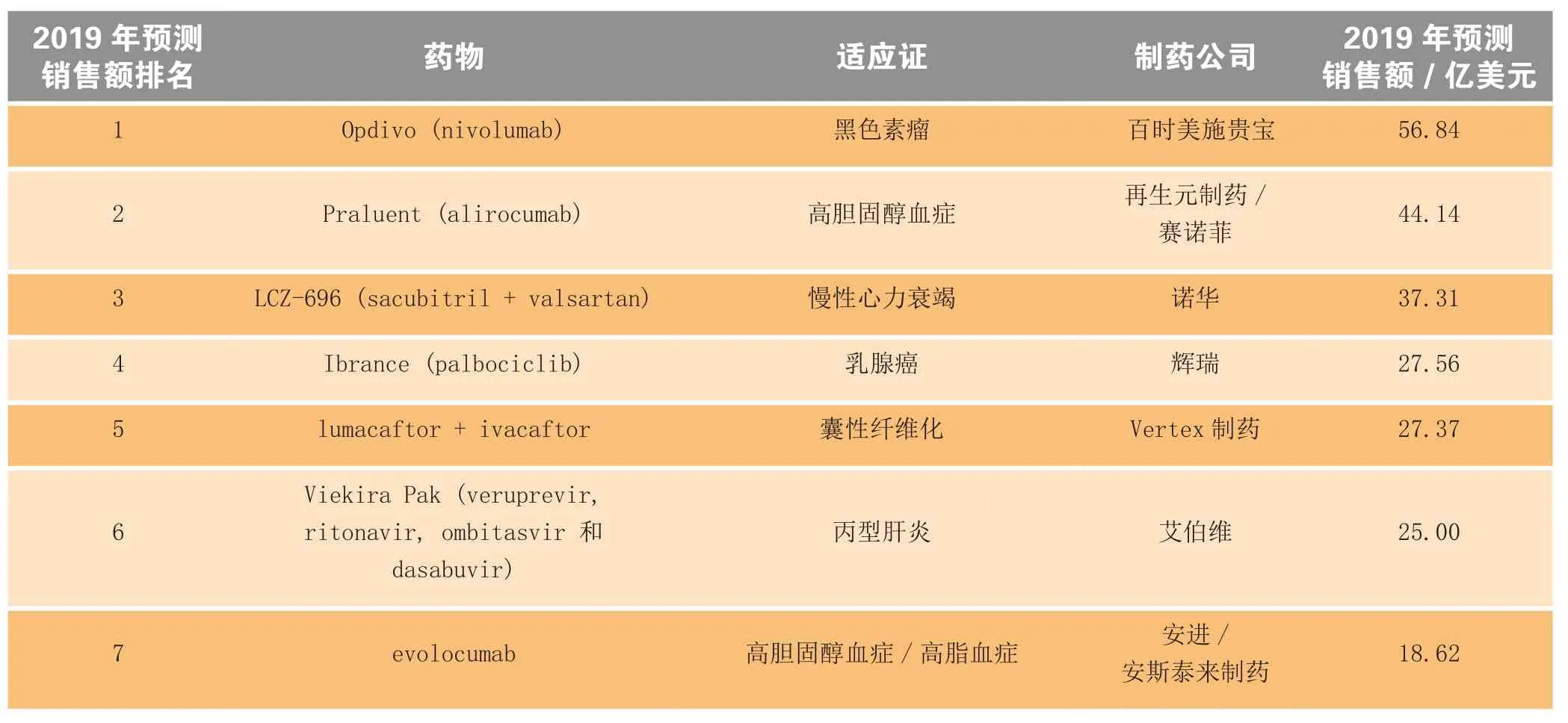
表1 2015年值得关注的未来重磅药物*Table1 The future blockbuster drugs-to-watch in 2015
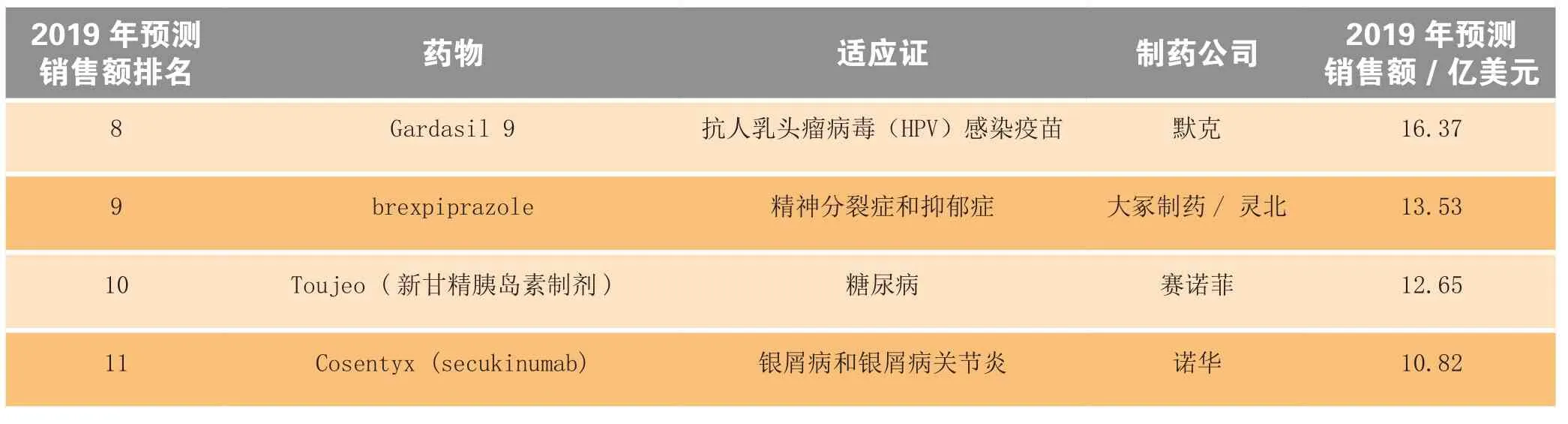
续表1
其他热销新药及其2019年的预测销售额(见图2)分别是:辉瑞公司的乳腺癌治疗药Ibrance (palbociclib)为27.56亿美元;Vertex制药公司囊性纤维化治疗药lumacaftor+ivacaftor为27.37亿美元;艾伯维(AbbVie)公司的丙肝治疗药Viekira Pak (veruprevir、ritonavir、ombitasvir和dasabuvir)为25亿美元;安进和安斯泰来制药公司的高胆固醇血症/高脂血症治疗药evolocumab为18.62亿美元;默克公司抗人类乳头瘤病毒(HPV)的Gardasil 9疫苗为16.37亿美元;大冢制药和灵北公司的精神分裂症和抑郁症治疗药brexpiprazole为13.53亿美元;赛诺菲公司的糖尿病治疗药Toujeo (新甘精胰岛素制剂)为12.65亿美元;诺华公司的银屑病和银屑病关节炎治疗药Cosentyx (secukinumab)为10.82亿美元。
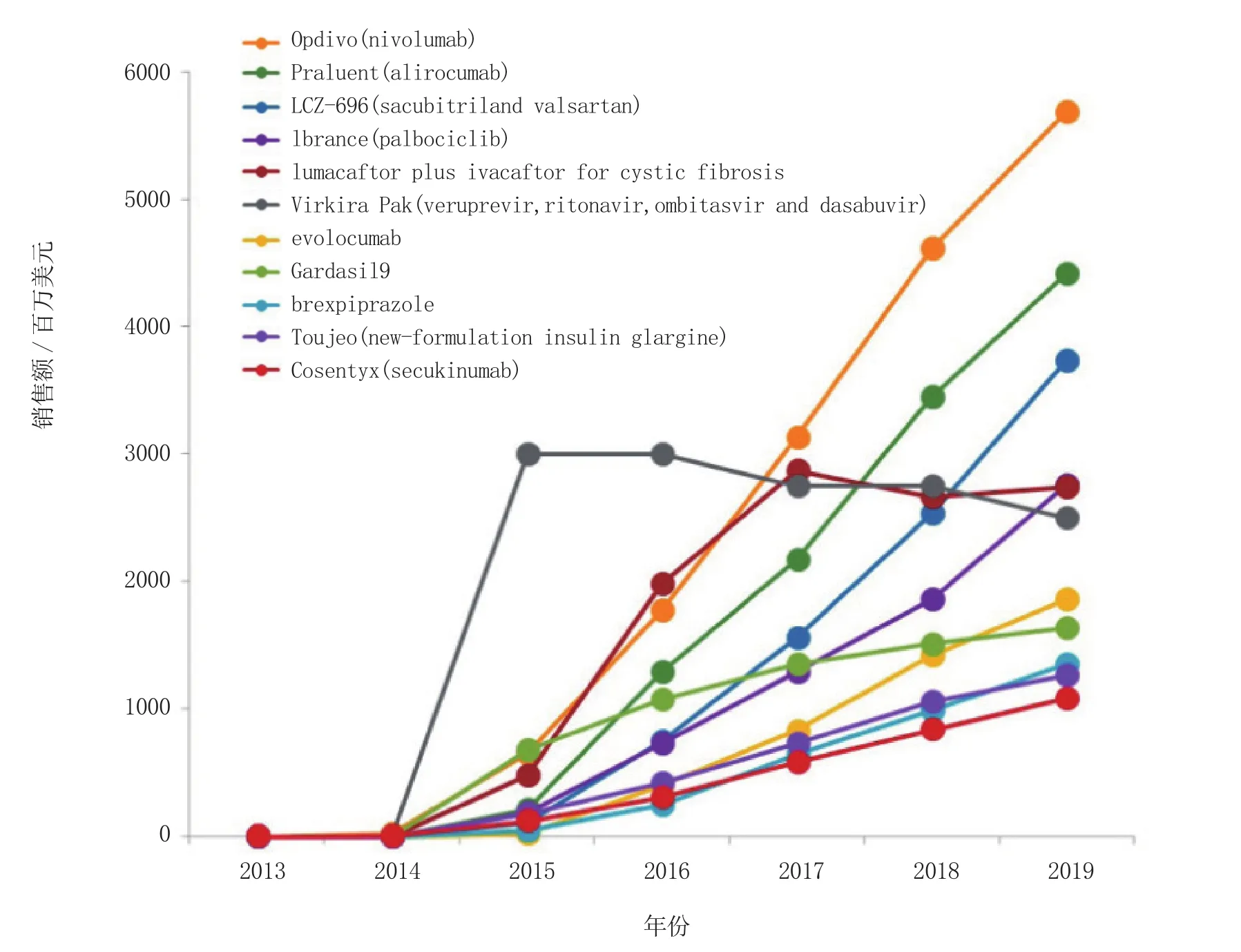
图2 2015年值得关注药物的预测销售额(数据截至日期为2015年2月)Figure 2 Sales forecast for drugs-to-watch in 2015
2.1 黑色素瘤和非小细胞肺癌治疗药Opdivo
2014年9月Opdivo在日本上市,预计2015年上半年将成为美国市场上的热销药物。2014年12月下旬,美国FDA加速批准了PD-1免疫检查点抑制剂Opdivo用于治疗不能手术切除或转移性(晚期)黑色素瘤,比原计划的PDUFA日期(2015年3月)提前了三个月,且该药已于2015年2月在美国上市。美国FDA审批基于的名为CheckMate037的Ⅲ期试验数据显示, Opdivo治疗组的客观缓解率(ORR)为32%,化疗组ORR为11%。2014年9月百时美施贵宝公司已向欧盟提交了Opdivo治疗黑色素瘤适应证的上市申请,且已获得加速审评资格。此外,2014年4月,Opdivo用于治疗非小细胞肺癌(NSCLC)的滚动式审评BLA已在美国启动; 2015年1月,一项Ⅲ期NSCLC 试验因Opdivo比对照药显著延长总生存期而被提前终止。
Opdivo的预测销售额已从2015年的6.521亿美元升至2019年的56.84亿美元,其中有50.13亿美元来自日本以外的市场,如美国。
Opdivo的竞争对手为默克公司的PD-1抑制剂Keytruda (pembrolizumab),后者基于Ib期试验数据于2014年9月通过美国FDA的加速审评程序获批上市。Keytruda在2019年的预测销售额为34.66亿美元。同Opdivo一样,默克公司已向欧盟提交了Keytruda治疗黑色素瘤适应证的上市申请。2015年1月,默克公司宣布将加快向美国FDA提交Keytruda治疗NSCLC适应证的申请,预计2015年年中提交申请。基于2014年10月美国FDA已授予Keytruda治疗NSCLC的突破性疗法资格,预计其2015年将会上市。
2.2 两种治疗高胆固醇血症的PCSK9抑制剂Praluent和evolocumab
赛诺菲/再生元制药的Praluent和安进/安斯泰来制药的evolocumab 两个PCSK9抑制剂将竞争成为下一个降胆固醇热销药。安进/安斯泰来制药于2014年8月首次向美国FDA提交了evolocumab的上市申请;2014年11月,美国FDA宣布受理该药的上市申请,其PDUFA日期为2015年8月27日; 2014年9月又向欧盟提交了evolocumab治疗血脂异常适应证的上市申请。多项Ⅲ期试验结果显示, evolocumab治疗12周后可降低患者的胆固醇水平。然而,2015年1月,美国FDA已同意优先审评2014年年末提交上市申请的Praluent,其PDUFA日期为2015年7月24日,比evolocumab的PDUFA日期早一个月。Praluent的优势表现为在Ⅲ期试验中该药可降低不良心血管事件(如,心源性死亡、心肌梗死和卒中)的发生率。2015年1月赛诺菲/再生元制药已向欧盟提交了有关Praluent的上市申请。2019年Praluent的预测销售额为44.14亿美元,evolocumab为18.62亿美元。
2.3 慢性心力衰竭治疗药LCZ-696
2014年第4季度,诺华公司已分别向美国和欧盟提交首个血管紧张素受体-脑啡肽酶双重抑制剂LCZ-696的上市申请,并期待2015年年底获得评审结果,该药可用于治疗射血分数降低型慢性心力衰竭(HFrEF)。2014年11月,欧盟给予该药加速审评资格,将明显缩短其审评时程。
一项涉及HFrEF 患者、名为 PARADI GM-HF 的临床试验比较了 LCZ-696 和依那普利两个治疗方案,在显示LCZ-696治疗组受试者院外生存期比依那普利治疗组受试者更长的阳性结果出台后,该项试验于2014年3月提前终止。2014年8月公布的相关试验最新数据彰显了LCZ-696的不凡疗效:与依那普利治疗组相比,LCZ-696治疗组受试者猝死率、因心衰住院的风险和全因死亡率分别降低了20%、21%和16%。LCZ-696适应证扩大用于射血分数正常型心衰(HFpEF)的申请预计最早可于2019年提交。LCZ-696在2015年的预测销售额为1.109亿美元,预计2019年将升至37.31亿美元。
2.4 乳腺癌治疗药Ibrance
2014年8月,辉瑞公司针对其周期蛋白依赖性激酶4和6抑制剂Ibrance向美国FDA提交了新药申请,该药可用于治疗未经全身性治疗的人类表皮生长因子受体 2 阴性(ER+HER2-)绝经后晚期乳腺癌患者;2015年2月美国FDA授予该药加速审批资格。Ibrance是基于以下名为PALOMA-1的Ⅱ期临床试验结果提交的新药申请, Ibrance联合芳香酶抑制剂来曲唑治疗组较来曲唑单药组可使患者无进展生存期延长一倍(10.2个月 vs 20.2个月)。一项中期研究数据显示,该药对患者总生存期有所改善,但差异不显著,如该药可使患者的生存期延长,还将进行一项随访分析。如果Ⅲ期试验数据和Ⅱ期结果一样好,Ibrance可能是这类患者的治疗新选择。该药在2019年的预测销售额为27.56亿美元。
2.5 囊性纤维化治疗复方药lumacaftor+ivacaftor
2014年11月Vertex制药公司已向美国FDA提交了lumacaftor+ivacaftor复方药的新药申请(NDA)和上市许可申请(MAA),用于治疗跨膜传导调节蛋白(CFTR)基因中F508del纯合子突变的12岁及以上囊性纤维化患者。该药已获得对MAA的加速审评资格,Vertex制药正在为该药寻求一项优先评审权;2015年1月,美国FDA宣布受理该药的上市申请,其PDUFA日期为2015年7月5日。此次申请提交基于2014年6月发布的名为TRAFFIC和TRANSPORT两项Ⅲ期试验结果, lumacaftor+ivacaftor复方药组在24周用药结束后,与安慰剂组相比其FEV1较基线值有绝对改善,且达到治疗的主要终点。Lumacaftor+ivacaftor复方药 2019年的预测销售额为27.37亿美元,超过了Vertex制药的Kalydeco(ivacaftor),后者已于2012年在美国和欧盟上市,其2019年的预测销售额为11.75亿美元。
2.6 丙肝治疗药Viekira Pak
艾伯维(AbbVie)公司的Viekira Pak是治疗丙肝的一种无干扰素的口服复方药,包含NS3/4A蛋白酶抑制剂veruprevir、增强剂ritonavir、NS5A抑制剂ombitasvir和NS5B聚合酶抑制剂dasabuvir 4个药物。基于关键性Ⅲ期研究结果,Viekira Pak对各组患者(包括首治、复治丙肝患者和代偿性肝硬化患者)治愈率介于95%~100%,2014年12月美国FDA批准该药可联合或不联合利巴韦林治疗基因1型丙型肝炎病毒(HCV)感染。2014年5月AbbVie公司向欧盟提交了该药的上市申请,欧盟授予其加速审评资格,且于2015年1月批准其上市以联合或不联合利巴韦林治疗基因1型HCV感染以及联合利巴韦林治疗基因4型HCV感染。预计2015年第1季度该药将在欧盟上市。2015年AbbVie公司还将向日本提交该药的上市申请。
每日最少服用4片的Viekira Pak将面临每日服用1片的Harvoni激烈竞争; Viekira Pak的2019年预测销售额为25亿美元,Harvoni为66.97亿美元。药物间竞争也带来了价格战比拼,Viekira Pak进入市场的每疗程价格为83 319美元,而Harvoni的价格为94 500美元。此外,2014年12月AbbVie公司与美国最大的药品福利管理公司的快捷药方(Express Scripts)达成协议,决定以非常优惠的价格(具体价格未披露)出售Viekira Pak,以替代Harvoni;在欧盟某些地区Viekira Pak每疗程的价格介于51 373~61 000美元。随后,吉列德制药公司与药品福利管理公司CVS Health和医疗保险公司Anthem签定协议,以相对于Viekira Pak的优惠价格优先供应Harvoni,其具体优惠价格将是这两项交易的重要部分之一。以上两种药物也可能面临其他竞争产品,如默克公司宣布将加快开发丙肝复方制剂grazoprevir+elbasvir,并计划于2015年上半年向美国FDA提交该药的上市申请。普遍预测grazoprevir+elbasvir将于2016年上市销售,其2019年的预测销售额为21.67亿美元。
2.7 预防HPV感染药Gardasil 9
2006年默克和赛诺菲·巴斯德公司研发的全球首个预防HPV感染及相关癌症的4价疫苗Gardasil上市销售;该药的销售额从2006年的2.348亿美元增至2013年的18.31亿美元,但预计2019年将降至12.36亿美元。Gardasil 9是默克公司继Gardasil疫苗后开发的新一代药物,将HPV的预防亚型由4种增至9种。临床数据表明, Gardasil 9对共有的4种HPV亚型引起的癌症与Gardasil等效,且对新覆盖的5种HPV亚型引起的癌症的预防有效率为97%。Gardasil 9是美国FDA批准的唯一一种预防这5种HPV亚型的疫苗,可预防20%的宫颈癌。Gardasil 9于2014年12月获得美国FDA批准,计划于2015年2月上旬上市;该药提交给欧盟的上市申请也正接受评审。预计2019年Gardasil 9的销售额将达16.37亿美元。
2.8 精神分裂症和抑郁证治疗药brexpiprazole
2014年7月大冢和灵北制药向美国FDA联合提交了brexpiprazole的新药申请,该药为口服5-羟色胺-多巴胺活性调节剂,可用于治疗精神分裂症以及抑郁症的辅助治疗。Brexpiprazole的新药申请是基于7项Ⅱ期和Ⅲ期临床研究,其中3项针对精神分裂症治疗,4项针对抑郁症的辅助治疗。针对精神分裂证的2项 Ⅲ期临床试验显示,相较于安慰剂,该药(4 mg·d-1)可使患者症状明显改善;其中一项试验中,该药2 mg·d-1的剂量就可见显著疗效。第3项涉及精神分裂症患者的Ⅱ期临床试验显示,brexpiprazole对患者症状有改善,但差异不显著。针对抑郁症的2项 Ⅲ期临床试验显示,该药剂量为2或3mg时有显著疗效;一项Ⅱ期相关研究显示,该药剂量为1.5 mg时即有显著疗效。另一项Ⅱ期试验也为其他研究提供了相关支持数据。2014年9月美国FDA宣布该药的PDUFA日期为2015年7月11日,两家公司计划2015年也向欧盟提交申请。预计该药2019年的销售额为13.53亿美元。
2.9 糖尿病治疗药Toujeo
赛诺菲公司研发的来得时(Lantsu)升级产品Toujeo(新甘精胰岛素皮下注射液),可用于治疗1型和2型糖尿病成人患者。赛诺菲分别于2014年5月和2014年7月向欧盟和美国FDA提交了该药的上市申请,预计分别于2015年第2和第1季度获知相关决定;2014年7月又向日本提交了上市申请。Toujeo的申请是基于名为EDITION、一系列国际Ⅲ期临床项目的数据,结果显示Toujeo可使HbA1c水平相对于基线有所降低。
2013年来得时的销售额为75.90亿美元,预计2014年达到最高值82.68亿美元后将逐渐降低至2019年的66.30亿美元,Toujeo的预测销售额不含在内。预计Toujeo的销售额在2019年将升至12.65亿美元。Toujeo将面临来得时仿制药的严峻竞争,如礼来和勃林格殷格翰公司的Basaglar (Abasria)已获批,将在美国、欧盟和日本上市。
2.10 银屑病和银屑病关节炎治疗药Cosentyx
诺华公司的抗白介素-17A(IL-17A)单克隆抗体Cosentyx于2014年12月在日本获批上市,用于全身性治疗应答不足的银屑病和银屑病关节炎成年患者。2015年1月,该药在美国和欧盟获批用于治疗中至重度斑块型银屑病,诺华公司已计划提交该药治疗银屑病关节炎、强直性脊柱炎和葡萄膜炎等适应证的上市申请。Cosentyx的Ⅲ期临床项目包括FIXTURE等4项在中至重度斑块型银屑病患者中进行的研究显示,与Enbrel(依那西普)的头对头比较疗效更好,且Cosentyx达到所有主要终点。Cosentyx打败其竞争对手(如,礼来公司的ixekizumab和安进/阿斯利康/Kyowa Hakko Kirin公司的brodalumab),成为首个获批上市的抗IL-17银屑病治疗药物。预计Cosentyx的销售额将从2015年的1.2亿美元升至2019年的10.82亿美元。
3 总结
上述潜在的热销新药目前预测的销售额远高于2014年预期,这是否可预示药物开发状态或热销模式的持久性尚待观察。2015年可供关注的方向有:基于免疫疗法的抗癌药物(如Opdivo、Keytruda)的研发情况;高胆固醇血症治疗药物(如Praluent、evolocumab)间的竞争情况;治疗慢性心力衰竭的复方新药(如LCZ-696)的市场准入情况;HCV全口服方案新药上市情况等。
Drugs to Watch in 2015
Thomson Reuters
The marketing and sales of three drugs-to-watch(Sovaldi、Anoro Ellipta and Zydelig) in 2014 were reviewed.The indications, flings, clinical development, and market outlook for drugs-to-watch in 2015 were especially introduced.
blockbuster drug; indications; flings; clinical development; market outlook
R97
A
1001-5094(2015)02-0153-06
