MDR1基因C3435T多态性对弥漫性大B细胞淋巴瘤化疗效果及血液学毒性的影响▲
2015-01-23黄谷瑜谭晓虹
黄谷瑜 柯 晴 谭晓虹 岑 洪
(广西医科大学附属肿瘤医院化疗三科,南宁市 530021,E-mail:hgy420@qq.com)
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤最常见的类型,是一组在临床特征、预后等方面具有高度异质性的肿瘤[1]。人类多药耐药基因1(multidrug resistance 1,MDR1)的产物P-糖蛋白(P-glycoprotein,P-gp)是一种 ATP 依赖性转运蛋白,能将许多结构不同的化合物逆向转运出细胞。MDR1 C3435T(rs1045642)位于26号外显子,可影响P-gp的表达和活性[2]。肿瘤细胞产生的MDR1基因过表达是导致化疗失败的一个主要因素[3]。目前许多研究已证实MDR1基因C3435T多态性与多种肿瘤的预后及化疗相关毒性有关。本研究旨在探讨MDR1基因C3435T多态性对DLBCL患者的化疗疗效及化疗相关血液学毒性的影响。
1 资料与方法
1.1 临床资料 选择2008年1月至2013年12月在广西医科大学附属肿瘤医院初治的DLBCL患者117例,诊断均符合WHO 诊断标准[4],临床分期采用Ann-Arbor分期,患者均接受4周期以上的CHOP(环磷酰胺、长春新碱、阿霉素、泼尼松)方案或R-CHOP(利妥昔单抗、环磷酰胺、长春新碱、阿霉素、泼尼松)方案一线化疗。117例患者中,116例有完整的血液学毒性资料,109例有一线化疗疗效评价资料,99例有详细的随访资料。患者临床资料见表1。
1.2 仪器和试剂 基因组DNA提取试剂盒TIANamp购自北京天根公司;PCR扩增引物由上海英骏生物技术有限公司合成;PCR扩增试剂盒Premix Ex Taq及限制性内切酶MboI购自大连TaKaRa公司;PCR扩增仪Biometra Tprofessional购自德国Biometra公司;核酸染料GelRed购自美国Biotium公司;凝胶成像系统购自美国Bio-Rad公司。1.3 MDR1基因C3435T多态性检测 采用聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)方法对多态性进行分析。抽取患者外周静脉血2 ml,用乙二胺四乙酸(EDTA)管抗凝,参照DNA提取试剂盒说明书分离基因组DNA。PCR 引 物 序 列 为 5'-TTGATGGCAAAGAAATAAAGC-3'和 5'-CTTACATTAGGCAGTGACTCG-3'。PCR 反应体系是 25 μl:0.3 μg 基因组 DNA、上下游引物各0.3 μm、Premix Ex Taq 12.5 μl;反应条件是:98℃ 变性10 s,56℃退火30 s,72℃延伸1 min,重复30 个循环。PCR扩增产物用2%琼脂糖凝胶电泳、用GelRed染色,在紫外线下观察,DNA条带为包含MDR1基因C3435T多态性位点的208 bp 的片段。酶切体系是 20 μl:1 μl MboI、2 μl PCR产物、1 μl 10×K缓冲液;反应条件是37℃消化2 h。酶切产物用上述方法观察DNA条带。TT纯合基因型可观察到1条未消化的条带(208 bp),CT杂合基因型可观察到208 bp、145 bp和63 bp 3条带,CC纯合基因型可观察到145 bp和63 bp 2条带。选择部分PCR产物进行DNA测序验证其分型结果。
1.4 治疗方法 117例 DLBCL患者均采用一线的CHOP方案或R-CHOP方案化疗,21 d为1周期,中位化疗周期为6(4~8)周期。在治疗期间每2周期进行疗效评价,治疗结束后2年内每3个月进行疗效评价,治疗结束后3~5年每6个月评价疗效(对于入组较晚的患者,以最后一次随访结果进行分析)。
1.5 疗效评价、生存分析及血液学毒性评价 疗效评价参照非霍奇金淋巴瘤NCCN指南2012年第3版淋巴瘤缓解标准[5],分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。总缓解率(ORR)为CR率和PR率之和。无进展生存(PFS):是指从治疗开始到疾病进展、复发,或者死亡的时间。总生存(OS):是
指从治疗开始到任何原因引起死亡的时间。血液学毒性评价参照WHO抗癌药急性及亚急性毒性分级标准[6]。严重的血液学毒性包括Ⅲ~Ⅳ级的白细胞减少、血小板减少以及贫血。
1.6 统计学分析 使用IBM SPSS 22.0统计软件进行分析。计数资料采用秩和检验或χ2检验(或Fisher精确概率法)。生存分析采用 Kaplan-Meier法,用Breslow(Generalized Wilcoxon)检验比较PFS和OS有无统计学差异。以P<0.05为差异有统计学意义。
2 结果
2.1 MDR1 C3435T等位基因的频率 在117例DLBCL患者中,CC基因型47例(40.2%,47/117),TT基因型17例(14.5%,17/117),CT 基因型 53 例(45.3%,53/117),C和T等位基因频率分别是62.8%(147/234)和37.2%(87/234)。117例DLCBL患者的MDR1 C3435T的基因型分布符合Hardy-Weinberg平衡(P=0.743)。
2.2 MDR1 C3435T不同基因型患者的临床资料比较
117例患者中,CC基因型47例,CT+TT基因型70例,CC基因型组与CT+TT基因型组患者性别、年龄、临床分期、血清乳酸脱氢酶水平、结外器官侵犯数目、体能状况评分和国际预后指数评分、化疗方案比较,差异无统计学意义(P均>0.05),具有可比性。
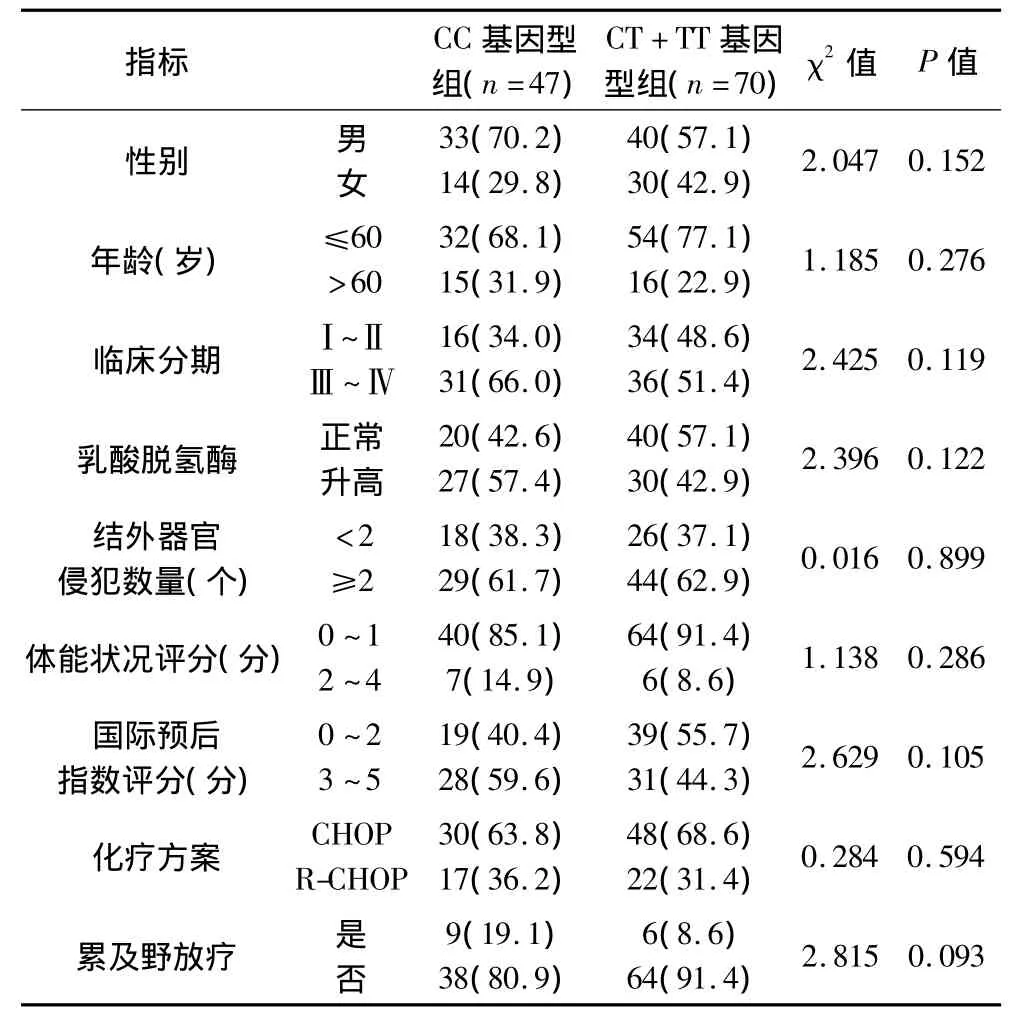
表1 CC基因型组与CT+TT基因型组患者临床资料比较(n,%)
2.3 MDR1 C3435T不同基因型组患者的疗效比较 117例患者中,109例患者有一线化疗疗效评价资料,其中CC基因型44例,CT+TT基因型65例。治疗后,CT+TT基因型组患者的ORR、CR率稍高于CC基因型组,但两组比较,差异无统计学意义(u=1.129,P=0.129)。见表2。
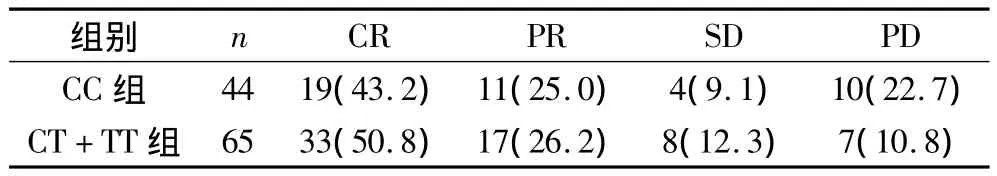
表2 不同基因组患者临床疗效比较(n,%)
2.4 MDR1 C3435T不同基因型组患者的生存时间比较
117例患者中,99例患者有完整随访资料,中位随访时间为11.2月。99例患者中,CC基因型38例,CT+TT基因型61例。CT+TT基因型组患者的中位PFS时间为29.6个月,明显长于CC基因型组患者的17.7个月(χ2=5.363,P=0.021),见图 1。而两组患者 OS 比较,差异无统计学意义(χ2=0.005,P=0.942),见图 2。

图1MDR1 C3435T各基因型DLBCL患者PFS曲线比较
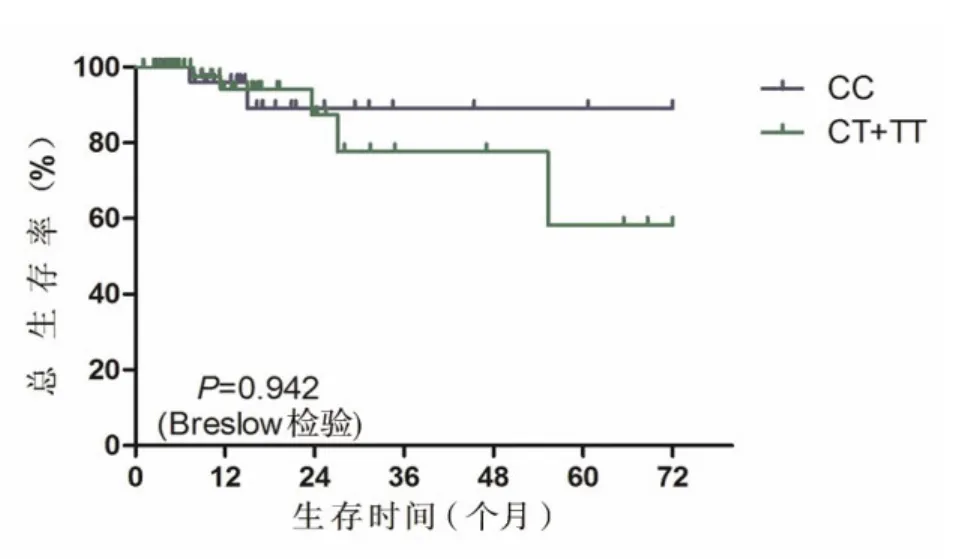
图2 MDR1 C3435T各基因型DLBCL患者OS曲线比较
2.5 MDR1 C3435T不同基因型组患者的血液学毒性比较 116例有完整的血液学毒性资料患者中,CC基因型46例,CT+TT基因型70例。经化疗后,CT+TT基因型组严重贫血、血小板减少和严重血小板减少发生率明显低于CC基因型组患者(P<0.05)。见表3。

表3 MDR1 C3435T不同基因型患者血液学毒性比较(n,%)
3 讨论
近年来,随着靶向药物的开发、应用以及化疗方案的不断完善,DLBCL患者的疗效及预后大大提高。R-CHOP方案已确定为 DLBCL患者的标准治疗方案[7]。尽管使用标准治疗方案,但仍有1/3的DLBCL患者最终发展为复发/难治性淋巴瘤[8]。
P-gp是MDR1基因的蛋白产物,又称ATP结合盒式转运子,具有广泛的底物特异性,可转运多种化学成分,包括外源性物质(如抗肿瘤药物和细菌毒素)以及内源性复合物,因此它可以保护机体不受侵害[9]。DLBCL化疗方案中的主要药物长春新碱和阿霉素,则是P-gp的底物。
MDR1基因C3435T多态性是一种同义突变的单核苷酸多态性,即不产生编码序列的改变。以往认为MDR1基因C3435T同义突变是沉默的突变,但目前研究证实MDR1基因同义突变可能会影响其产物P-gp的表达及功能[10]。但尚不明确这种基因突变是否会影响化疗的疗效和毒性。Hoffmeyer等[2]对高加索人群十二指肠中P-gp的表达水平与MDR1基因C3435T多态性的关系进行统计分析,结果发现CC型患者MDR1表达水平比TT型患者高2倍,并且TT型患者血浆药物含量最高。Illmer等[11]研究也证实,MDR1基因C3435T多态性可通过选择性药物转运等特殊机制影响急性髓细胞白血病患者的治疗效果,并且CC型基因可能是疾病复发的独立影响因素。Jamroziak等[12]报告慢性淋巴细胞白血病患者细胞中P-gp的活性由MDR1 C3435T基因型决定,CC基因型患者P-gp活性最高,TT基因型最低,而P-gp对抗癌药物转运起重要作用,因此MDR1可影响化疗疗效。关于急性淋巴细胞白血病、多发性骨髓瘤和乳腺癌的研究,也证实T携带者的OR率或OS优于CC型患者[13-15]。然而,有一些研究得出不同的结论,如 Hu等[16]对中国DLBCL患者的研究结果表明,TT基因型患者的OS较短;Cizmarikova等[17]发现在基于蒽环类药物化疗的乳腺癌患者中,CC基因型患者的PFS和OS更长;还有研究证实MDR1基因mRNA的表达量在T基因携带者中比 C基因携带者高[18],或认为 MDR1基因C3435T多态性与急性髓细胞白血病患者的疗效和预后无相关性[19-20]。
本研究结果显示,MDR1基因 C3435T多态性与DLBCL患者的PFS和化疗后血液学毒性有关联,CT+TT基因型患者较CC基因型患者PFS长,严重贫血、血小板减少和严重血小板减少的发生率低(P<0.05)。本研究结果与部分学者的研究结果有所不同,如Erdelyi等[21]的研究发现TT基因型患者化疗后更易于合并感染,但各基因型患者化疗后严重白细胞减少发生率无差异;Tran等[22]报告,TT基因型患者化疗后更易发生严重血液学毒性。还有的学者认为MDR1基因C3435T多态性与化疗后血液学毒性发生无显著相关性[17,23]。造成这些研究结果差异的原因还不清楚,推测可能与研究对象种族、肿瘤病理类型、治疗方案等因素有关。此外,上述研究大多是回顾性研究,研究的样本量相对较小、随访时间相对较短,不足以达到充分的检验效能。因此要得到明确结论,尚需前瞻性大样本的研究进一步证实。
综上所述,MDR1基因 C3435T多态性可能影响DLBCL患者的化疗效果和血液学毒性。未来可通过研发靶向MDR1的药物,减少肿瘤细胞耐药发生,进而提高DLBCL患者化疗效果、减轻化疗药物毒性反应,最终实现基于基因多态性的个体化治疗。
[1] Lenz G,Staudt LM.Aggressive lymphomas[J].N Engl J Med,2010,362(15):1 417 -1 429.
[2] Hoffmeyer S,Burk O,von Richter O,et al.Functional polymorphisms of the human multidrug-resistance gene:multiple sequence variations and correlation of one allele with P-glycoprotein expression and activity in vivo[J].Proc Natl Acad Sci USA,2000,97(7):3 473 -3 478.
[3] Fung KL,Gottesman MM.A synonymous polymorphism in a common MDR1(ABCB1)haplotype shapes protein function[J].Biochim Biophys Acta,2009,1794(5):860 -871.
[4] A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin's lymphoma.The Non-Hodgkin's Lymphoma Classification Project[J].Blood,1997,89(11):3 909 -3 918.
[5] Cheson BD,Pfistner B,Juweid ME,et al.Revised response criteria for malignant lymphoma[J].Clin Oncol,2007,25(5):579-586.
[6] Miller AB,Hoogstraten B,Staquet M,et al.Reporting results of cancer treatment[J].Cancer,1981,47(1):207 - 214.
[7] Coiffier B,Lepage E,Briere J,et al.CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma[J].N Engl J Med,2002,346(4):235 -242.
[8] Friedberg JW.New strategies in diffuse large B-cell lymphoma:translating findings from gene expression analyses into clinical practice[J].Clin Cancer Res,2011,17(19):6 112-6 117.
[9] Shankland KR,Armitage JO,Hancock BW.Non-Hodgkin lymphoma[J].Lancet,2012,380(9 844):848 -857.
[10] Kimchi-Sarfaty C,Oh JM,Kim IW,et al.A"silent"polymorphism in the MDR1 gene changes substrate specificity[J].Science,2007,315(5811):525 -528.
[11] Illmer T,Schuler US,Thiede C,et al.MDR1 gene polymorphisms affect therapy outcome in acute myeloid leukemia patients[J].Cancer Res,2002,62(17):4 955 -4 962.
[12] Jamroziak K,Balcerczak E,Smolewski P,et al.MDR1(ABCB1)gene polymorphism C3435T is associated with P-glycoprotein activity in B-cell chronic lymphocytic leukemia[J].Pharmacol Rep,2006,58(5):720 -728.
[13] Jamroziak K,Mlynarski W,Balcerczak E,et al.Functional C3435T polymorphism of MDR1 gene:an impact on genetic susceptibility and clinical outcome of childhood acute lymphoblastic leukemia[J].E Eur J Haematol,2004,72(5):314-321.
[14] Buda G,Maggini V,Galimberti S,et al.MDR1 polymorphism influences the outcome of multiple myeloma patients[J].Br J Haematol,2007,137(5):454 -456.
[15] George J,Dharanipragada K,Krishnamachari S,et al.A single-nucleotide polymorphism in the MDR1 gene as a predictor of response to neoadjuvant chemotherapy in breast cancer[J].Clin Breast Cancer,2009,9(3):161 -165.
[16] Hu LL,Yu B,Yang J.MDR1 polymorphisms associated with risk and survival in diffuse large B-cell lymphoma[J].Leuk Lymphoma,2013,54(6):1 188 -1 193.
[17] Cizmarikova M,Wagnerova M,Schonova L,et al.MDR1(C3435T)polymorphism:relation to the risk of breast cancer and therapeutic outcome[J].Pharmacogenomics J,2010,10(1):62-69.
[18] Nakamura T,Sakaeda T,Horinouchi M,et al.Effect of the mutation(C3435T)at exon 26 of the MDR1 gene on expression level of MDR1 messenger ribonucleic acid in duodenal enterocytes of healthy Japanese subjects[J].Clin Pharmacol Ther,2002,71(4):297 -303.
[19] Hur EH,Lee JH,Lee MJ,et al.C3435T polymorphism of the MDR1 gene is not associated with P-glycoprotein function of leukemic blasts and clinical outcome in patients with acute myeloid leukemia[J].Leuk Res,2008,32(10):1 601 - 1 604.
[20] van der Holt B,Van den Heuvel-Eibrink MM,Van Schaik RH,et al.ABCB1 gene polymorphisms are not associated with treatment outcome in elderly acute myeloid leukemia patients[J].Clin Pharmacol Ther,2006,80(5):427 -439.
[21] Erdélyi DJ,Kámory E,Zalka A,et al.The role of ABC-transporter gene polymorphisms in chemotherapy induced immunosuppression,a retrospective study in childhood acute lymphoblastic leukaemia[J].Cell Immunol,2006,244(2):121-124.
[22] Tran A,Jullien V,Alexandre J,et al.Pharmacokinetics and toxicity of docetaxel:role of CYP3A,MDR1,and GST polymorphisms[J].ClinPharmacolTher,2006,79(6):570-580.
[23] Chang H,Rha SY,Jeung HC,et al.Association of the ABCB1 3435C>T polymorphism and treatment outcomes in advanced gastric cancer patients treated with paclitaxel-based chemotherapy[J].Oncol Rep,2010,23(1):271 -278.
