丘脑卒中伴嗜睡患者血浆下丘脑分泌素和白细胞介素-17含量变化
2015-01-23田倩倩崔林阳薛蓉
田倩倩,崔林阳,薛蓉
丘脑在睡眠和觉醒的调节中起着重要的作用,因此,丘脑卒中患者常伴有睡眠障碍[1]。1998年由Sakurai等发现的递质下丘脑分泌素(hypocretin,Hcrt)越来越被证明在促进觉醒中发挥非常重要的作用,这种促觉醒作用主要是通过兴奋多个皮层下觉醒系统和非特异性丘脑皮层投射系统而调节的[2]。同时有实验发现炎性因子的改变与睡眠结构有关[3]。白细胞介素-17(interleukin 17,IL-17)是脑组织缺血再灌注损伤机制中的一个重要因素。目前国内外对于丘脑卒中后血浆中生化指标的研究尚少,为此,本研究对血浆中Hcrt、IL-17浓度的变化进行监测,初步探索丘脑卒中后嗜睡发生机制,以期为其早期识别诊断提供理论依据。
1 对象与方法
1.1 研究对象 选择2013年3月~2014年3月在天津医科大学总医院神经内科住院的经头颅影像学检查证实的丘脑卒中患者34例为研究对象。纳入和排除标准:①符合1995年中华医学会第四届脑血管病学术会议修订的诊断标准[4],经头颅计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)检查确诊的首次急性期丘脑卒中(包括出血性丘脑卒中和缺血性丘脑卒中)患者;②年龄40~80岁;③发病12 d内就诊;④美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分0~7分;⑤无智能、语言理解明显障碍,能独自完成各种量表的测评;⑥配合检查并完成随访者,签署知情同意书。排除标准:①昏迷;②合并其他部位卒中及既往卒中史;③其他脑病史;④严重的生理及心理疾病;⑤存在已知的睡眠疾病;⑥近期服用影响中枢神经系统药物(如苯二氮 类、抗抑郁药、抗精神病药等)的患者。
1.2 研究方法
1.2.1 临床资料及分组 登记年龄、性别、文化程度、职业、婚姻状况、利手等人口学信息;登记糖尿病[5]、高血压[6]、吸烟[7]、饮酒[7]等相关血管性危险因素;现病史;既往睡眠状况、鼾症及是否伴有睡眠呼吸暂停;服药史及抗精神病类药物服用情况。
入选患者分为两组:按照由Johns MW编制的Epworth嗜睡量表[8]评定患者白天嗜睡状态,所有研究对象均由经过专业培训的同一人员,采用交谈的方法应用Epworth嗜睡量表进行问卷调查,并将其分为以下两组:
丘脑卒中伴嗜睡组:Epworth嗜睡量表>10分的患者;
丘脑卒中不伴嗜睡组:Epworth嗜睡量表≤10分的患者。
1.2.2 实验室检查 于发病后2~12 d采集清晨空腹静脉血3~5 ml。血样通过低温(4 ℃)离心机以3000转/分离心15 min提取血浆,将分离所得血浆在分析前一直存储于-80 ℃冰箱。采用天津达科生物科技有限公司提供的酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒对血浆中Hcrt、IL-17的浓度进行测定。
1.3 统计学方法 采用SPSS 17.0统计软件分析,计量资料符合正态分布的用(s)表示,不符合正态分布的用中位数和四分位数表示,组间差异采用方差分析;计数资料用率表示,采用χ2检验或非参数检验,两组间两独立样本采用t检验。P<0.05为差异有显著性。
2 结果
研究共入组34例患者,男18例,女16例,年龄43~78岁,平均(60.1±12.6)岁。其中丘脑卒中伴嗜睡组18例(52.9%),不伴嗜睡组16例(47.1%)。
2.1 丘脑卒中伴/不伴嗜睡患者基线对比 丘脑卒中伴嗜睡组与丘脑卒中不伴嗜睡组比较,其基线资料均未见显著差异(表1)。
2.2 丘脑卒中患者伴/不伴嗜睡对Hcrt、IL-17水平的影响 丘脑卒中伴嗜睡组Hcrt浓度较不伴嗜睡组增高,差异有显著性;嗜睡组IL-17浓度较不伴嗜睡组增高,差异有显著性(表2)。
3 讨论
丘脑卒中后睡眠障碍的表现形式多样,主要表现为睡眠增多、白天过度嗜睡、疲劳感等[9]。由于认识及关注度不足,国内外尚缺乏关于丘脑卒中后睡眠障碍的流行病学研究。本研究数据显示,丘脑卒中后嗜睡患者的比例为52.9%,发生率高,推测其可能与丘脑卒中后诱发与之相关的睡眠神经递质、炎性介质、机体的应激反应改变有关,本研究从丘脑卒中后血浆中Hcrt和IL-17的变化对其发生机制进行相关分析。
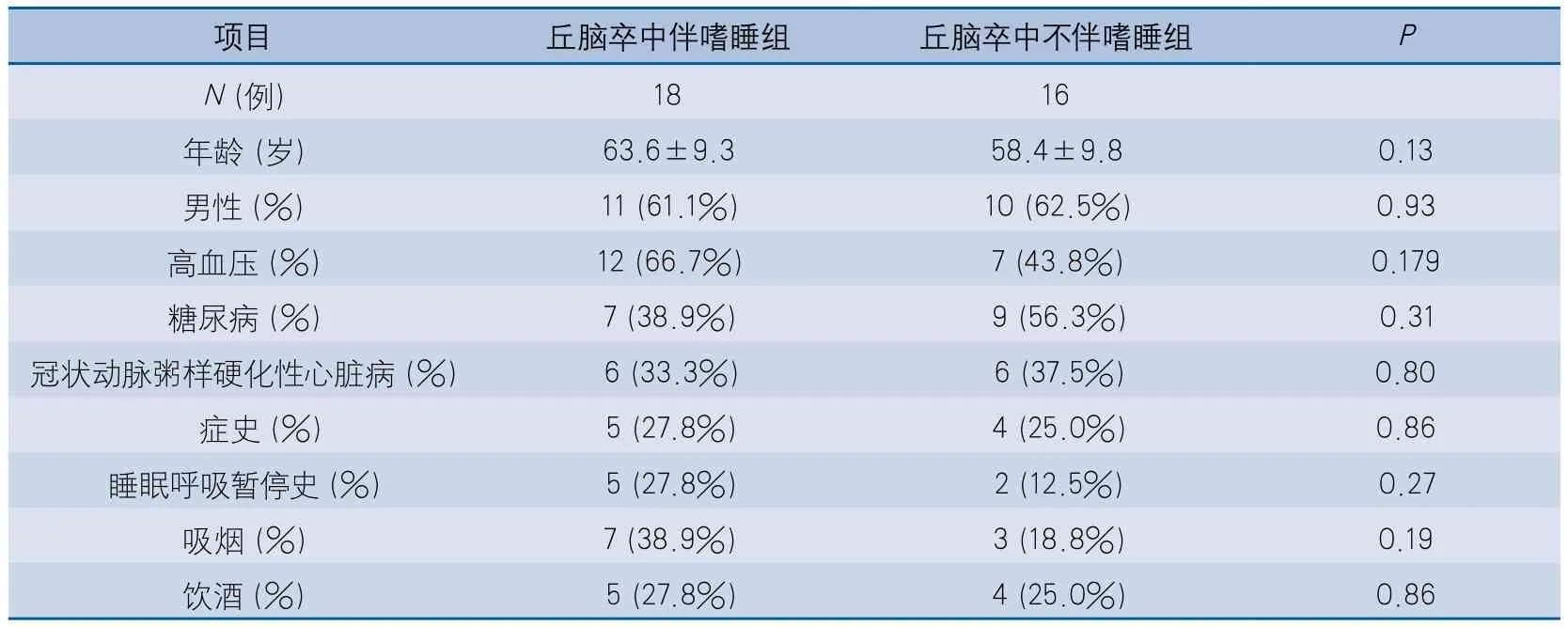
表1 丘脑卒中伴/不伴嗜睡基线资料对比
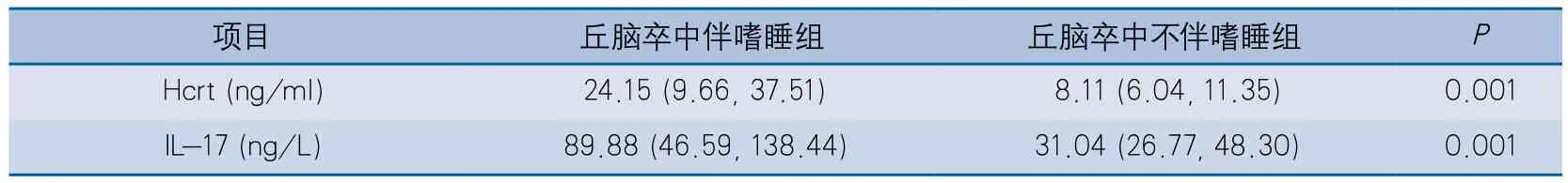
表2 丘脑卒中伴/不伴嗜睡患者Hcrt、IL-17的浓度变化比较
Hcrt由广泛分布于外侧下丘脑中的神经元产生,并与中枢神经系统有广泛的纤维投射[10-18]。这对清醒和快速眼动睡眠的调控十分重要。而国内外尚未见关于丘脑卒中后血浆中Hcrt变化的相关报道。国外学者Vogel等[19]认为去甲肾上腺素能神经元和5-羟色胺(5-hydroxy tryptamine,5-HT)能神经元胞体位于脑干,其轴突通过丘脑及基底节达到额叶皮质,当病灶累及以上部位时,可影响区域内的去甲肾上腺素能和5-HT能的神经通路,导致去甲肾上腺素和5-HT的含量下降,从而产生睡眠-觉醒障碍。本研究结果显示,丘脑卒中伴嗜睡组的血浆Hcrt含量明显高于丘脑卒中不伴嗜睡组,这可能与血脑屏障、体内应激所产生的毒性介质有关。研究表明,Hcrt神经元与谷氨酸能、酪氨酸能、多巴胺能和胆碱能神经元之间有着高度的联系[20-21]。Hcrt系统既可对皮层神经元兴奋性发挥直接调节作用,又可通过调节胆碱和单胺类觉醒纤维对皮层神经元兴奋性发挥间接调节作用[22]。后者主要是由于Hcrt向大脑和脊髓弥散性投射,激活丘脑-皮层、皮层-基底系统和其他的下丘脑和脑干唤醒系统的神经元,激活皮层从而引起行为觉醒。因此,推测丘脑损伤时阻断上述通路,扰乱神经递质间的相互调节,从而干扰睡眠-觉醒的调节。
大量实验表明,Hcrt不仅在下丘脑表达,在内脏中也被发现,从而认为其在人体中是系统循环的[23]。但动物实验表明,Hcrt-1很容易透过血脑屏障,而在人类这貌似不太容易实现[24]。研究发现,卒中尤为丘脑卒中患者及发作性睡病的患者脑脊液中Hcrt的含量较正常对照组明显降低,而本研究发现丘脑卒中后嗜睡患者血浆中的Hcrt反较不伴嗜睡者高,这可能与丘脑卒中后脑中Hcrt神经元减少较其他组更多,从而激活交感神经系统和γ-氨基丁酸(gamma-aminobutyric acid,GABA)的表达,进而刺激外周Hcrt的表达[25]有关。但本研究仅局限于小样本临床研究,受实验条件限制,患者病情较轻,且未能对脑中各部分进行相关实验研究,嗜睡者Hcrt的信使核糖核酸(messenger ribonucleic acid,mRNA)表达是否增加,以及与Hcrt相关的神经递质是如何调节的仍未可知,仍需要进一步的研究加以证实。
IL-17不仅是一类在缺血性卒中后炎症反应中起重要作用的促炎性细胞因子,同时也参与睡眠的免疫调节机制。研究表明,IL-17能够诱导上皮细胞、巨噬细胞分泌IL-6,且IL-17 mRNA表达上调可诱导IL-6、IL-1、肿瘤坏死因子α、C反应蛋白(C-reactive protein,CRP)的表达,从而加重脑缺血后继发性炎性反应[26-28]。在敲除IL-1受体的脑特殊装载蛋白的小鼠中,非快速眼动睡眠轻度延长且快速眼动睡眠轻度减少,认为IL-1β有调节睡眠的作用[25]。并且Taku等[29]对194例无症状性脑梗死(3例丘脑)人群的研究发现其血清中IL-6、CRP升高。本研究结果显示,丘脑卒中伴嗜睡组的血浆IL-17浓度较丘脑卒中无嗜睡组明显增高,可能与脑损伤激发了IL-17的表达,IL-17诱导睡眠相关细胞因子的过度表达,从而产生睡眠障碍有关;或者丘脑卒中IL-17所诱导的炎症反应,可能进一步损害丘脑组织,从而破坏与睡眠相关的神经递质的表达及神经环路的完整性,加重睡眠障碍。但这尚未有相关文献证实,仍需进行相关研究进一步探索。
本研究为小样本、单中心的预探索研究,且受相关实验条件及患者病情的限制,存在不足与缺陷,仍需进一步扩大样本量对其结果的可靠性行进一步的探索。
1 Lee SJ, Kim JS, Song IU, et al. Poststroke restless legs syndrome and lesion location:anatomical considerations[J]. Mov Disord, 2009, 24:77-84.
2 夏建霞. Orexin-A兴奋大鼠皮层神经元的细胞机制[D]. 重庆:第三军医大学, 2005.
3 Clinton JM, Davis CJ, Zielinski MR, et al.Biochemical regulation of sleep and sleep biomarkers[J]. J Clin Sleep Med, 2011, 7(5 Suppl):S38-S42.
4 吴逊. 全国第四届脑血管病学术会议纪要[J]. 卒中与神经疾病, 1997, 4:51-55.
5 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2010年版)[J]. 中国医学前沿杂志(电子版), 2011,4:54-109.
6 陈改玲, 刘国仗. 关于高血压定义与分类的修订建议[J]. 中华老年多器官疾病杂志, 2003, 2:258-259.
7 苗海军, 周晓辉, 钟小兰. Alzheimer病危险因素病例对照研究[J]. 新疆医科大学学报, 2006,29:1146-1149.
8 Sil A, Barr G. Assessment of predictive ability of Epworth scoring in screening of patients with sleep apnoea[J]. Laryngol Otol,2012, 126:372-379.
9 邓丽影. 脑卒中后觉醒障碍[J]. 中国现代神经疾病杂志, 2013, 13:476-480.
10 Johnson PL, Samuels BC, Fitz SD, et al.Activation of the orexin 1 receptor is a critical component of CO2-mediated anxiety and hypertension but not bradycardia[J].Neuropsychopharmacology, 2012, 37:1911-1922.
11 Johnson PL, Shekhar A. An animal model of panic vulnerability with chronic disinhibition of the dorsomedial/perifornical hypothalamus[J]. Physiol Behav, 2012, 107:686-698.
12 Bharadwaj KN, Spitz C, Shekhar A, et al.Computational fluid dynamics of developing avian outflow tract heart valves[J]. Ann Biomed Eng, 2012, 40:2212-2227.
13 Donner NC, Johnson PL, Fitz SD, et al.Elevated tph2 mRNA expression in a rat model of chronic anxiety[J]. Depress Anxiety, 2012,29:307-319.
14 Shekhar A. Many faces of orexin/hypocretin[J].Prog Brain Res, 2012, 198:1-4.
15 Bolbecker AR, Shekhar A. Muscarinic agonists and antagonists in schizophrenia:recent therapeutic advances and future directions[J].Handb Exp Pharmacol, 2012, 208:167-190.
16 Shamoon H, Center D, Davis P, et al.Preparedness of the CTSA's structural and scientific assets to support the mission of the National Center for Advancing Translational Sciences (NCATS)[J]. Clin Transl Sci, 2012, 5:121-129.
17 Hale MW, Shekhar A, Lowry CA. Stressrelated serotonergic systems:implications for symptomatology of anxiety and affective disorders[J]. Cell Mol Neurobiol, 2012,32:695-708.
18 Pizza F, Magnani M, Indrio C, et al.The hypocretin system and psychiatric disorders[J]. Curr Psychiatry Rep, 2014,16:433.
19 Vogel CH. Assessment and approach to treatment in post-stroke depression[J]. J Am Acad Nurse Pract, 1995, 7:493-497.
20 高文文, 秦升, 孔令超, 等. Hypocretin的研究新进展[J]. 医学综述, 2010, 8:2425-2427.
21 de Lecea L, Huerta R. Hypocretin (orexin)regulation of sleep-to-wake transitions[J].Front Pharmacol, 2014, 5:16.
22 胡志安, 夏建霞. 觉醒系统的活动对学习记忆的影响[J]. 第三军医大学学报, 2011, 33:1091-1094.
23 Kirchgessner AL, Liu M. Orexin synthesis and response in the gut[J]. Neuron, 1999, 24:941-951.
24 Dalal MA, Schuld A, Haack M, et al. Normal plasma levels of orexin A (hypocretin-1) in narcoleptic patients[J]. Neurology, 2001,56:1749-1751.
25 Kitamura E, Hamada J, Kanazawa N, et al.The effect of orexin-A on the pathological mechanism in the rat focal cerebral ischemia[J]. Neurosci Res, 2010, 68:154-157.
26 Miossec P, Kolls JK. Targeting IL-17 and TH17 cells in chronic inflammation[J]. Nat Rev Drug Discov, 2012, 11:763-776.
27 Huang SH, Frydas S, Kempuraj D, et al.Interleukin-17 and the interleukin-17 family member network[J]. Allergy Asthma Proc, 2004,25:17-21.
28 Shichita T, Hasegawa E, Kimura A, et al. Peroxiredoxin family proteins are key initiators of post-ischemic inflammation in the brain[J]. Nat Med, 2012, 18:911-917.
29 Hoshi T, Kitagawa K, Yamagami H, et al.Relations of serum high-sensitivity C-reactive protein and interleukin-6 levels with silent brain infarction[J]. Stroke, 2005, 36:768-772.
