血液透析患者透析间期颅内动脉血流动力学变化的临床研究
2015-01-23耿培宏罗洋
耿培宏,罗洋
来自美国肾脏数据系统(the United States Renal Data System,USRDS)的数据显示,卒中已成为血液透析(hemodialysis,HD)患者主要终点事件之一[1]。北京血液透析质量控制中心统计结果也表明,HD患者卒中发生率仅次于心血管并发症而位居第二[2]。该并发症可能与HD患者容量负荷过重、毒素蓄积、营养不良、贫血以及动脉粥样硬化等因素有关[3-4]。此外,透析中除水造成的颅内血流动力学骤变可能是卒中发生的重要原因[5-6]。但是,对HD患者血流动力学改变的研究多集中于透析过程中的指标变化,透析间期颅内动脉血流动力学变化特征及其相关影响因素目前尚未完全阐明。本研究采用经颅多普勒超声(transcranial duplex sonography,TCD)方法对HD患者透析间期颅内血流动力学变化特征进行临床评估。
1 对象与方法
1.1 研究对象 于2011年5月~2013年5月连续性收集首都医科大学附属北京天坛医院肾内科HD患者30例;病例入选标准:①各种原因进入终末期肾脏病行维持性HD≥3个月患者;②年龄≥18岁。病例排除标准:①既往有颅内疾病病史;②合并其他可能影响颅内动脉血流的疾病,如心肺功能不全等;③病情过重或精神障碍等不能配合超声检查的患者。另外选择年龄、性别匹配因其他诊断需要行TCD检查且肾功能正常的28例门诊患者为对照组。已向所有患者解释研究内容并已签署知情同意书。
1.2 仪器与方法 采用美国飞利浦公司IU22型彩色超声诊断仪,探头频率2.0 MHz。选择双侧大脑前动脉(anterior cerebral artery,ACA)、大脑中动脉(middle cerebral artery,MCA)、大脑后动脉(posterior cerebral artery,PCA)以及基底动脉(basilar artery,BA)的平均血流速度(mean blood flow velocity,MV)、阻力指数(resistance index,RI)和搏动指数(pulsatility index,PI)作为颅内动脉血流动力学评估指标;所有透析患者均在前次透析结束24 h后行TCD检测。取仰卧位,于颞窗依次探测MCA、ACA、PCA主干,调节探头方向和深度,深度范围MCA为50~55 mm、ACA为55~65 mm、PCA为60~70 mm,显示清晰频谱后冻结图象并保存,由TCD自带分析软件测算出收缩期峰值速度(Vs)、舒张期峰值速度(Vd)和峰值平均血流速度(Vm)。RI计算公式为:RI=(Vs-Vd)/Vs[7]。PI计算公式为:PI=(Vs-Vd)/Vm[8]。为减少实验误差,对全部患者双侧颅内动脉相关指标进行测量,获取平均值进行比较。同时记录患者入组时的基线资料。患者各种基线指标的诊断标准以人民卫生出版社出版的《诊断学》第7版为准[9]。
1.3 统计学分析 采用SPSS 17.0统计软件进行统计分析。连续变量首先行正态性检验,符合正态分布的连续变量以均数±标准差表示,非正态分布连续变量以中位数和四分位数表示,计数资料百分比表示。连续变量比较采用t检验及Mann-Whitney U检验,非计数资料之间比较采用χ2检验。因本研究患者例数较少,故采用多因素Logistic回归评价HD患者颅内动脉血流动力学改变的风险因素。P<0.05为差异具有显著性。
2 结果
2.1 HD组及对照组患者一般情况比较 HD组共30例(男18例,女12例),年龄34~68岁,平均年龄(56.3±10.1)岁;对照组共28例(男17例,女11例),年龄37~66岁,平均年龄(46.1±9.7)岁。两组患者基线资料中,糖尿病、高血压患病构成比差异具有显著性(P<0.05);血红蛋白、血清白蛋白、血清总胆固醇水平具有显著性差异(P<0.05);其余基线指标差异均未见显著性(表1)。
2.2 颅内动脉血流动力学指标比较 与对照组比较,HD组ACA、MCA、PCA、BA的MV均升高(P<0.05);两组间RI和PI变化差异未见显著性(表2)。
2.3 颅内动脉平均血流速度相关风险因素分析对HD患者与对照组之间存在差异的初始变量进行多因素Logistic回归分析显示,贫血及高血压的HD患者大脑ACA、MCA、PCA及BA血流速度增加的风险比值比(odds ratio,OR)及95%可信区间(confidence interval,CI)增加(P<0.05);而低白蛋白血症、高胆固醇血症、糖尿病的HD患者颅内动脉MV增加的风险增加未见显著性(表3)。
3 讨论
卒中是HD患者最常见的并发症之一,寻找相关风险因素及有效干预措施的研究一直备受关注[10]。本研究结果表明,HD患者透析间期大脑前、中、后及基底动脉平均血流速度均出现显著性增加;而各动脉RI及PI与对照组比较增加未出现显著性。多因素Logistic回归分析显示,贫血及高血压与HD患者大脑前、中、后及基底动脉血液流速增加相关。
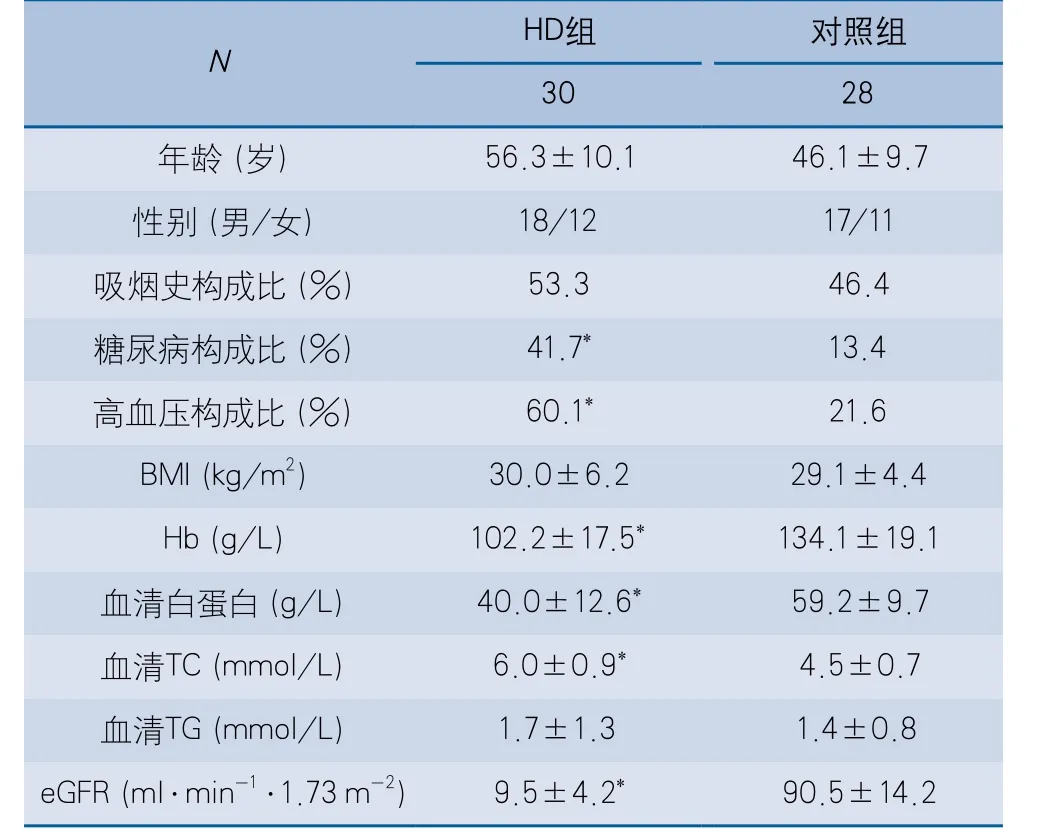
表1 HD组及对照组临床基本特征比较
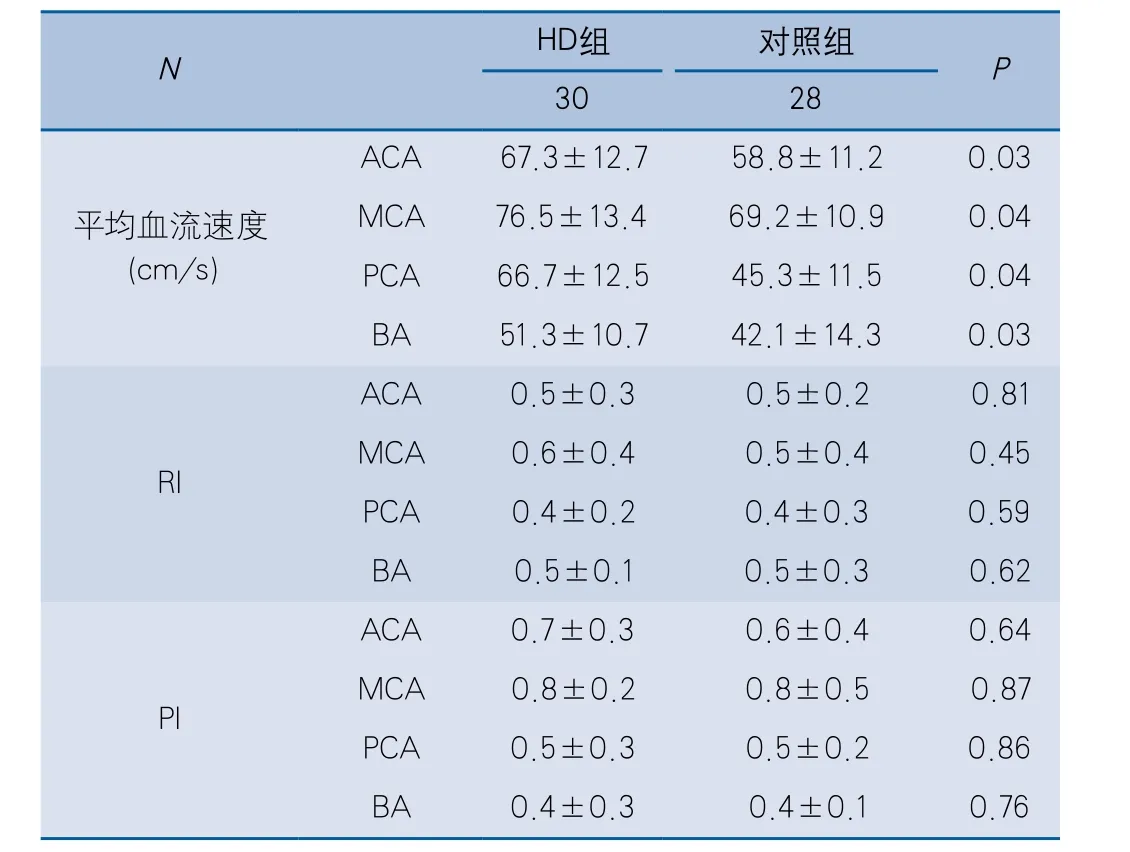
表2 HD组及对照组颅内动脉血流动力学特征比较
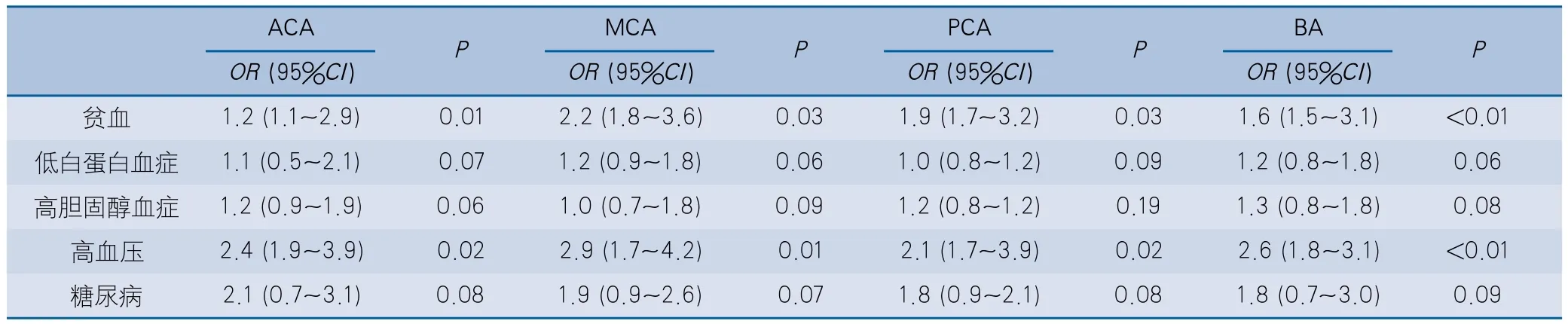
表3 HD组患者颅内动脉血液流速增加风险因素的多因素Logistic回归分析
美国USRDS和北京血液净化质控中心数据库的资料均显示,HD患者心、脑血管事件中卒中占其中的40%~50%[1-2]。既往研究显示,HD患者动脉粥样硬化、贫血、血压波动以及透析相关的水、钠潴留和毒素蓄积均与卒中发生有关[11-12]。由于HD患者每周均需要接受10~12 h透析治疗,其体内血流动力学变化在透析过程中明显增强,因此,HD患者颅内动脉血流动力学变化在卒中发生中的作用得到深入研究。Mertens等[13]首先报道了长期HD患者大脑中动脉血流量增加的现象,但是,作者未对上述现象的危险因素进行分析。Kuwabara等[14]也通过同位素15氧与计算机显影技术相结合证实了长期HD患者脑血流量增加的现象。同时,该研究还显示贫血与此类患者脑血流量增加显著相关。但是,上述研究方法均为静态测量研究,无法反映颅内动态血流变化。
TCD在评价颅内血流量方面的应用提示,该方法具有简单、无创、可重复及较高准确性等优点[15]。本研究通过TCD对颅内动脉血流速度进行检测发现,HD患者大脑前、中、后及基底动脉平均血液流速均较正常对照组显著增加,贫血及高血压HD患者颅内动脉血流平均速度增加风险显著增强。同时,对于对照组受检者而言,其颅内各动脉的平均血液流速未见显著性升高。鉴于透析间期的时程是透析治疗期的14~16倍,此期间颅内动脉血液流速增加可能对卒中的发生起到重要作用。上述血流动力学改变既有可能是HD患者贫血造成脑缺氧的一种代偿反应,也可能是透析间期水、钠潴留和血压升高的一种反应,上述变化一定程度上反映了HD患者特殊的病理生理状态以及治疗模式对颅内动脉血流动力学带来的影响。
此外,本研究中HD患者RI和PI增加均未见显著性。RI、PI均反映某一横断面的血管顺应性和弹性阻力,因此,通常可以间接反映实质性脏器损害程度,RI>0.8时多提示有实质损害的发生[7-8,16]。本研究中患者RI表明,HD患者虽然存在动脉粥样硬化、糖尿病等基础疾病,但是,尚未出现明显的脑实质损伤。
本研究通过对照研究证实了HD患者颅内动脉平均血流速度增加的现象,为研究此类患者卒中发病机制提供了部分新线索。但是,本研究仍具某些局限。本研究样本含量较少,研究没有随访观察到HD患者颅内血流增加与预后之间的关联,上述问题有望在后续大样本前瞻性队列研究中进行验证。
综上所述,本研究结果表明,HD患者与肾功能正常者比较,颅内动脉平均血流速度增加,而颅内各动脉RI、PI未见显著增加。本研究结果为进一步阐明此类患者卒中的发病机制提供了部分证据。
1 Murray AM, Seliger S, Lakshminarayan K, et al. Incidence of stroke before and after dialysis initiation in older patients[J]. J Am Soc Nephrol, 2013, 24:1166-1173.
2 李明旭, 陈洪, 周春华. 2007年北京地区在透析血液透析患者进入透析时心脑血管合并症-BJHDQCIC统计结果分析[J]. 中国血液净化, 2010, 9:227-229.
3 Chan CT, Jain V, Picton P, et al. Nocturnal hemodialysis increases arterial baroreflex sensitivity and compliance and normalizes blood pressure of hypertensive patients with end-stage renal disease[J]. Kidney Int, 2005,68:338-344.
4 Toyoda K, Fujii K, Fujimi S, et al. Stroke in patients on maintenance hemodialysis:a 22-year single-center study[J]. Am J Kidney Dis,2005, 45:1058-1066.
5 Straver B, de Vries PM, ten VBJ, et al.Intradialytic hypotension in relation to pre-existent autonomic dysfunction in hemodialysis patients[J]. Int J Artif Organs,1998, 21:794-801.
6 Straver B, De Vries PM, Donker AJ, et al. The effect of profiled hemodialysis on intradialytic hemodynamics when a proper sodium balance is applied[J]. Blood Purif,2002, 20:364-369.
7 Bai CH, Chen JR, Chiu HC, et al. Lower blood flow velocity, higher resistance index, and larger diameter of extracranial carotid arteries are associated with ischemic stroke independently of carotid atherosclerosis and cardiovascular risk factors[J]. J Clin Ultrasound, 2007, 35:322-330.
8 Krejza J, Arkuszewski M, Radcliffe J, et al.Association of pulsatility index in the middle cerebral artery with intelligence quotient in children with sickle cell disease[J].Neuroradiol J, 2012, 25:351-359.
9 陈文彬, 潘祥林. 诊断学[M]. 7版. 北京:人民卫生出版社, 2008:243-316.
10 McCallum C, Leonard M. The connection between neurosciences and dialysis:a quick neurological assessment for hemodialysis nurses[J]. CANNT J, 2013, 23:20-26.
11 Van Buren PN, Inrig JK. Hypertension and hemodialysis:pathophysiology and outcomes in adult and pediatric populations[J]. Pediatr Nephrol, 2012, 27:339-350.
12 Paneni F, Gregori M, Pignatelli G, et al.Pathophysiology of biventricular dysfunction during hemodialysis:emerging concepts[J]. Int J Cardiol, 2012, 155:478-479.
13 Stefanidis I, Bach R, Mertens PR, et al.Influence of hemodialysis on the mean blood flow velocity in the middle cerebral artery[J]. Clin Nephrol, 2005, 64:129-137.
14 Kuwabara Y, Sasaki M, Hirakata H, et al.Cerebral blood flow and vasodilatory capacity in anemia secondary to chronic renal failure[J]. Kidney Int, 2002, 61:564-569.
15 Arsovska A, Popovski A, Orovchanec N, et al.Comparative analysis between transcranial color duplex sonography and magnetic resonance angiography in patients with stroke[J]. Prilozi, 2006, 27:151-165.
16 Heyer EJ, Mergeche JL, Connolly ES Jr.Middle cerebral artery pulsatility index and cognitive improvement after carotid endarterectomy for symptomatic stenosis[J]. J Neurosurg, 2014, 120:126-131.
