微生物分步发酵法制备功能性高蛋白菌糠饲料的研究
2015-01-21王红连周群兰全卫丰张东升
■徐 淏 王红连 周群兰 蒋 益 全卫丰 张东升 谢 骏
(1.江苏省苏微微生物研究有限公司,江苏无锡 214063;2.中国水产科学研究院淡水渔业研究中心农业部淡水渔业与种质资源利用重点实验室,江苏无锡 214081)
菌糠是栽培食用菌后剩下的废料。据调查显 示,每生产1 kg的食用菌约产生3.25 kg的菌糠,我国作为食用菌生产大国,每年的菌糠产量估计不少于700万吨,如不加以充分利用,将造成资源极大浪费,甚至给环境带来严重污染[1]。作为废弃的食用菌培养料,菌糠含有较丰富的营养物质,可作为基础性饲料原料[2],国内已有许多关于菌糠用作动物饲料的报道[3-4]。但直接将菌糠用作饲料,存在粗纤维含量高、适口性差和消化吸收率低的缺陷,需要适当添加辅料进行营养平衡后才能使用,只能部分替代糠麸、鱼粉、豆饼等原料[5]。因此,如何提高菌糠的营养价值,改善其适口性和饲用性能成为当今菌糠资源化利用的研究重点。
采用微生物菌剂对菌糠进行生物发酵处理,制备发酵型菌糠是提高菌糠饲料效价的有效方法[6-7]。目前,国内发酵菌糠采用的微生物主要是乳酸菌类、酵母菌类和霉菌类,采用的方式有单菌发酵或混菌发酵,均能一定程度地提升蛋白质含量和改善饲料品质[8-10]。
食用菌对纤维素和木质素等具有较强的分解转化能力[11],产生的多糖具有一定的保健功能;酵母菌生长迅速,是生产菌体蛋白的理想微生物。目前仅见食用菌中的平菇与酿酒酵母联合发酵菌糠的报道[12],还未见灵芝与酿酒酵母联合发酵菌糠的报道,鉴于此,本文以开发新型功能性高蛋白菌糠饲料为目的,研究了灵芝与酿酒酵母菌协同发酵对菌糠蛋白和多糖含量的影响,初步建立了分步发酵菌糠的最佳工艺条件,为促进菌糠资源高值化利用提供技术依据。
1 材料与方法
1.1 材料
灵芝(保藏号:G21)、平菇(保藏号:PL10)、金针菇(保藏号:FV2)、杏鲍菇(保藏号:PE01)这四种菌由江苏省苏微微生物研究有限公司食用菌研究室提供;酿酒酵母(编号:ACCC20065)由广东环凯生物科技有限公司提供。杏鲍菇菌糠:由江苏安惠生物科技有限公司提供,菌糠经烘干粉碎,过100目筛。
1.2 培养基
食用菌斜面培养基:PDA培养基;
酿酒酵母斜面培养基:麦芽汁固体培养基;
酿酒酵母液体培养基:麦芽汁液体培养基;
食用菌液体培养基:豆饼粉20 g、玉米粉20 g、葡萄糖20 g、K2HPO41 g、MgSO40.5 g、VB 120 mg,pH值自然,蒸馏水1 000 ml;
固体发酵基础培养基:菌糠90%、麸皮8%、尿素1%、(NH4)2SO41%、料水比:1∶1.8,pH值自然,以500 g/袋,不压实,0.1 MPa、121℃条件下灭菌40 min。
1.3 试验方法
1.3.1 酿酒酵母发酵条件优化
1.3.1.1 酿酒酵母培养及接种方法
酿酒酵母经过斜面活化后,接种于酿酒酵母液体培养基,28℃、摇床转速150 r/min,恒温培养2 d,血球计数板计数后,以108个/g接种于固体发酵培养基中,28℃静置培养。
1.3.1.2 酿酒酵母发酵条件单因素试验
将影响酿酒酵母发酵菌糠的几个主要因素即麸皮、氮源、料水比、发酵时间及温度进行探讨,试验设计见表1。以固体发酵基础培养基为基础发酵条件,分别改变这5个因素进行单因素试验,其中在改变麸皮或氮源量时,菌糠含量随之增减,保持菌糠与麸皮或菌糠与氮源总量不变,其他条件不变,每个因素设5个水平,以发酵菌糠的真蛋白含量为指标,对发酵结果进行考察。
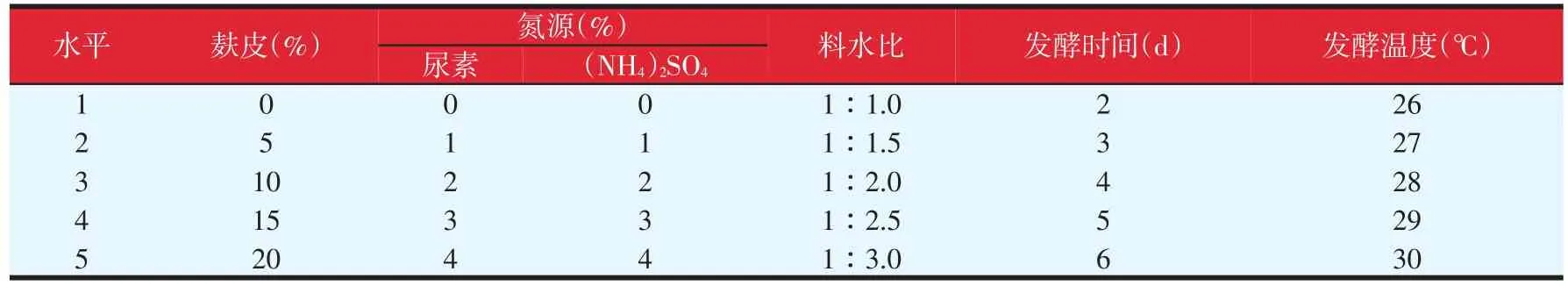
表1 单因素试验设计
1.3.1.3 酿酒酵母发酵条件正交试验设计
根据单因素试验的结果,以菌糠为基础料,通过添加适当比例的氮源(硫酸铵和尿素),来设计酵母发酵菌糠的最适培养条件。选取麸皮、料水比、氮源和发酵时间这四个关键影响因素,在28℃条件下,每组条件采用3个平行样,以发酵结束后的各组真蛋白含量的平均值为考察指标,通过4因素3水平的正交试验,筛选出酿酒酵母发酵菌糠的最佳条件。
1.3.2 食用菌品种的筛选及温度影响试验
1.3.2.1 食用菌品种的筛选
将平菇、金针菇、杏鲍菇和灵芝菌经斜面活化后,接种于100 ml食用菌液体培养基中,25℃、140 r/min旋转式摇床培养7 d后,以1∶9比例与无菌水混匀,制成菌悬液,接种于方法1.3.1筛选出的酿酒酵母发酵菌糠最佳培养基。以重量5%接种,选取各个食用菌都适合的生长温度25℃,静置培养,每两天观察其菌丝生长情况,发酵7 d后,60℃烘干测定,筛选出菌丝生长速度快,粗多糖、真蛋白含量高的食用菌品种。
1.3.2.2 温度对灵芝菌发酵菌糠的影响
采用方法1.3.1.3筛选出的最佳培养基,接种优化筛选出的灵芝菌,进行菌糠固体发酵,考察25、26、27、28℃不同温度条件下对真蛋白和粗多糖含量的影响。每组采用3个平行样,结果取其平行样的平均值。灵芝菌液体培养方法与接种方法同1.3.2.1,发酵时间为7 d。
1.3.3 不同发酵方式的对比试验
以筛选出的最优培养基,将灵芝菌与酿酒酵母进行混菌发酵,采取混菌共发酵(食用菌与酿酒酵母同时接种于固体发酵培养基中的发酵方式)、混菌分步发酵(食用菌先接种,发酵长满菌丝后再接种酿酒酵母的发酵方式)、酿酒酵母单菌发酵和灵芝单菌发酵四种发酵方式,发酵时间统一为11 d,温度28℃,以总氮、蛋白氮、无机氮、粗多糖和粗纤维为考察指标。
1.4 测定方法
1.4.1 总氮的测定方法
采用凯氏定氮法测定[13]。
1.4.2 蛋白氮及无机氮测定方法
蛋白氮的测定:按照武英利[14]方法,略有改变。称取待测样品0.5~1 g于200 ml烧杯中,加入50 ml蒸馏水,用玻璃棒搅拌均匀,在电炉上加热煮沸,加入20 ml 10%硫酸铜溶液,再加入20 ml 2.5%氢氧化钠溶液搅匀,从电炉上取下,在室温放置2 h,然后用倾泻法将样品过滤到滤纸上,用少量温水多次洗涤烧杯和沉淀物,直至洗出液无硫酸根离子(用10%氯化钡溶液来检验滤液无沉淀),连同漏斗一起放入80℃干燥箱中烘干,将滤纸和沉淀物同时放入消化管中进行消化,凯氏定氮法进行测定。
无机氮=总氮-蛋白氮;
真蛋白=蛋白氮×6.25。
1.4.3 粗多糖测定方法
粗多糖的测定参照NY/T 1676—2008[15]。
1.4.4 粗纤维含量测定方法
粗纤维含量的测定采用黄萍等[16]的方法。
2 结果与讨论
2.1 酿酒酵母发酵条件单因素试验结果
2.1.1 麸皮对酿酒酵母发酵结果的影响
麸皮作为碳源,能较快地被微生物所利用,使酿酒酵母能较快地经过适应期,麸皮不同添加量对酿酒酵母发酵结果的影响见图1。从图1可以看出,在麸皮含量0~20%的范围内,发酵菌糠真蛋白含量随着麸皮含量的增加而升高,而麸皮含量从15%提高到20%,发酵菌糠的真蛋白含量几乎没有变化,本着菌糠废弃物利用的目的,正交试验中麸皮添加量设计为5%、10%和15%。
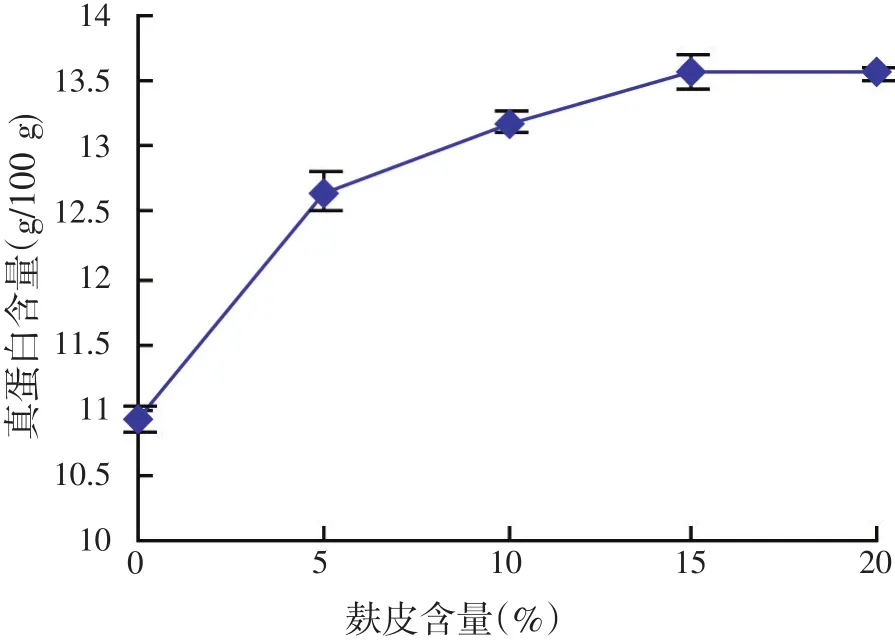
图1 麸皮对酵母发酵结果影响
2.1.2 氮源对酿酒酵母发酵结果的影响
本文考察了两种氮源即尿素和硫酸铵对发酵菌糠真蛋白的影响,结果见图2。从图2可以看出,在给定的氮源范围内,发酵菌糠真蛋白含量均是先随着氮源的添加量的增加而增加,达到一个最高值后,再随着氮源的添加量的增加而减少。尿素和硫酸铵的添加量均是在2%时,发酵菌糠的真蛋白含量最高,且真蛋白含量相近。
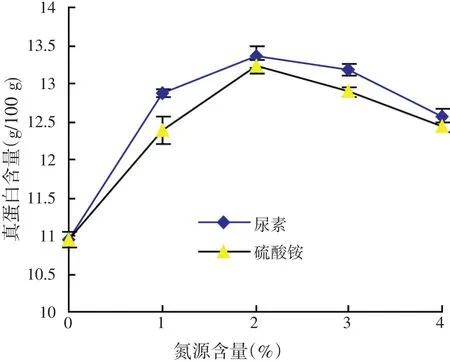
图2 氮源对酵母发酵结果的影响
2.1.3 料水比对酿酒酵母发酵结果的影响
基质的含水量是决定固态发酵成功与否的关键之一。含水量可由基质的性质、产物的类型以及微生物的需要来决定。高的含水量可导致多孔性降低、氧扩散受限制,并增加细菌污染的机会。低含水量则使基质膨胀程度降低、水张力增高,从而使生长受抑制。因此,在发酵培养基中添加不同的料水比,来考察不同含水量对酿酒酵母发酵结果的影响,结果见图3。由图3可以看出,真蛋白含量随着料水比的增大,先是增加,随后渐渐减少,料水比在1∶2.0时发酵结果最好。
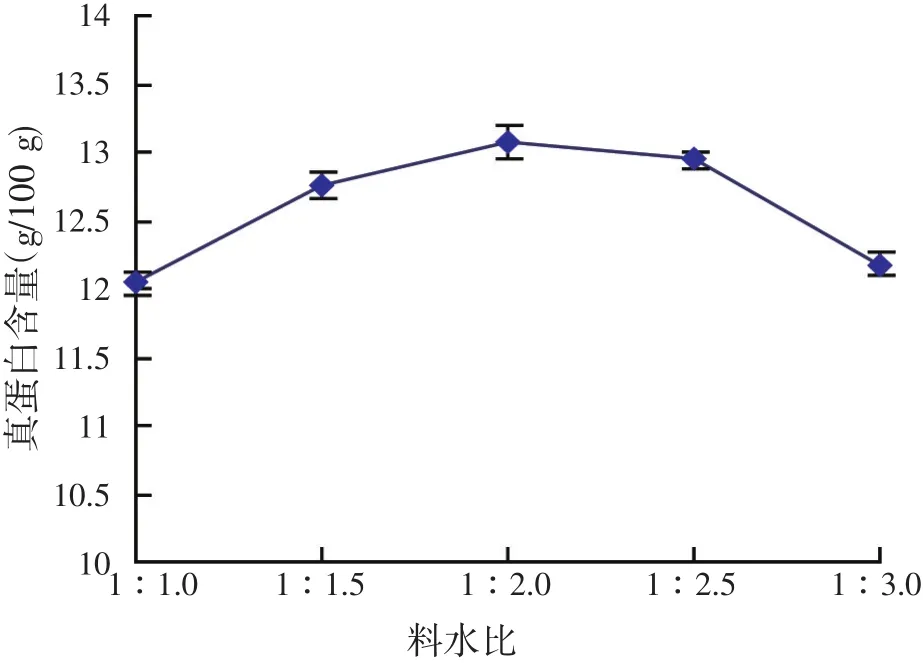
图3 料水比对酿酒酵母发酵结果的影响
2.1.4 时间对酿酒酵母发酵结果的影响
发酵时间对酿酒酵母发酵结果的影响见图4。由图4可以看出,随着发酵时间的延长,真蛋白不断增加,在发酵的第2 d到第4 d,增加的幅度较大,第5 d真蛋白的含量达到一个最高值,接着随着时间的延长,有小幅度的降低(故正交试验中选取发酵时间为4、5、6 d)。
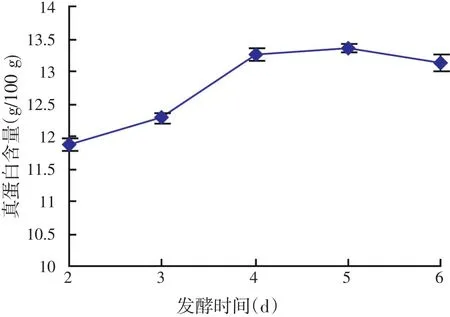
图4 时间对酿酒酵母发酵结果的影响
2.1.5 温度对酿酒酵母发酵结果的影响
温度对酿酒酵母发酵结果的影响见图5。由图5可知,随着温度的提高,真蛋白含量先是不断增加,随慢慢降低,在温度为28℃达到最高。
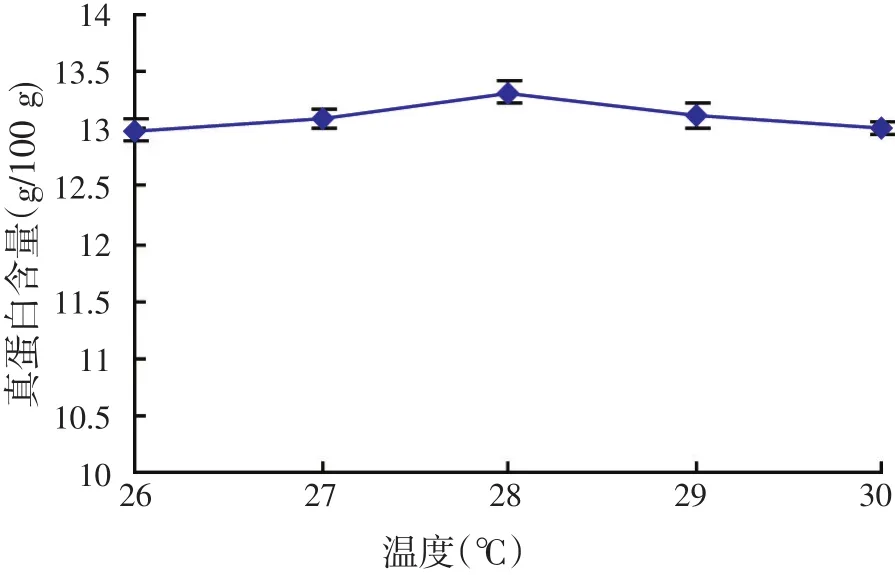
图5 温度对酿酒酵母发酵结果的影响
2.2 酿酒酵母发酵条件正交试验结果及验证试验
2.2.1 酿酒酵母发酵条件正交试验设计
正交试验设计见表2。
2.2.2 酿酒酵母发酵条件正交试验结果
菌糠对照组的真蛋白含量为9.345 g/100 g,正交试验结果见表3。由表3可知,各个组合发酵条件的真蛋白均高于对照组。通过极差分析可知,影响酿酒酵母发酵结果真蛋白含量的因素主次顺序分别为:氮源>麸皮含量>料水比>发酵时间。
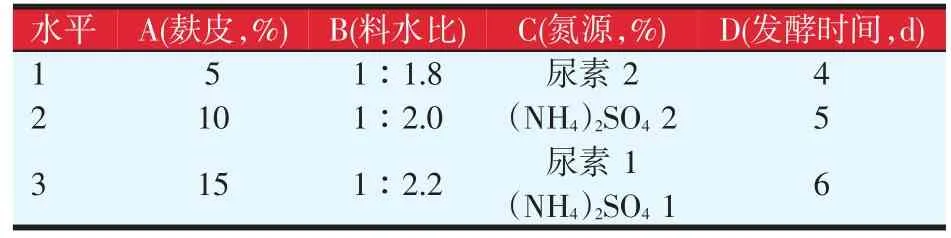
表2 发酵条件正交试验因素和水平设计
结合表2、表3,获得酿酒酵母固体发酵的最佳条件为:A2B2C1D1,即88%菌糠,麸皮含量为10%,氮源(根据试验结果确定单独添加尿素效果较好,所以选择不添加硫酸铵)(尿素)为2%,料水比1∶2.0,发酵时间为4 d。
2.2.3 酿酒酵母发酵条件验证试验
采用2.2.1中所获得的最佳发酵条件对酿酒酵母进行验证试验,共采取5个平行样,结果见表4。由表4可知,5组平行样的真蛋白结果均高于正交试验表中的数据,真蛋白平均值达到了13.97 g/100 g。
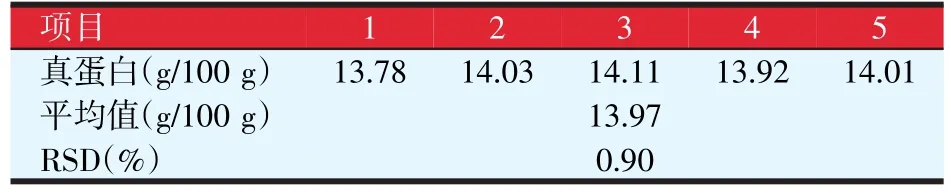
表4 酿酒酵母验证试验结果
2.3 食用菌品种的筛选及不同发酵温度的影响结果
2.3.1 食用菌品种的筛选
4种食用菌接种于2.2.2所筛选出的最佳固体发酵培养基上进行发酵,生长情况及粗多糖含量见表5。金针菇与平菇菌种生长速度较慢,灵芝菌与杏鲍菇生长速度较快,均能在7 d内长满培养基表面,但杏鲍菇菌丝体没有灵芝菌菌丝体稠密,且接种灵芝菌的粗多糖含量最高,真蛋白含量略低于杏鲍菇,综合考虑,筛选出灵芝菌,进一步与酿酒酵母进行混菌发酵。
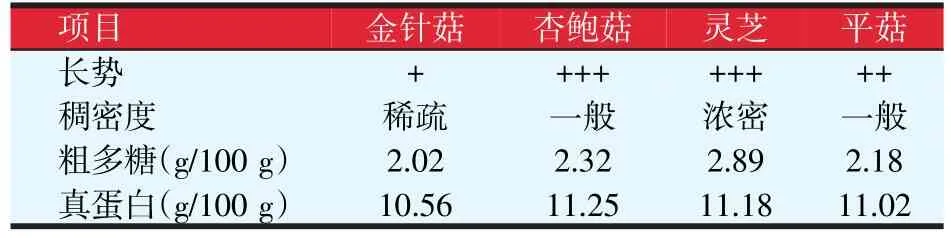
表5 四种食用菌固体发酵结果
2.3.2 不同温度对灵芝发酵菌糠的影响
采用上文酿酒酵母固体发酵的最佳培养基,考察了不同培养温度对真蛋白与粗多糖含量的影响,结果见表6。温度在25~28℃范围内,真蛋白与粗多糖含量受温度的影响较小;25℃时粗多糖含量相对较高,但无显著差异。因此综合考虑,选择28℃作为灵芝菌固体发酵菌糠的培养温度。
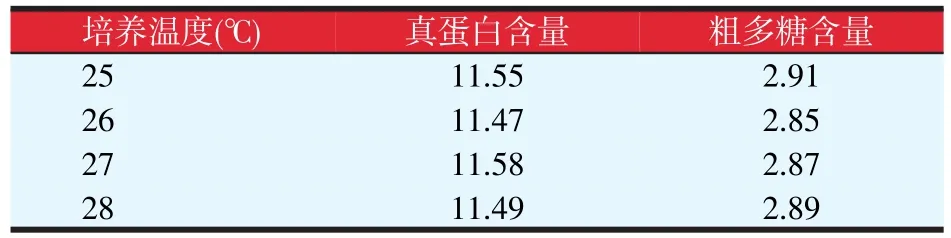
表6 培养温度对灵芝菌固体发酵菌糠的影响(g/100 g)
2.4 不同发酵方式对比试验
2.4.1 不同发酵方式对菌糠总氮、蛋白氮和无机氮含量的影响
将各种方式发酵后的菌糠、原始菌糠、固体发酵培养基分别烘干粉碎过筛后,进行总氮与蛋白氮的测定,结果见图6。
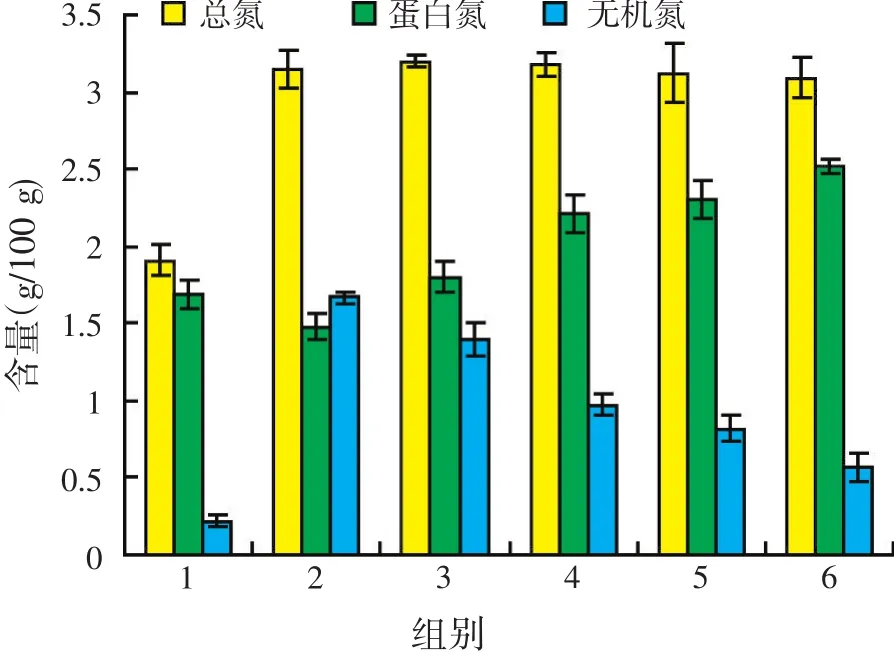
图6 灵芝与酿酒酵母不同发酵方式对菌糠总氮、蛋白氮及无机氮的影响
从图6可以看出,原始菌糠中蛋白氮和总氮相近,无机氮很少,在菌糠发酵培养基中适当添加了一定量的尿素后,大大提高了初始原料中的无机氮和总氮含量。另外,各种发酵方式下的无机氮均有一定程度的下降,蛋白氮相应提高,这表明在发酵过程中菌体利用自身的反应体系将无机氮转化成了有机氮,大大提高了氮的利用价值。比较发现,混菌发酵的蛋白氮含量均高于单菌发酵的结果,混菌共发酵后真蛋白提高了55.41%,混菌分步发酵后真蛋白提高了70.27%,混菌分步发酵增加的幅度更大,蛋白氮达到2.52 g/100 g,折合成真蛋白为15.75 g/100 g,原因可能是先接种灵芝菌后,灵芝利用菌体内各种酶的活动,将菌糠中的纤维素降解成了可利用碳源,为后接入的酿酒酵母提供了可利用的碳源,因此获得比共发酵更高的发酵产量。
2.4.2 不同发酵方式对菌糠粗纤维和粗多糖含量的影响
对上述4种发酵方式的菌糠中粗纤维与粗多糖进行了分析,结果见表7,表中的发酵方式序号与图6相同。
由表7可知,混菌共发酵(方式5)与混菌分步发酵(方式6),粗多糖含量均比灵芝单菌发酵(方式3)提高,这种提高来源于灵芝菌与酿酒酵母共同贡献的结果。方式6的粗纤维含量与方式3基本接近,这表明菌糠纤维素含量的降低可能来自于灵芝菌的生长作用,而不是酵母菌;方式5的纤维素含量相对稍高,也许是酵母菌与灵芝菌一起生长时的营养竞争,影响了灵芝菌纤维素酶的分泌。
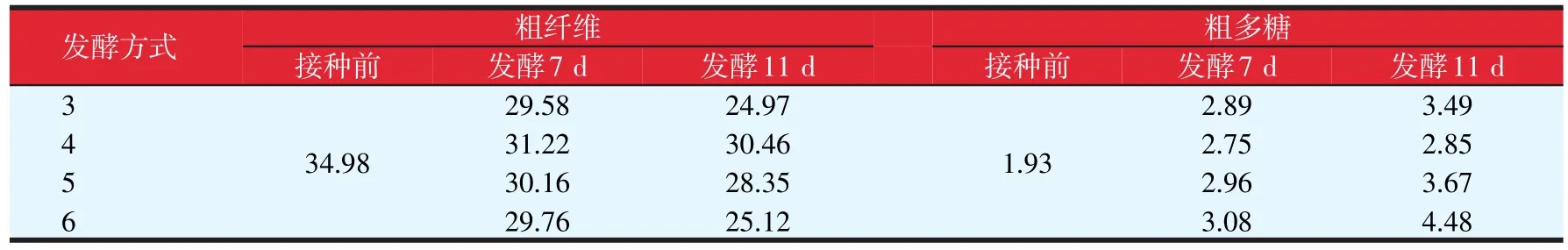
表7 不同发酵方式对菌糠粗纤维与粗多糖含量的影响(g/100 g)
3 结论
在固体菌糠的发酵过程中,微生物通过自身的生长作用,将培养基中的无机氮和有机氮转化为菌体蛋白,本文测定的真蛋白数据即包含了这部分蛋白质的含量。该数值是除去无机氮后的有机氮,因此低于已知文献采用凯氏定氮法测定的20%(甚至38%)的全氮结果(即粗蛋白含量)[17-18],但是该数值真实、客观和准确地表征了微生物生长产生的新蛋白。本文采用灵芝菌与酿酒酵母分步协同发酵杏鲍菇菌糠,真蛋白含量达15.75 g/100 g,比原始菌糠提高了68.54%,提高幅度明显。
采用本文建立的最佳工艺条件,以灵芝菌与酿酒酵母分步协同发酵杏鲍菇菌糠,粗多糖含量达4.48 g/100 g,比原始菌糠提高了132.12%。灵芝多糖是一类具有多种生理功效的活性物质,能提高动物的免疫力和抵抗疾病的能力,促进动物的生长[19]。酵母葡聚糖是一种存在于天然营养酵母细胞壁中的免疫多糖,具有抗菌及免疫调节作用[20]。酿酒酵母在发酵过程则产生浓郁的酒香味,可以改善菌糠的适口性,诱发动物的食欲,促进动物的采食。
另据报道,食用菌多糖及糖肽对动物有许多益生效果[19],而酵母蛋白又是制备营养性小肽的理想原料[21],因此,利用菌糠蛋白制备营养肽、多糖肽等生物活性肽的研究是下一步的研究方向。
