吡格列酮对大鼠冠状动脉微栓塞后心肌损伤的影响
2015-01-19杨华锋王现涛刘阳春陆元喜
杨华锋 李 浪 王现涛 刘 涛 刘阳春 陆元喜
广西医科大学第一附属医院心内科,广西南宁 530021
冠状动脉微栓塞(CME)指急性冠脉综合征(ACS)患者动脉粥样硬化斑块自发性破裂后,斑块碎片和脂质成分等致血栓成分流向远端微小血管引起微循环堵塞,也是行经皮冠状动脉治疗(PCI)的常见并发症[1]。CME 导致心肌损伤,易发生“慢血流”或“无复流”。 研究表明, 炎性因子参与的心肌组织局部炎性反应与CME 发生后心肌损伤密切相关[2]。 已证实,过氧化物酶体增殖物激活受体γ(PPARγ)激动剂的代表药物吡格列酮可抑制体外培养心肌细胞的炎性反应,起保护心肌细胞效应[3]。 吡格列酮还能抑制大鼠心肌缺血/再灌注损伤[4-5],因此,本研究观察吡咯列酮预处理对大鼠CME 后心肌组织炎性因子的影响,探讨PPARγ激动剂预防CME 致心肌损伤的作用机制。
1 材料与方法
1.1 主要试剂
42 μm 微栓塞球冻干粉(2×107个/g)购自挪威Dynal 公司;盐酸吡格列酮片(杭州中美华东制药有限公司,15 mg×7 片/盒,国药准字H20050500,批号:140702);兔抗肿瘤坏死因子-α(TNF-α)多克隆抗体、HRP 羊抗兔IgG 抗体购自北京博奥森生物公司;Trizol、反转录试剂盒购自上海生工生物工程有限公司。
1.2 实验动物模型的建立及分组
体质量200~250 g 的成年雄性SPF 级SD 大鼠,由广西医科大学实验动物中心提供 (动物合格证号:SCXK 桂2014-0002)。 参照既往文献方法[6],10%水合氯醛2.5~3.0 mL/kg 腹腔注射麻醉大鼠, 颈正中切口暴露气管,经口盲插入气管导管,连接小动物呼吸机及心功能分析仪,辅助呼吸并监测心率。 开胸暴露心脏及大血管,分离升主动脉,血管夹钳夹主动脉根部,微栓塞球0.1 mL(3×104个/mL,混悬于含十二磺基硫酸钠的生理盐水)经注射器由心尖部迅速注射至左心室,夹闭时间为10 s,待呼吸、心率正常后逐层关胸,自主呼吸恢复后拔管脱机。 将术后存活30 只大鼠随机分为单纯微栓塞组(CME 组)和吡格列酮预处理组(PIO 组),每组15 只。 另以等量生理盐水替代微栓塞球行左心室注射的15 只大鼠为假手术组(S 组)。 PIO组术前连续7 d 给予吡格列酮10 mg/kg 灌胃,1 次/d。术毕所有动物均常规腹腔注射青霉素预防感染,饲养12 h 后处死。
1.3 RT-PCR 定量测定白细胞介素(IL)-6、IL-10 及TNF-α mRNA 表达
取心室组织0.2 g 并按Trizol 试剂盒说明操作提取心室肌总RNA,用Nanodrop 测量浓度后,1%琼脂糖凝胶电泳检测示RNA 无降解后,调整RNA 浓度至1 μg/μL,行逆转录合成cDNA。SYBR GREEN Ⅰ荧光标记法检测PCR 产物,反应体系为20 μL。本实验特异性引物均由上海生工生物公司合成:IL-6 (229 bp):上游:5'-CTGCTCTGGTCTTCTGGAGT-3',下游:5'-GGTCTTGGTCCTTAGCCACT-3'。 IL-10(572 bp):上 游:5'-ACGCTGTCATCGATTTCTC-3', 下 游:5'-GCAAGTGAAAGGACACCAT-3'。 TNF-α(460 bp)上游:5'-TGGCCCAGACCCTCACA-3', 下游:5'-TGCCCGGACTCCGTGAT-3'。 GAPDH(223 bp):上 游:5'-GGCATTGCTCTCAATGACAA -3', 下 游:5' -TGTGAGGGAGATGCTCAG-3'。 反应条件:94℃变性45 s,56℃退火45 s,72℃延伸45 s,循环40 次。
1.4 Western blot 检测TNF-α 表达
取心室肌组织0.5 g 以液氮研磨法研磨组织,转移至EP 管, 加入蛋白裂解液与蛋白酶抑制剂,4℃下12 000 r/min 离心20 min,抽取上清液用BCA 法检测蛋白浓度。 然后取50 μg 蛋白样品,配制15%分离胶和5%浓缩胶, 聚丙烯酰胺凝胶电泳, 半干法转膜35 min;含5%脱脂奶粉TBST 缓冲液封闭1 h;1︰200一抗4℃孵育过夜,TBST 洗膜后以相应二抗孵育1 h;增强化学发光法显示抗原-抗体复合物, 暗室胶片显影。用GelDoc 凝胶成像系统扫描。选择GAPDH 蛋白作为内参。
1.5 统计学方法
采用SPSS 16.0 软件统计分析,计量资料以均数±标准差(s)表示,采用方差分析,组间两两比较采用LSD-t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠心肌IL-6、IL-10、TNF-α mRNA 表达水平比较
与S 组 比 较,CME 组 与PIO 组IL-6、IL-10、TNF-α mRNA 表达水平均升高, 差异有统计学意义(P <0.05);与CME 组比较,PIO 组IL-6、TNF-α mRNA表达水平下降,IL-10 mRNA 表达水平升高, 差异有统计学意义(P <0.05)。 见图1、表1。
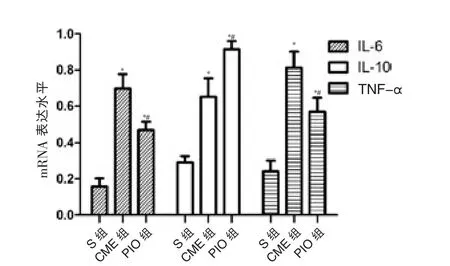
图1 各组大鼠心肌IL-6、IL-10 与TNF-α mRNA 表达水平比较
表1 各组大鼠心肌IL-6、IL-10 与TNF-α mRNA 表达水平比较(s)

表1 各组大鼠心肌IL-6、IL-10 与TNF-α mRNA 表达水平比较(s)
注:与S 组比较,*P <0.05;与CME 组比较,#P <0.05;IL-6:白细胞介素-6;IL-10:白细胞介素-10;TNF-α:肿瘤坏死因子-α;S:假手术;CME:冠状动脉微栓塞;PIO:吡格列酮
?
2.2 各组大鼠心肌TNF-α 蛋白表达水平比较
与S 组(0.61±0.20)比较,CME 组(1.74±0.34)与PIO 组(1.21±0.46)的TNF-α 蛋白表达水平均升高,差异有统计学意义(P <0.05);CME 组与PIO 组的TNF-α 蛋白表达水平比较差异有统计学意义 (P <0.05)。 见图2。
3 讨论

图2 各组大鼠心肌TNF-α 蛋白表达水平比较
CME 发生后急性期易发生心肌损伤, 病理特征为局部微小心肌梗死灶,伴随心肌标志物以及炎性因子升高,表现为灌流-收缩功能不匹配,冠脉血流储备下降,血流动力学不稳定及恶性心律失常[7]。 CME 是影响ACS 患者预后及死亡率的独立预测因素[1]。Skyschally 等[2]发现,心肌组织微梗死灶引起的炎性反应是CME 急性期导致心肌损伤的因素。
CME 后心肌炎症损伤的显著生化改变为炎性因子表达上调,且炎性因子对心肌收缩舒张功能起负性调节作用[8]。笔者在前期研究已证实,CME 发生后3 h,心肌组织局部炎性因子表达水平开始明显升高并于12 h 达到高峰[9]。 因此,本研究选择对CME 后炎性因子观察时间点为12 h。
在正常生理情况下,TNF-α、 白介素等炎性因子在心脏中含量极微,仅由内皮细胞及位于心肌组织间质的巨噬细胞等免疫细胞产生;在应激损伤刺激等特殊状态下,心肌细胞本身也可表达多种炎性因子。 研究发现,CME 后急性期显著升高的炎性因子,主要由应激状态心肌细胞本身分泌产生[10]。 TNF-α 是CME致心肌损伤的重要细胞因子。 急性期上调的TNF-α可直接抑制心脏收缩功能,激活中性粒细胞及血管内皮细胞并促进其表达黏附分子,引起中性粒细胞及淋巴细胞等免疫细胞在受损心肌组织局部募集,导致心肌组织炎症级联反应[11]。IL-6 是另一个重要的炎症因子,Nessler 等[12]研究证实,心肌缺血后IL-6 表达增加,促进氧化应激,直接介导炎性反应。 表达上调的TNF-α 与IL-6 对缺血后心肌炎性反应起协同反应作用,两者能破坏心肌微血管完整性,降低一氧化氮合成酶活性及腺苷生成,进一步加重微循环损伤[13]。 本研究检测心肌组织IL-6 与TNF-α 水平,从生化角度间接反映CME 后炎性反应及心肌损伤程度。 本实验中,大鼠CME 发生后心肌组织TNF-α 与IL-6 升高,客观反映了CME 后12 h 心肌损伤情况,CME 组较PIO 组心肌炎症损伤更严重, 提示吡格列酮对CME后心肌损伤有一定的保护作用。
IL-10 主要由Th2 与Treg 细胞分泌,在体内能抑制白介素及TNF-α 等炎性因子表达, 起拮抗炎性反应作用。 PPARγ 是属于Ⅱ型核受体超家族成员的核转录因子,参与糖脂代谢的调节,也调控体内炎性反应[14]。 研究表明,作为PPARγ 激动剂的代表药物,吡格列酮能减轻缺血/再灌注损伤, 保护内皮细胞而发挥保护心肌效应,且该效应独立于糖脂代谢的调控功能[3,15]。 本实验发现,与S 组比较,CME 组 及PIO 组IL-10 mRNA 均上升, 提示CME 发生后体内抗炎因子IL-10 基因受转录调控。 PIO 组术前7 d 连续予10 mg/(kg·d)吡格列酮预处理,与CME 组比较,IL-6 mRNA、TNF-α mRNA 及 蛋 白 表 达 水 平 降 低,IL-10 mRNA 水平增高, 说明吡格列酮减少CME 后急性期心肌组织炎性因子在转录及翻译水平的表达,减轻炎性反应。 较CME 组升高的IL-10 mRNA,提示吡格列酮可能通过一系列复杂机制上调抗炎因子的转录水平,起心肌保护作用。 研究表明,PPARγ 激动剂能激活PI3K/Akt、内皮型一氧化氮合酶(eNOS)等促生存通路、并抑制核因子-κB、丝裂原活化蛋白激酶等介导炎性反应通路的激活而减轻炎性反应[3,16],但上述通路是否参与吡格列酮对CME 后心肌组织炎性因子的表达调控,有待进一步研究证实。
综上所述,吡格列酮预处理可通过下调炎性因子IL-6 与TNF-α 的表达, 升高抗炎细胞因子IL-10 水平,从而减少大鼠CME 后心肌组织炎性反应,这种作用可能由PPARγ 介导,为防治CME 后心肌损伤提供新的思路, 深入研究PPARγ 激动剂对炎性因子表达的调控机制将具有重要价值。
[1] Heusch G,Kleinbongard P,Böse D,et al. Coronary microembolization:from bedside to bench and back to bedside [J]. Circulation,2009,120(18):1822-1836.
[2] Skyschally A,Haude M,Dörge H,et al.Glucocorticoid treatment prevents progressive myocardial dysfunction resulting from experimental coronary microembolization [J]. Circulation,2004,109(19):2337-2342.
[3] Caglayan E,Stauber B,Collins AR,et al. Differential roles of cardiomyocyte and macrophage peroxisome proliferatoractivated receptor gamma incardiacfibrosis [J]. Diabetes,2008,57(9):2470-2479.
[4] Wang H,Zhu QW,Ye P,et al. Pioglitazone attenuates myocardial ischemia-reperfusion injury via up-regulation of ERK and COX-2 [J]. Biosci Trends,2012,6(6):325-332.
[5] 赵俞,余智,卢波达,等.吡格列酮对急性缺血再灌注损伤大鼠TNF-α、IL-10 和细胞凋亡的影响[J].中国现代医生,2014,51(35):1-4.
[6] Li L,Su Q,Wang Y,et al. Effect of atorvastatin(Lipitor)on myocardial apoptosis and caspase-8 activation following coronary microembolization [J]. Cell Biochem Biophys,2011,61(2):399-406.
[7] Heusch G,Schulz R,Haude M,et al. Coronary microembolization [J]. J Mol Cell Cardiol,2004,37(1):23-31.
[8] Dörge H,Schulz R,Belosjorow S,et al. Coronary microembolization:the role of TNF-alpha in contractile dysfunction [J]. J Mol Cell Cardiol,2002,34(1):51-62.
[9] Li L,Zhao X,Lu Y,et al. Altered expression of pro- and anti-inflammatory cytokines is associated with reduced cardiac function in rats following coronary microembolization [J]. Mol Cell Biochem,2010,342(1-2):183-190.
[10] Lu Y,Li L,Zhao X,et al. Beta blocker metoprolol protects against contractile dysfunction in rats after coronary microembolization by regulating expression of myocardial inflammatory cytokines [J]. Life Sci,2011,88(23-24):1009-1015.
[11] Drabek T,Janata A,Wilson CD,et al. Minocycline attenuates brain tissue levels of TNF-α produced by neurons after prolonged hypothermic cardiac arrest in rats [J].Resuscitation,2014,85(2):284-291.
[12] Nessler J,Nessler B,Golebiowska-Wiatrak R,et al.Serum biomarkers and clinical outcomes in heart failure patients treated de novo with carvedilol [J]. Cardiol J,2013,20(2):144-151.
[13] Li J,Zhang H,Zhang C. Role of inflammation in the regulation of coronary blood flow in ischemia and reperfusion:mechanisms and therapeutic implications [J]. J Mol Cell Cardiol,2012,52(4):865-872.
[14] Liu J,Xia Q,Zhang Q,et al. Peroxisome proliferator-activated receptor-gamma ligands 15-deoxy-delta(12,14)-prostaglandin J2 and pioglitazone inhibit hydroxyl peroxide-induced TNF-alpha and lipopolysaccharide-induced CXC chemokine expression in neonatal rat cardiac myocytes [J]. Shock,2009,32(3):317-324.
[15] 申琳,王浩,叶平.吡格列酮对大鼠缺血/再灌注心肌过氧化物酶体增殖物受体γ 辅激活因子1α 表达的影响[J].南方医科大学学报,2014,34(2):197-200.
[16] Yasuda S,Kobayashi H,Iwasa M,et al. Antidiabetic drug pioglitazone protects the heart via activation of PPARgamma receptors,PI3-kinase,Akt,and eNOS pathway in a rabbitmodel of myocardial infarction [J]. Am J Physiol Heart Circ Physiol,2009,296(5):H1558-H1565.
