兔脂肪干细胞诱导的成骨细胞复合猪小肠黏膜下层构建组织工程骨膜的实验研究
2015-01-19王光楠秦书俭
王光楠 陈 艳 秦书俭
1.解放军第二〇五医院显微外科,辽宁锦州 121001;2.辽宁医学院解剖学教研室,辽宁锦州 121001
在临床工作中,骨缺损修复一直没有得到很好的解决,目前常把植骨术作为主要的方法。 植骨术可以分为3 种:自体来源植骨术、同种异体或异种植骨术以及组织工程骨植骨术。 前两种方法由于供源不足、供区损伤、移植排斥反应等影响而限制其在临床工作中的广泛应用,但是组织工程骨移植可以克服这些不足和弊端,成为骨缺损修复的新方法。 在组织工程骨移植中,种子细胞的性能与生物材料的选择,以及细胞和生物材料的复合情况是最为核心的部分,关系到组织工程产品的治疗效果,而以及生物产品在使用中的安全性等各个方面。
脂肪干细胞(adipose-derived stem cells,ADSCs)是存在于脂肪组织基质中的贴壁细胞,具有增殖能力强以及向多个方向分化的潜能[1-2]。其与骨髓基质干细胞(bone marrow stem cells,BMSCs)相近的分子生物学特性[3-4],而BMSCs 已经应用于同种异体组织工程化组织构建以及组织修复的研究,ADSCs 是否具有与BMSCs 相似的修复特性,国内外文献少见报道。 本研究旨在探讨ADSCs 诱导产生的成骨细胞与猪小肠黏膜下层(small intestinal submucosa,SIS)支架复合构建生物活性骨膜的可行性, 为进一步应用同种异体ADSCs 诱导产生的成骨细胞为种子细胞构建组织工程骨修复骨缺损提供依据。
1 材料与方法
1.1 实验对象
成年健康日本大耳白兔10 只,体重2~2.5 kg,雌雄不限。 动物由上海SLAC 实验动物有限公司提供,合格证号:2007000520595。
1.2 方法
1.2.1 制备猪脱细胞SIS、兔ADSCs 培养及构建组织工程骨膜
1.2.1.1 制备猪脱细胞SIS 采用物理方法处理及化学方法,按文献[5]方法制备脱细胞小肠黏膜下层,冻干后用环氧乙烷消毒,备用。 具体方法如下:
物理方法处理:取屠宰4 h 内经过检疫的健康成年猪的小肠,先使用清水洗净,再挑选粗细均匀的管腔管壁没有破损且无淋巴结的部位。 翻转小肠,使黏膜面向外,清除小肠黏膜层直至黏膜下层暴露,再次翻转小肠,使用包裹有纱布的刀柄去除浆膜层和肌层的组织。 用40℃水持续冲洗干净。
化学方法:按文献[5]方法制备,将经过上述物理方法处理后的小肠首先进行如下化学方法处理操作(以下所有操作均在室温进行, 处理的材料与溶液的体积比要始终保持在1∶100):将用上述物理方法处理过的SIS 浸泡在含有乙二胺四乙酸(EDTA,100 mmol/L)和氢氧化钠(100 mmol/L)溶液中,2 周后取出;然后用去离子水冲洗干净后,在含有盐酸(1 mmol/L)和氯化钠(1 mmol/L)的溶液中(pH 0~1)浸泡6~8 h;用去离子水冲洗干净后在氯化钠(1 mmol/L)的磷酸盐缓冲液中浸泡16 h;用去离子水冲洗后,在磷酸盐缓冲液中(pH 7~7.14)中浸泡2 h;再用去离子水冲洗2 h;杀菌:将SIS 在含过氧乙酸(0.1%)的乙醇溶液(20%)中浸泡8 h, 再用含0.05%叠氮化钠的磷酸盐缓冲液清洗2 h,然后程序性降温到-80℃,冻干后用环氧乙烷消毒,备用。
1.2.1.2 ADSCs 的获取、原代和传代培养及鉴定 取大白兔,麻醉取腹股沟部及肾下脂肪组织,PBS 冲洗,脂肪剪成直径为1 mm 的3 个小块, 置0.1%Ⅰ型胶原酶中,消化60 min,置于离心机以1000 r/min 离心10 min,弃去上清,采用含10%胎牛血清的培养基制成单细胞悬液,置恒温培养箱常规培养。待细胞融合达80%时,1∶2 传代,扩增培养。取第3 代细胞采用流式细胞仪检测细胞表面抗原CD29、CD34 的表达进行细胞鉴定。1.2.2.3 ADSCs 成骨诱导 对照组:取第3 代细胞,制成细胞悬液,DMEM 培养基(含50 μmol/L 抗坏血酸、10 mmol/L β-甘油磷酸钠以及0.1 μmol/L 地塞米松的)培养,每隔3 d 换液1 次。 倒置显微镜下观察细胞基本长满之后,用0.25%胰酶,0.01%EDTA 消化后进行传代培养。 实验组:培养基更换为加入成骨诱导剂的DMEM 培养基,其他步骤同对照组。
1.2.1.3 ADSCs 诱导的成骨细胞与SIS 复合 组织工程骨膜(以下用“M”表示)的复合:于操净工作台修剪SIS 与培养板6 孔和96 孔的孔径大小基本一致,取6 孔及96 孔培养板,经消毒灭菌后,每孔加入BSA(600 μL/50 μL),置于37℃,5%二氧化碳培养箱中12 h后,取由ADSCs 诱导的成骨细胞,传2 代后制成两种浓度的细胞悬液(5×104/孔、5×103/孔),分别接种于6孔和96 孔板中,置于37℃,5%二氧化碳培养箱中复合培养10 d,每3 天更换培养液1 次。 观察、检测ADSCs 复合SIS 构建的M。
1.2.2 实验结果检测
1.2.2.1 倒置显微镜下观察细胞形态 倒置光学显微镜下观察原代及传至3 代ADSCs 的生长情况以及形态变化特点。
1.2.2.2 诱导成骨细胞检测 成骨诱导第12 天, 每组取一块6 孔培养板,按照碱性磷酸酶显色试剂盒要求进行BCIP/NBT 染色,显微镜下观察拍照。 对照组处理方法及时间同实验组。
1.2.2.3 MTT 法检测细胞的生长曲线情况 用胰酶-EDTA 消化诱导后传至第2 代成骨细胞接种于96 孔培养板中,每孔细胞密度为3×103个,体积为200 μL/孔。每个培养板设10 孔为实验组,6 孔设为对照组,总共接种6 板。置于二氧化碳培养箱中培养,1、3、5、7、10 d后,各取1 板,实验组和对照组每孔加入5 mg/mL MTT,每孔20 μL,培养4 h 后,吸弃培养孔内培养液,每孔加入DMSO 150 μL,于自动酶标仪上(λ=490 nm)检测各个孔的吸光度值,数据以(s)表示,横坐标以时间,纵坐标以吸光度值制作细胞的生长曲线,观察诱导后传至第2 代成骨细胞生长情况。
1.2.2.4 检测M 中的碱性磷酸酶(alkaline phosphatase,ALP)表达情况 取M 的6 孔板,从复合培养10 d 之后,分别取0、5、10、15 d 为时间点,吸除成骨诱导培养液,先用PBS 冲洗2 次,然后在各孔中加入400 μL的1%TritonX-100 溶液,放置在4℃的冰箱中过夜之后,取出50 μL 的细胞裂解液,依据检测试剂盒说明书操作:设置空白管、标准管以及测定管;每组测定管均加入0.5 mL 的缓解液、50 μL 的细胞上清液和0.5 mL 的基质液。 在混匀之后,放置在37℃的水浴箱中孵育15 min,然后再加入105 mL 显色剂,充分混匀后,在波长为520 nm 处测定各孔的吸光度。根据相应空白管以及标准管的吸收值计算ALP 的含量,ALP=测定管吸光度/标准管吸光度×标准管含酚量(0.1×0.005)×(100/0.005),取平均值,结果用金氏单位(U/100 mL)表示。
1.3 统计学方法
采用统计软件SPSS 13.0 对数据进行分析, 正态分布计量资料以均数±标准差(s)表示,采用Oneway ANOVA 进行数据分析。 以P <0.05 为差异有统计学意义。
2 结果
2.1 SIS 大体形态学观察结果
经物理机械及化学方法处理获得的SIS 呈浅乳白色半透明薄膜状。 见图1、2。

图1 物理法制成的猪小肠黏膜下层

图2 化学处理后的干燥猪小肠黏膜下层
2.2 原代及传代细胞细胞形态学结果
原代培养的细胞在接种8 h 后,贴壁细胞为成纤维样形态细胞,ADSCs 则是悬浮在培养瓶的底部。 细胞接种24 h 后,ADSCs 达到85%贴壁, 体积开始小、形态为圆形透明状态;在2~4 d 时贴壁细胞的逐渐伸展,体积逐渐增大,外形为短梭形或多角形,细胞多数为单核,而且核仁清晰,细胞之间互相连接,形态类似成纤维细胞。 在7 d 左右细胞数量明显增多,贴壁细胞呈现团簇状或漩涡状排列状态, 部分形成细胞集落,细胞形态呈现长梭形,细胞间排列紧密,常伴有2~3 个突起,细胞核大,呈扁圆形。 在接种14 d 时,贴壁的ADSCs 汇合成单层细胞,基本铺满于整个瓶底。部分集落细胞内可见脂肪颗粒,贴壁细胞由梭形形态逐渐变为椭圆形形态。 见图3A~D。
传代后细胞呈长梭型及多角形贴壁分布,形态大小较一致,突起减少,增殖迅速,一般3~4 d 即可汇合成单层,平行或漩涡状排列。 各代细胞于形态上无明显变化。
流式细胞表型分析结果显示:贴壁细胞高表达间充质干细胞的特异性表面标志物CD29(93.58%),CD44(91.16%),仅表达少量的造血干细胞的特异性表面标志物CD34(0.96%),确定贴壁细胞为ADSCs。见图3E~G。
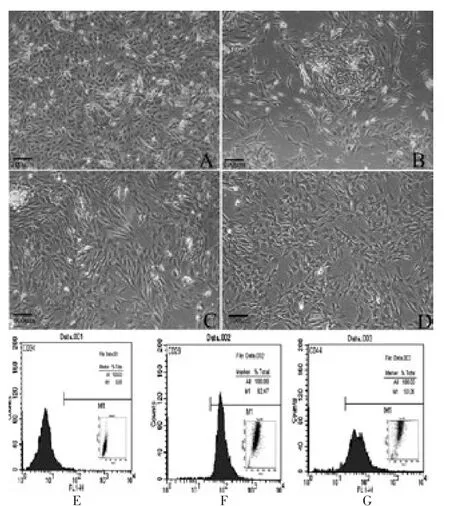
图3 倒置显微镜下脂肪干细胞一般状态观察及流式细胞鉴定结果
2.3 诱导的成骨细胞倒置显微镜观察结果
细胞在成骨细胞诱导后, 生长速度明显变慢,细胞形态逐渐由梭形变为三角形、多角形,有数个突起(图4)。 随诱导时间的延长,细胞均出现重叠生长,形成多个散在的细胞结节、基质堆积,在细胞结节中央区形成矿化结节。 对照组细胞形态无改变。
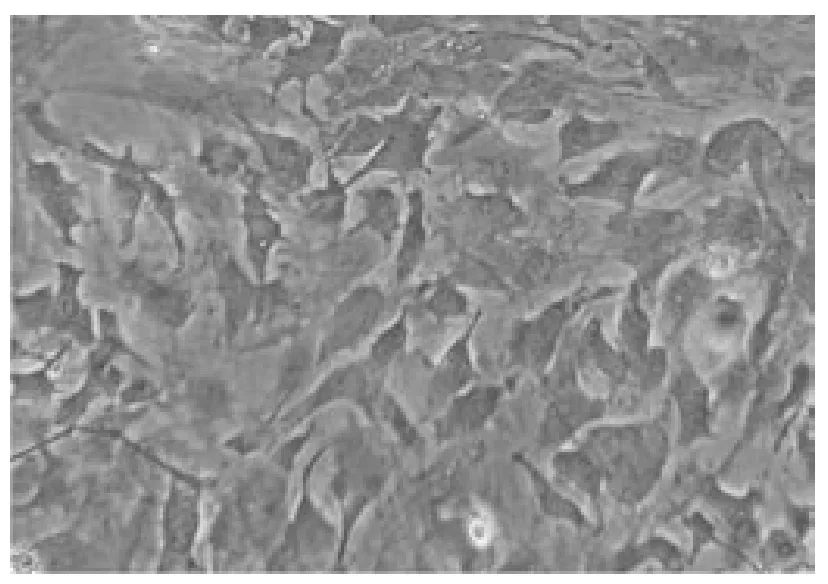
图4 成骨细胞诱导第8 天倒置显微镜下细胞形态(200×)
2.4 ALP 染色观察结果
实验组细胞ALP 表达阳性, 表现为细胞浆被染成蓝色(图5,封三)。 对照组细胞浆未被染色(图6,封三)。
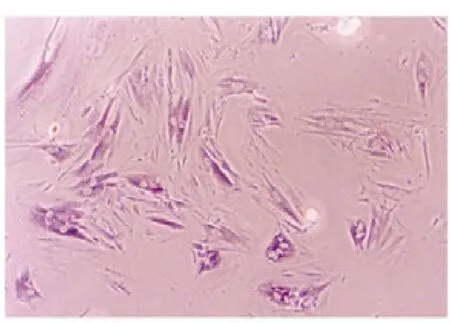
图5 实验组碱性磷酸酶染色(200×)(见内文第7页)
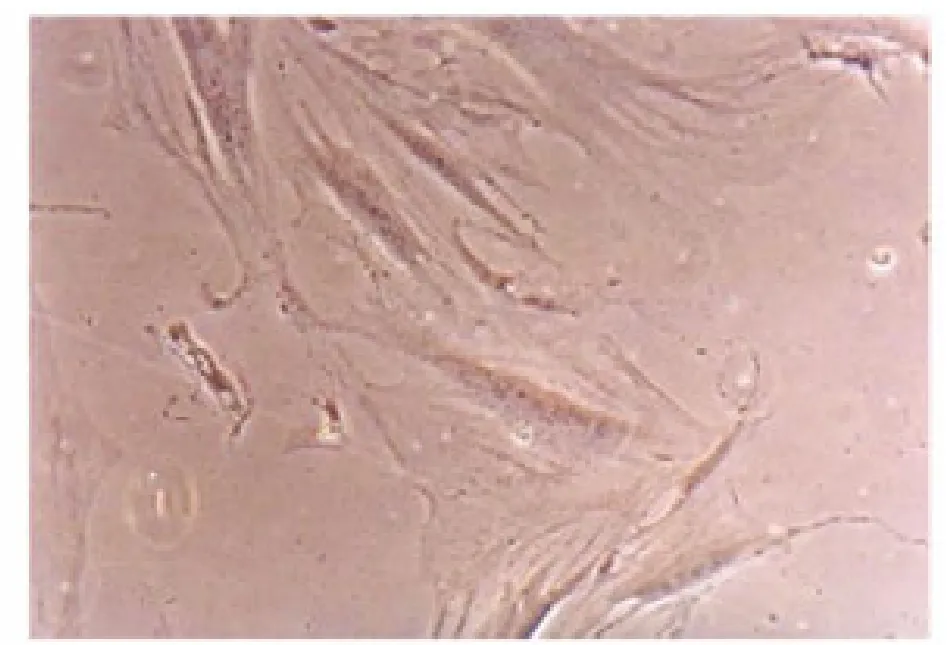
图6 对照组碱性磷酸酶染色(200×)(见内文第7页)
2.5 由ADSCs 诱导的成骨细胞生长曲线
实验组ADSCs 诱导成骨细胞在第1~5 天, 细胞数目增殖变化不大, 第7 天起细胞大量增加达到顶点,1 周后生长速度略有减慢。 见图7。

图7 脂肪干细胞诱导的第2 代成骨细胞生长曲线
2.6 M 表面细胞的生长曲线
M 表面ADSCs 诱导成骨细胞在第1~3 天, 细胞数目增殖变化不大,6 d 达到峰值, 之后速度又减慢。见图8。
2.7 ALP 定量表达结果
实验组与对照组相比,相同时间点ALP 活性明显增高,差异均有统计学意义(P <0.05)。 实验组M培养后5 d 表达明显增多,并且达到最高值,在10~15 d都有不同程度降低。 见表1。
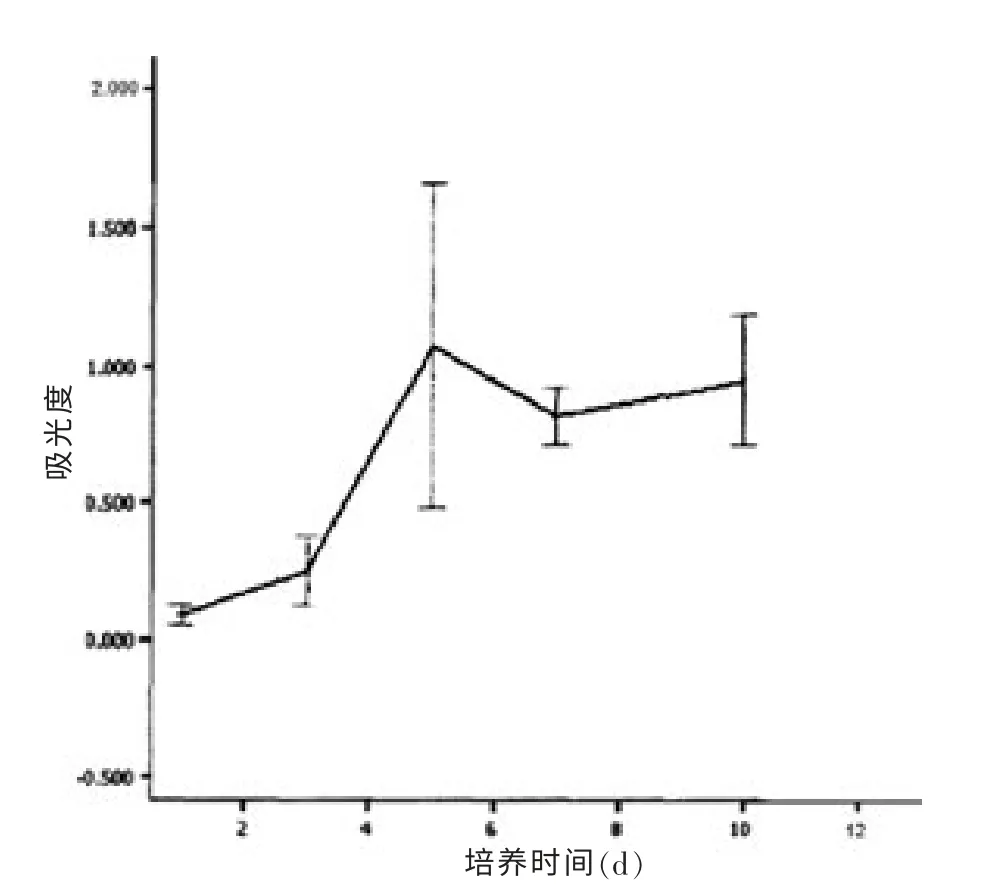
图8 组织工程骨膜表面细胞生长曲线
表1 两组不同时间点的碱性磷酸酶活性比较(n = 10,U/100 mL,s)
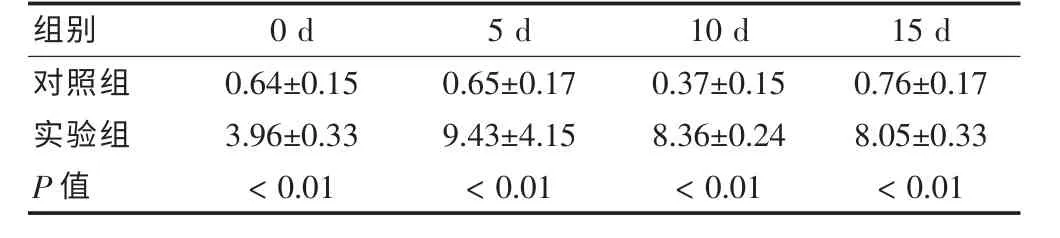
表1 两组不同时间点的碱性磷酸酶活性比较(n = 10,U/100 mL,s)
组别 0 d 5 d 10 d 15 d对照组实验组P 值0.64±0.15 3.96±0.33<0.01 0.65±0.17 9.43±4.15<0.01 0.37±0.15 8.36±0.24<0.01 0.76±0.17 8.05±0.33<0.01
3 讨论
骨组织工程的研究热点是将具备良好成骨能力的种子细胞接种到生物相容性良好、有利于种子细胞黏附生长的生物支架材料上体外复合培养,从而构建出具有成骨活性的植骨材料,即组织工程化骨。 一些实验结果显示,具有成骨潜能的种子细胞与支架材料复合有较强的成骨能力[6]。
ADSCs 在含有成骨诱导剂的特定条件下可以向成骨细胞分化[7-12]。在本实验中采用地塞米松、β-甘油磷酸钠和抗坏血酸加入到基础培养基中,作为成骨诱导分化的培养液。 地塞米松促进ADSCs 早期成骨分化是通过与干细胞上的糖皮质激素受体结合,从而激活干细胞表面的受体, 促进ADSCs 的ALP 活性表达增强。也有研究表明地塞米松通过增强其受体与基因组中靶序列的亲和力从而调控分化细胞中的基因表达,提高ALP 活性,促进成骨分化。 在成骨诱导后期地塞米松可诱导干细胞发生矿化;β-甘油磷酸钠可释放磷酸根,为提供干细胞体外诱导培养过程中发生钙沉积所需要的磷离子, 为细胞矿化提供离子环境,促进生理性钙盐沉积;抗坏血酸可以通过延长Ⅰ型胶原转录因子的半衰期从而使Ⅰ型胶原mRNA 的含量增加,促进胶原合成。 这些调控因子的联合应用为ADSCs 体外成骨诱导培养提供了良好环境[13-17]。
本研究中ADSCS 在成骨诱导后, 生长速度明显变慢,细胞形态逐渐由梭形变为三角形、多角形,有数个突起。随诱导时间的延长,细胞均出现重叠生长,形成多个散在的细胞结节,基质堆积,在细胞结节中央区形成矿化结节。
本研究将兔的ADSCS 诱导而成的成骨细胞与SIS 复合构建组织工程骨膜后进行成骨生长特性进行了实验研究。 实验结果提示诱导的成骨细胞在SIS 膜上表现为M 表面细胞的生长曲线,可见M 表面ADSCs生长情况,1~3 d 增殖缓慢。证实细胞在组织工程骨膜上生长状态很好,而且SIS 具有一定的促进成骨细胞分裂作用。
[1] Fikry EM,Safar MM,Hasan WA,et al. Bone marrow and adipose-derived?Mesenchymal stem cells alleviate methotrexate-induced pulmonary fibrosis in rat:comparison with dexamethasone [J]. J Biochem Mol Toxicol,2015,29(7):321-329.
[2] Yin Y,Zhou X,Guan X,et al. In vivo tracking of human adipose-derived stem cells?Labeled with ferumoxytol in rats with middle cerebral artery occlusion by magnetic resonance imaging [J]. Neural Regen Res,2015,10(6):909-915.
[3] Aubin JE. Osteoprogenitor cell frequency in rat bone marrow stromal populations' role for heterotypic cell—cell interaction in osteoblast differentiation [J]. Cell Tissue Res,1999,72(3):396-410.
[4] Chiou GJ,Crowe C,McGoldrick R,et al.Optimization of an injectable tendon hydrogel: the effects of platelet-rich plasma and adipose-derived stem cells on tendon healing in vivo [J].Tissue Eng Part A,2015,21(9-10):1579-1586.
[5] Abraham GA,Murray J,Billiar K,et al. Evaluation of the porcine intestinal Col layer as a biomaterial [J]. J Biomed Mater Res,2000,51(3):442-452.
[6] Kneser U,Stangenberg L,Ohnolz J,et al.Evaluation of processed bovine cancellous bone matrix seeded with syngenic osteoblasts in a critical size calvarial defect rat model [J]. Cell Mol Med,2006,3(10):695-707.
[7] Zhou H,Yang J,Xin T,et al. Exendin-4 enhances the migration of adipose-derived stem cells to neonatal rat ventricular cardiomyocyte-derived conditioned medium via the phosphoinositide 3-kinase/Akt-stromal cell-derived factor-1α/CXC chemokine receptor 4 pathway [J]. Mol Med Rep,2015,11(6):4063-4072.
[8] Pascucci L,Mercati F,Marini C,et al. Ultrastructural morphology of equine adipose -derived mesenchymal stem cells [J]. Histol Histopathol,2010,25(10):1277-1285.
[9] Edwards PC,Ruggiero S,Fantasia H,et al. Sonic hedgehog geneen hanced tissue engineering for bone regeneration [J]. Gene Therapy,2005,12(1):75-86.
[10] Girolamo L,Lopa S,Arrigoni E,et al. Human adiposederived stem cells isolated from young and elderly women:their differentiation potential and scaffold interaction during in vitro osteoblastic differentiation [J]. Cytotherapy,2009,11(6):793-803.
[11] Wall ME,Rachlin A,Otey CA,et al. Human adipose-derived adult stem cells upregulate palladin during osteogenesis and in response to cyclic tensile strain [J]. Am J Physiol Cell Physiol,2007,293(5):1532-1538.
[12] Kim YJ,Yu JM,Joo HJ,et al. Role of CD9 in proliferation and proangiogenic action of human adipose-derived mesenchymal stem cells [J]. Pflugers Arch,2007,455(2):283-296.
[13] Lin Y,Chen X,Yan Z,et al. Multilineage differentiation of adipose-derived stromal cells from GFP transgenic mice [J]. Mol Cell Biochem,2006,285(1-2):69-78.
[14] 朱肖奇,贺用礼,马雪峰,等.生物衍生骨与骨髓间充质干细胞复合修复免桡骨大段缺损[J].中国组织工程研究与临床康复,2009,13(3):417-422.
[15] Neubauer M,Hacker M,Bauer-Kreisel P,et al. Adipose tissue engineering based on mesenchymal stem cells and basic fibroblast growth factor in vitro[J].Tissue Eng,2005,11(11-12):1840-1851.
[16] 刘琴,陈芳,杨丽君,等.低温冻存对兔脂肪间充质干细胞部分生物学特性的影响[J].中国实验动物学报,2014,22(4):60-64.
[17] Baldursson BT,Kjartansson H,Konrádsdóttir F,et al.Healing rate and autoimmune safety of full-thickness wounds treated with fish skin acellular dermal matrix versus porcine small -intestine submucosa: a noninferiority study [J]. Int J Low Extrem Wounds,2015,14(1):37-43.
