硝酸溶液中铝的电化学溶解行为
2015-01-17朱礼洋林如山唐洪彬
陈 辉,朱礼洋,林如山,唐洪彬,何 辉
中国原子能科学研究院 放射化学研究所,北京 102413
硝酸溶液中铝的电化学溶解行为
陈 辉,朱礼洋,林如山,唐洪彬,何 辉*
中国原子能科学研究院 放射化学研究所,北京 102413
铝常用作核燃料的包壳材料以及辐照靶件的基体材料。研究其电化学溶解行为对于开发新型铝基体首端溶解工艺具有重要意义。研究了铝在硝酸中的阳极溶解电化学行为,并测定一系列条件下铝阳极的电化学阻抗谱、极化曲线和循环伏安曲线。结果表明:在稳态时,铝表面形成钝化膜,钝化膜的厚度随硝酸浓度的升高先下降后升高,在硝酸浓度为4 mol/L时厚度较薄;体系的温度升高、硝酸铝浓度下降都使钝化膜的厚度减小;在有极化电流作用下,升高温度、增大酸度以及增大硝酸铝浓度,都易于使膜击穿,从而实现阳极溶解;铝在硝酸中的溶解速率仅与电流强度有关,电解速率可达0.4 g/(A·h)。
后处理;铝基体;钝化膜;电化学溶解;阻抗谱
金属铝是核燃料常用的包壳材料之一,另外许多辐照靶件如UO2-Al、NpO2-Al和U-Al等都使用铝作为基体材料[1-3]。要对这些核燃料进行处理必须研发相应的铝基体溶解技术。铝是两性物质,但是在酸性条件下表面会生成一层致密的氧化铝钝化膜,会阻碍溶解的顺利进行。目前溶解铝的方法主要有在酸性条件下采用汞催化[4]和HBF4催化溶解[5],以及在碱性条件下采用混合碱NaOH、NaNO3溶解[6]。这些方法都需加入额外的试剂,会带来新的问题,如给废液的处理处置造成困难,引起设备的强烈腐蚀,使废液的盐份大大增加,因此有必要研发新的首端溶解方法。
铝在极化电流作用下会发生阳极溶解,为电化学溶解铝基体提供了可能。采用电化学溶解铝不会向体系中引入新的物质,相比前面几种方式具有良好的发展前景。目前硝酸中电化学溶解铝的研究很少,为此本工作拟对其溶解行为进行研究,为开发铝基体核燃料新型首端溶解技术提供基础数据。
1 实验部分
1.1 试剂与仪器
硝酸,分析纯,北京化工厂。高纯铝块与铝丝,纯度均大于99.9%,上海富曦机电设备有限公司,其中铝块规格为φ17 mm×5 mm,铝丝的规格为φ1 mm×20 mm。铂丝参比电极,CHI 11.5,CH instrument. Inc。铂片对电极规格为15 mm×15 mm×0.1 mm,天津艾达恒晟科技发展有限公司。
Reference 3000电化学工作站,美国Gamry公司;HX-1050恒温水浴器,北京博医康实验仪器有限公司。
1.2 实验方法
电化学测试采用三电极体系,示意图示于图1(a),包括玻璃夹套电解池、铝工作电极、铂片对电极和铂丝参比电极。体系温度通过恒温水浴器提供的循环水保持恒定,控温精度达到±0.1 ℃。铝工作电极示于图1(b),采用聚四氟乙烯封装,并采用螺纹压紧密封。与溶液接触的铝块为φ10 mm的圆面。该工作电极具有对水密封性能好,工作面固定,容易拆卸可以方便的取出铝块进行表面处理等优点。
进行电化学测试时需要对铝块进行预处理。将铝块的工作面分别在400#和2000#砂纸上打磨光亮,然后用丙酮浸泡除去表面油污,最后用去离子水冲洗干净并晾干。将上述处理过的铝块用聚四氟乙烯封装好,安放到三电极体系中。加入一定量已知浓度的硝酸,视条件改变加入不同浓度的Al(NO3)3溶液。开循环水使溶液达到设定温度,开启磁力搅拌并设置到固定的转速。待开路电位稳定后开始用电化学工作站测阻抗谱、极化曲线和循环伏安曲线。阻抗谱测定时频率范围是0.4~1×106Hz,交流幅值为10 mV,直流电位相对于参比电极为0 V。极化曲线测定时扫描速率为20 mV/s,取样时间0.5 s。循环伏安扫描速率为50 mV/s,步进1 mV。其中测阻抗谱和极化曲线均重复多次测定,直到体系足够稳定,测定图谱不再发生变化为止。铝的溶解速率测定在H型电解池中进行,电解池之间为φ13 mm×30 mm的通道,通道采用烧结多孔玻璃片隔开,防止阳极产物和阴极产物相互扩散。阳极为规格φ1 mm×20 mm的铝丝,阴极为10 mm×40 mm×1 mm的钛网,空隙率35%。电解液为120 mL硝酸溶液,随实验条件不同会加入不同浓度的硝酸铝。

1——玻璃夹套(Glass jacketed),2——铂片辅助电极(Counter electrode),3——铂丝参比电极(Pt wire reference electrode),4——铝工作电极(Al working electrode),5——磁子(Magneton)图1 用于电化学测试的三电极体系(a)和铝工作电极(b)Fig.1 Three electrode system for the electrochemical test(a) and the working electrode(b)
2 结果与讨论
2.1 阻抗谱分析
电化学阻抗谱是在电极上加一个幅值很小的交流电,连续改变频率,从而获得被测电极的阻抗特性。因为所加的交流电幅值很小,而且是交流电,正负极经历时间相同,电极基本不会被极化,是一种准稳态测定方法,可用来分析电极的表面[7-8]。
铝表面模型和等效电路示于图2。在铝基体的表面有一层致密的氧化铝膜层,然后是多孔的膜层。可用R(QR(LR))型等效电路模拟[9],该等效电路包括铝表面到溶液本体的溶液电阻Rs,溶液与电极之间电双层结构用电容C表示,因为存在“弥散效应”用等效元件Q表示,电荷转移电阻为Rt,吸附电阻为Rad以及感抗为L。其中Rt值可用于判断铝表面膜的厚度情况[10]。阻抗谱BODE图实验值与拟合结果比较示于图3。由图3可知,在频率1~40 000 Hz,实验值与计算值符合较好,说明采用R(QR(LR))等效电路模型基本能代表硝酸溶液中铝表面情况。阻抗谱用Zsimpwin软件拟合,25 ℃时不同硝酸浓度下的阻抗(Z)谱示于图4。由图4可知,采用R(QR(LR))等效电路模型模拟结果与实验值符合较好,说明所用模型基本能代表硝酸溶液中铝表面情况。阻抗谱的拟合结果列入表1。由表1可知:电荷转移电阻Rt随着硝酸的浓度先减小后增大;在硝酸浓度为4 mol/L时有极小值109.5 ohm·cm2,说明此时铝表面的致密膜层很难生成,铝块的溶解速率较快。结果表明,控制体系中硝酸的浓度能有效地加快铝块的溶解。

图2 硝酸中铝表面模型(a)与R(QR(LR))型等效电路(b)Fig.2 Model(a) and R(QR(LR)) equivalent circuit(b) for Al in HNO3 solution

c(HNO3)= 8 mol/L, 25 ℃交流电压10 mV(AC voltage 10 mV)每个频率下测量10次(10 points/decade);实线是计算值(The solid lines are the calculated value)图3 阻抗谱BODE图实验值与拟合结果比较Fig.3 Comparative results between experimental impedance spectrums BODE and fitting results

25 ℃,交流电压10 mV(AC voltage 10 mV)每个频率下测量10次(10 points/decade),0.4~1×106 Hzc(HNO3),mol/L:■——1,●——2,▲——4,▼——6,◆——8图4 不同硝酸浓度下的阻抗谱Fig.4 Impedance spectrums in different concentration of nitric acid

表1 不同硝酸浓度下的阻抗谱拟合结果Table 1 Fitting results of impedance spectrums in different concentration of nitric acid
温度对阻抗谱的影响结果示于图5,拟合计算结果列于表2。由图5和表2可知,随着温度升高,阻抗谱的容抗弧迅速减小,电荷转移电阻Rt值从25 ℃时的112.1 ohm·cm2减小到65 ℃时的8.620 ohm·cm2。说明随着温度的升高,铝表面钝化膜厚度有较大程度的减少,更容易发生阳极溶解。

c(HNO3) =4 mol/L,交流电压10 mV (AC voltage 10 mV)每个频率下测量10次(10 points/ decade),0.4~1×106 Hzt,℃:1——25,2——45,3——65图5 不同温度的阻抗谱Fig.5 Impedance spectrum in different temperature
在铝的溶解过程中,溶液中Al3+浓度不断升高,因此有必要考察Al3+浓度对铝块表面的影响。加入Al(NO3)3后阻抗谱的变化示于图6。由图6可知:阻抗的容抗弧随着时间逐渐增大,直到约70 min后体系达到稳定。这可能表明在有Al3+存在时,铝表面存在反应,使钝化膜不断增厚,而随着反应的进行,Al3+浓度越来越少,钝化膜的厚度几乎不再变化,反应趋于平衡。不同Al(NO3)3溶液达到平衡时阻抗谱示于图7。由图7可知,Al3+浓度升高电荷阻移电阻增大,钝化反应随Al3+浓度的升高而加强,导致钝化膜层越厚,即电阻越来越大。不同硝酸铝浓度下阻抗谱拟合结果列入表3。由表3可知:电荷转移电阻Rt随着硝酸铝浓度的增加而增大,说明随着硝酸铝浓度的增加,铝表面膜层厚度增厚,不利于阳极溶解。
2.2 极化曲线分析
阻抗谱反应的是准稳态下铝表面形成氧化膜的情况。因为表面形成氧化膜,要实现铝的溶解必须施加足够的电位以击穿氧化膜,为此测定了不同条件下的极化曲线。不同硝酸浓度下的极化曲线示于图8。由图8可知,正向极化曲线随着电压的升高,电流初始变化很慢,直到达到某一电位,电流迅速增大,此处即为膜的击穿电位。只有电位大于击穿电位,铝的阳极溶解才能进行。酸度为8 mol/L时,击穿电位约0.3 V,而当酸度为1 mol/L时,击穿电位约1.5 V。硝酸浓度越高,击穿电位越低,越容易溶解。而且酸度越高,自腐蚀电位也越低,说明在溶液中也易于发生腐蚀。
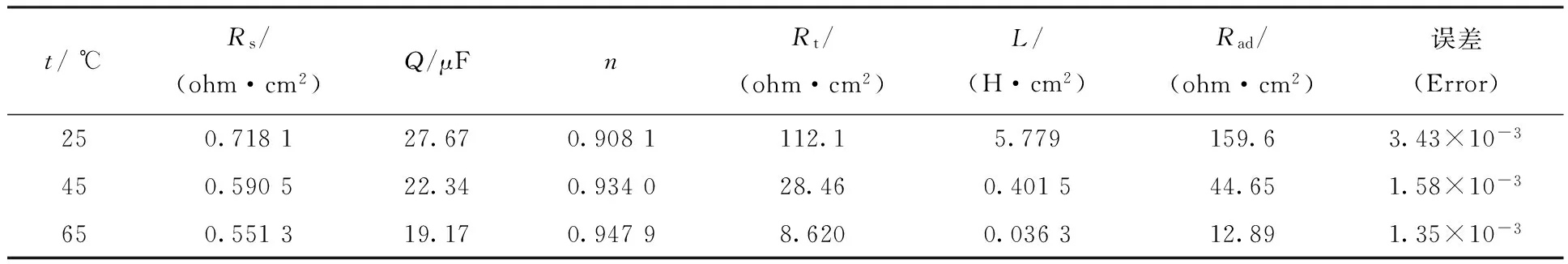
表2 不同温度下阻抗谱拟合结果Table 2 Fitting results of impedance spectrums in different temperature

4 mol/L HNO3-0.373 3 mol/L Al(NO3)3, 25 ℃交流电压10 mV(AC voltage 10 mV)每个频率下测量10次(10 points/decade),0.4~1×106 Hzt,min:■——0,●——4,▲——11▼——58,◀——66,▶——70图6 加入Al(NO3)3后阻抗谱的变化Fig.6 Change of impedance spectrums after adding Al(NO3)3

4 mol/L HNO3,25 ℃交流电压10 mV(AC voltage 10 mV)每个频率下测量10次(10 points/decade),0.4~1×106 Hzc(Al(NO3)3),mol/L:■——0.37,●——0.93,▲——1.40图7 不同硝酸铝浓度下的阻抗谱Fig.7 Impedance spectrums in different concentration of aluminum nitrate

表3 不同硝酸铝浓度下阻抗谱拟合结果Table 3 Fitting results of impedance spectrums in different concentration of aluminum nitrate

25 ℃,扫描速率20 mV/s(Scan rate is 20 mV/s)样品时间0.5 s(Sample period is 0.5 s)平衡时间5 s(Equilibrium time is 5 s)c(HNO3), mol/L:○——2,△——4,◇——8图8 不同硝酸浓度下极化曲线Fig.8 Polarization curves in different concentration of nitric acid
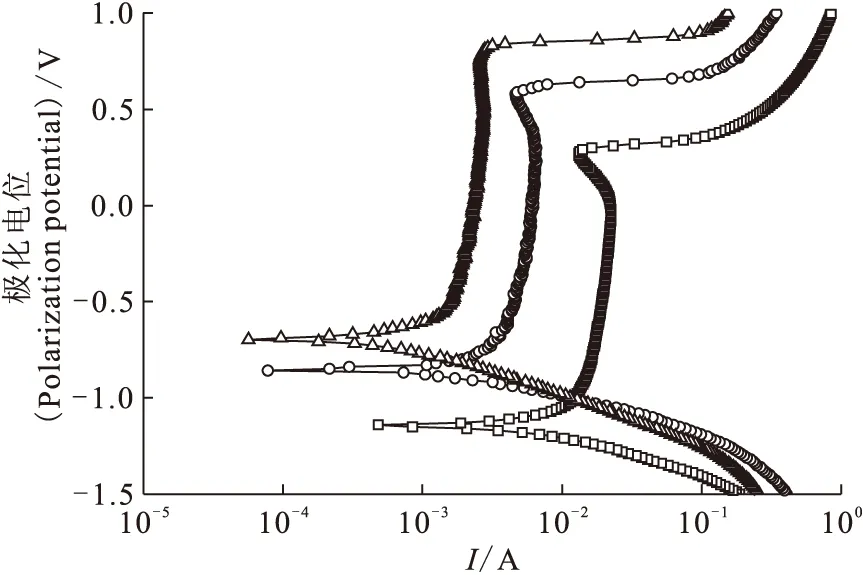
4 mol/L HNO3,扫描速率20 mV/s(Scan rate is 20 mV/s)样品时间0.5 s(Sample period is 0.5 s)平衡时间5 s(Equilibrium time is 5 s)△——25 ℃,○——45 ℃,□——65 ℃图9 不同温度下的极化曲线Fig.9 Polarization curves in different temperature
温度对击穿电位的影响示于图9。由图9可知,随着温度从25 ℃升高到65 ℃,击穿电位从0.8 V左右降到0.3 V,击穿电位明显减少,说明温度越高氧化膜越容易被击穿。分析原因:可能是由于温度升高时,氧化膜的厚度减小,并且氧化膜致密性下降,致使击穿电位明显减少。对工艺的指导意义在于升高温度有利于铝的阳极溶解。
在4 mol/L HNO3、25 ℃条件下考察了硝酸铝浓度对极化曲线的影响。在硝酸铝浓度为0.37 mol/L时,击穿电位约1.1 V。当Al3+浓度升高到0.93 mol/L后,击穿电位为0.4 V左右,且Al3+浓度进一步升高到1.40 mol/L后,击穿电位下降不大。说明铝离子浓度升高有利于降低击穿电位,但是当浓度达到一定值后,击穿电位不再显著下降。
2.3 循环伏安测试
在6 mol/L硝酸时的循环伏安曲线示于图10。由图10可以明显看到,只有当电位升高到约0.9 V时电流才显著增大,这时钝化膜被击穿,发生阳极溶解。但在回扫时,电流随电压的下降是缓慢的,说明钝化膜被击穿后电压下降仍能维持阳极溶解。但是在紧随其后的第二次扫描时,击穿电位反而略有升高,这是因为极化电流较低时,会有膜的生成。在进行循环伏安测试时可以经常观察到如图11的情形,在击穿前电流有下降的趋势,说明在有极化电流作用下,膜的厚度仍有可能增加。
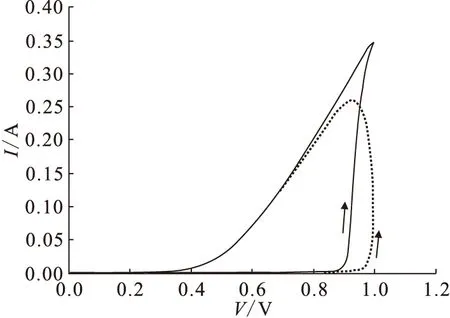
25 ℃,扫描速率50 mV/s(Scan rate is 50 mV/s)步长1 mV(Step size is 1 mV)平衡时间5 s(Equilibrium time is 5 s),6 mol/L HNO3— ——第一次扫描(First scan)… ——第二次扫描(Second scan)图10 循环伏安曲线Fig.10 Cyclic voltammograms curve
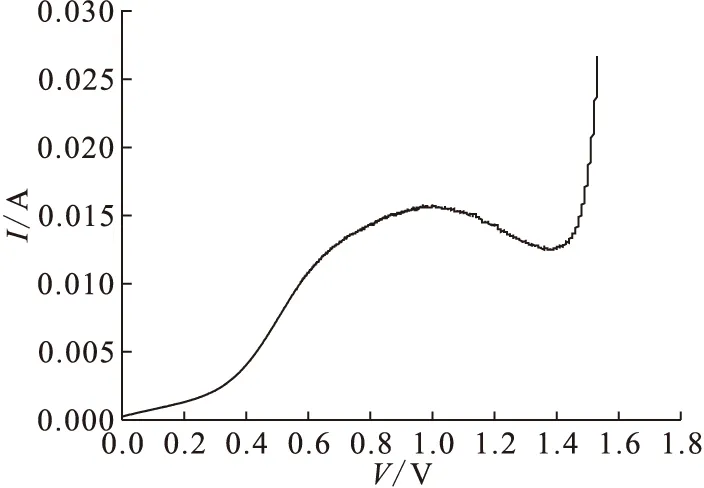
图11 极化过程中膜的生成作用Fig.11 Generation of film during polarization
2.4 溶解速率
上述结果表明,铝表面的钝化膜在极化电流作用下可被击穿从而发生阳极溶解,为了达到实际工程应用,还需要有一定的溶解速率。图12为不同酸度和电流下溶解速率。由图12可知,在研究的酸度范围内,铝的电化学溶解速率几乎不受硝酸浓度的影响,而随电流强度的增大呈线性增大趋势。在电流从0.5 A增加到3.0 A时,溶解速率从3 mg/min增加到20 mg/min。溶液中铝离子的浓度从0 mol/L增加到1.4 mol/L对溶解速率没有影响。这说明铝的溶解速率仅与电流强度成正比。溶解速率经计算可达到0.4 g/(A·h),是理论溶解速率0.34 g/(A·h)的1.19倍,电解时一部分电流消耗在分解硝酸和电解液温度增加方面,所以得到的较高的溶解速率是由于裸露的新鲜铝与硝酸的化学反应提供的。

25 ℃c(HNO3), mol/L:□——3,○——4△——5,▽——6,◁——7,▷——8图12 电流强度和硝酸浓度对铝的溶解速率的影响Fig.12 Effect electric current intensity and nitrate concentration on the dissolution rate
3 结 论
在硝酸介质中铝的表面可以形成一层氧化膜,氧化膜的厚度与硝酸浓度、溶解中铝离子浓度以及温度均有关系。在有极化电流作用下钝化膜的厚度会有增厚的趋势,直到极化电位达到膜的击穿电位,铝才开始阳极溶解。其击穿电位受硝酸浓度、铝离子浓度和温度的影响。在有强的极化电流作用下,电流强度成为影响铝溶解的主要因素,电解速率可达0.4 g/(A·h),而硝酸浓度和铝离子浓度对铝的溶解速率没有显著影响。该结果可为进一步发展铝基体燃料首端溶解工艺奠定理论基础。
[1] Sindelar R L, Zapp P E, Iyer N C, et al. Alternative aluminum spent nuclear fuel treatment technology development status report (U) , WSRC-TR-97-00345 (U)[R]. US: Savannah River Technology Center, 1997.
[2] Hofman G L, Rest J, Snelgrove J L. Irradiation behavior of uranium oxide-aluminum dispersion fuel, IL 60439-4841[R]. Argonne: Argonne National Laboratory, 1996.
[3] Idaho National Laboratory. Summary of plutonium-238 production alternatives analysis final report, INL/EXT-13-28846[R]. US: Idaho National Laboratory, 2013.
[4] Crooks Ⅲ W J, Crown J P, Dunn K A, et al. Mercury-free dissolution of aluminum-based nuclear material: from basic science to the plant, WSRC-MS-2003-00254[R]. US: Savannah River Technology Center, 2003.
[5] Mechelhoff M, Kelsall G H, Graham N J D. Electrochemical behavior of aluminium in electrocoagulation processes[J]. Chemical Engineering Science, 2013, 95: 301-312.
[6] Wham R M, Icenhour A S, Bond W D, et al. Development and evaluation study for the production of238Pu, ORNL/TM-2004/174[R]. US: Oak Ridge National Laboratory, 2004.
[7] 曹楚南,张鉴清.电化学阻抗谱导论[M].北京:科学出版社,2002:20-25.
[8] 史美伦.交流阻抗谱原理及应用[M].北京:国防工业出版社,2011:15-16.
[9] 安百刚,张学元,宋诗哲,等.LY12铝合金在模拟酸雨溶液中的阻抗谱研究[J].中国腐蚀与防护学报, 2003,23(3):167-170.
[10]方百友,卢燕平,吴继勋.6030铝型材在不同pH值硫酸溶液中的阻抗行为[J].表面技术, 1998, 27(1):19-20.
Electrolytic Dissolution of Aluminum in Nitric Acid
CHEN Hui, ZHU Li-yang, LIN Ru-shan, TANG Hong-bin, HE Hui*
China Institute of Atomic Energy, P. O. Box 275(26), Beijing 102413, China
Aluminum is one of cladding materials for nuclear fuel. It is important to investigate the electrolytic dissolution of aluminum in nitric acid. The electrochemical impedance spectroscopy, polarization curve and cyclic voltammetry cure of anodic aluminum electrode in nitric acid under various conditions were collected. It turns out, under steady state, the thickness of the passivated film of aluminum decreases with temperature while increases with the concentration of aluminum nitrate. As the concentration of nitric acid increases, the thickness of the film decreases first and then increases. Under the polarization current, increasing of temperature, as well as the concentration of nitric acid and aluminum nitrate can facilitate the breakdown of the film, thus anodic dissolution occurs. The dissolution rate is only proportional to electric current, and a current efficiency of 0.4 g/(A·h) can be obtained. Our results provide theoretical foundations for developing electrolytic dissolution technology for aluminum-based nuclear fuel head end process.
reprocessing; aluminum; passivated film; electrolytic dissolution; electrochemical impedance spectroscopy
2014-11-17;
2015-10-09
陈 辉(1978—),女,吉林吉林人,博士,副研究员,核燃料循环与材料专业
*通信联系人:何 辉(1972—),男,陕西武功人,博士,研究员,核燃料循环与材料专业
TQ133.1
A
0253-9950(2015)06-0408-07
10.7538/hhx.2015.37.06.0408
