硝基咪唑类PET肿瘤乏氧显像剂的研究总结和展望
2015-01-17王振光陈成成刘思敏
于 倩,王振光,陈成成, 刘思敏,石 彬
青岛大学附属医院 PET/CT中心,山东 青岛 266000
硝基咪唑类PET肿瘤乏氧显像剂的研究总结和展望
于 倩,王振光*,陈成成, 刘思敏,石 彬
青岛大学附属医院 PET/CT中心,山东 青岛 266000
乏氧显像剂能选择性的滞留在乏氧组织或细胞中。随着正电子发射计算机断层显像(PET)技术的发展,PET肿瘤乏氧显像可无创性评估实体瘤的乏氧状态,对肿瘤的治疗指导、疗效评价和预后判断具有重要的临床应用价值。18F-硝基咪唑(18F-FMISO)是目前广泛用于临床研究的硝基咪唑类乏氧显像剂,然而其存在某些缺点,新的硝基咪唑类乏氧显像剂正在广泛研究。本文就近年来正电子核素标记的硝基咪唑类肿瘤乏氧显像剂的研究进展进行简要概述。
肿瘤乏氧;PET;硝基咪唑类乏氧显像剂

发射正电子的核素主要有18F、68Ga、11C、13N、62Cu、15O、82Rb、122I、64Cu、124I、76Br等,其中在核医学研究以及临床工作中最常应用的正电子核素有11C、13N、15O和18F等。18F-硝基咪唑(18F-FMISO)是目前广泛用于临床研究的硝基咪唑类乏氧显像剂,在过去的20年里一直被用于肿瘤乏氧检测,是第一个用于肿瘤乏氧检测的PET乏氧显像剂,但是正常组织对18F-FMISO的清除率慢、乏氧区域和周围正常组织对比不明显、成像时间晚进而造成影像质量下降、患者等待时间长等缺点,一定程度上限制了其临床应用。因此需要在不减低乏氧检测灵敏度的同时克服18F-FMISO的缺点发展一种更理想的乏氧显像剂。而乏氧显像灵敏度的影响因素包括:乏氧显像剂在乏氧组织中的滞留量、滞留时间以及在正常组织中清除的速率。近年来有关正电子核素标记的硝基咪唑类肿瘤乏氧显像剂的研究取得不少进展,本文对硝基咪唑类PET肿瘤乏氧显像剂进行简要概述,把该类显像剂按结构分为MISO衍生物类、依他硝唑(ETA)衍生物类、多拉达唑(DORA)衍生物类、124I-碘代硝基咪唑核苷(124I-IAZA)类似物、68Ga标记的硝基咪唑类衍生物等。
1 MISO衍生物类肿瘤乏氧显像剂
部分MISO衍生物类肿瘤乏氧显像剂结构式示于图2。
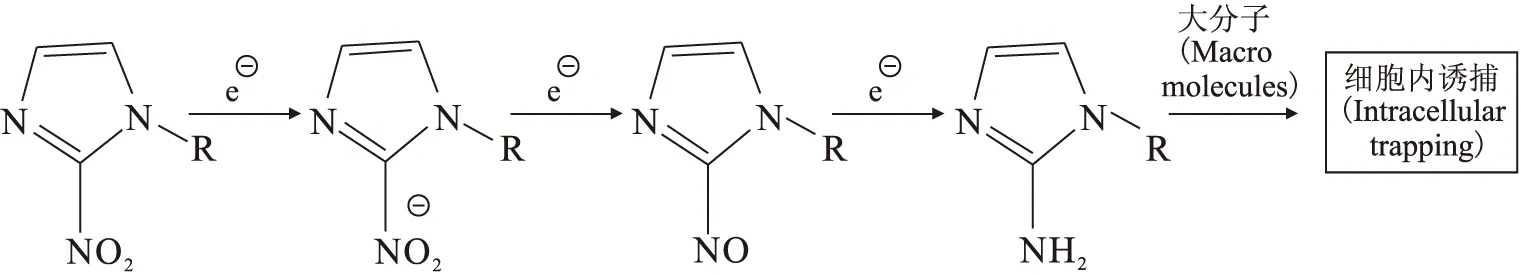
图1 硝基咪唑显像原理Fig.1 2-nitroimidazole imaging principle
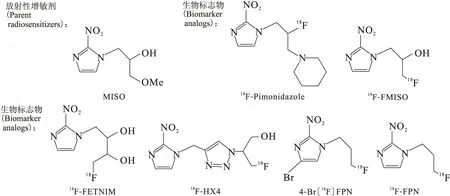
图2 MISO衍生物类肿瘤显像剂Fig.2 MISO derivative tumor imaging
1.118F-氟赤硝基咪唑
18F-氟赤硝基咪唑(18F-FETNIM)是一种亲水性强、毒性低、正常组织摄取较低的肿瘤乏氧显像剂,对18F-FMISO的结构稍加改造修饰即可得到。18F-FETNIM在脑和骨骼中分布较少,在肾和肠中分布较多,且体内消除速率快,是近年来的研究热点[1]。18F-FETNIM的周围组织代谢率、脱氟率和乏氧组织代谢率均适用于PET/CT,且优于18F-FMISO,是一种高度稳定、耐用的放射性显像剂。与18F-FMISO、18F-FDG相比,18F-FDG的肿瘤/血放射性摄取比值最高,18F-FETNIM[2]次之,而18F-FETNIM的肿瘤/肌肉比值要明显高于18F-FDG和18F-FMISO。通过肿瘤的放射性自显影显示,乏氧区域吸收的18F-FETNIM要比正常区域多。然而18F-FETNIM在组织中早期摄取值是多变的,受局部血流灌注的影响较大。研究表明,18F-FETNIM反映肿瘤乏氧和氧合状态的效果比较满意,且治疗后生存周期短的患者往往治疗前就有较高的18F-FETNIM摄取值[3]。18F-FETNIM摄取值受几种生物学可变因素影响如乏氧、糖代谢和血管再生术,与18F-FMISO的PET/CT联合显像能为放射治疗确定乏氧和再增殖生物学靶区,以通过剂量调强放疗提高再增殖和乏氧区域的放疗剂量,从而提高肿瘤的局部控制率和患者的远期生存质量[4]。18F-FETNIM作为第二代肿瘤乏氧显像剂,具有良好的应用前景[5]。
1.218F-HX4
18F-4-2-硝基-1H-咪唑基-甲基-1H-1,2,3-三唑-3-(2-硝基苯磺酰氧基)丙醇乙酯(18F-HX4)的制备方法简单、方便、安全、可靠,能选择性地浓聚于恶性肿瘤,可用于肿瘤组织乏氧情况的检测,主要经肾脏及胆囊排泄,与肠道无关。对于头颈部肿瘤,18F-HX4注射后55~80 min时即可显示良好的肿瘤/肌肉放射性摄取比值(T/M,1.4),而其他显像剂通常需要等待120~240 min后可进行显像。在肺癌中,18F-HX4的T/M值与18F-FMISO相似,且随显像时间的延长略微增高,较短的等待时间(约90 min)即可进行显像。18F-HX4比18F-FMISO有更高的乏氧组织敏感性和特异性,在一定程度上克服了18F-FMlSO清除率慢、乏氧区域和周围正常组织对比不明显、成像时间晚等缺陷[6]。18F-HX4作为一种反映肿瘤细胞乏氧状态的显像剂,与内源性乏氧标志物CAIX高度相关,比18F-FMISO更真实地反映肿瘤乏氧,是近年来研究的一种新型乏氧显像剂,研究前景看好[7]。
1.318F-哌莫硝唑
18F-哌莫硝唑(18F-FPIMO)在生长的肿瘤模型鼠中有摄取,给药3 h后,肿瘤组织的放射性摄取是肌肉的2~6倍。18F-FPIMO的放射自显影结果与免疫组化相似。研究表明,18F-FPIMO与18F-氟代氨氯酶素糖苷(18F-FAZA)相比,主要通过肝、肾代谢并且血流代谢迅速导致肿瘤绝对值摄取低,并不具备成为良好乏氧显像剂的潜力[8]。
1.418FPN 、18FON 、4-Br18FPN
18F-1-(3-氟丙基)-2-硝基咪唑(18FPN)、18F-1-(8-氟丙基)-2-硝基咪唑(18FON)与18F-FMISO相比,具有更高的初始脑摄取、脑清除迅速,在肿瘤组织中的摄取不明显。18F-4-溴-1-(3-氟丙基)-2-硝基咪唑(4-Br18FPN)初始脑摄取量明显高于18F-FMISO,但清除迅速,在肿瘤中的定位效应不及18F-FMISO[9]。以上三种均未表现出作为脑乏氧显像剂的潜力。
2 ETA衍生物类肿瘤乏氧显像剂
部分ETA衍生物类肿瘤乏氧显像剂结构式示于图3。
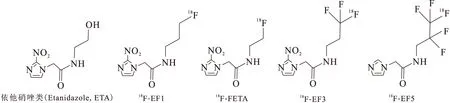
放射性增敏剂(Parent radiosensitizers):ETA;生物标志物(Biomarker analogs):18F-EF1,18F-FETA,18F-EF3,18F-EF5图3 ETA衍生物类肿瘤乏氧显像剂Fig.3 ETA derivative tumor imaging
2.118F-依他硝唑
18F-依他硝唑(18F-FETA)与18F-EF1结构非常相似,其区别在于酰胺基团支链少了一个碳原子[10]。研究表明,注射4 h后,18F-FETA在心脏、肠、肾和肿瘤中的摄取与18F-FMISO类似,但在肝脏和肺中18F-FETA的摄取比18F-FMISO要低。18F-FETA能够快速的通过血脑屏障,注射4 h后的脑/血流值为1.07±0.31。18F-FETA作为一种乏氧显像剂,并未得到比18F-FMISO更好的效果[11]。
2.218F-EF系列
18F-EF系列主要包括EF1、EF3和EF5等,与18F-FMISO相比,EF系列的2-硝基咪唑支链上的羟基换成了酰胺基团,与乏氧细胞的结合更具有特异性,同时毒性明显下降。EF系列主要通过泌尿系统代谢。其中18F-2-(2-硝基-1-咪唑)-N-(3-氟丙基)-乙酰胺(18F-EF1)在乏氧组织中的结合与滞留性质与18F-FMISO相似,但其代谢比18F-FMISO慢,更适合于乏氧显像[12]。18F-2-(2-硝基-1-咪唑)-N-(3,3,3-三氟丙基)-乙酰胺(18F-EF3)与18F-FMISO相比,毒性小。Mahy等[13]分析了不同氧浓度下18F-EF3的药代动力学、生物学分布、代谢及特异性等情况,同时对18F-EF3和18F-2-(2-硝基-1-咪唑)-N-(3,3,3-五氟丙基)-乙酰胺(18F-EF5)在同一模型中用免疫荧光检测方法进行对比,结果显示:18F-EF3的摄取量与氧浓度呈负相关,18F-EF3的T/M值与18F-EF5的荧光强度有密切关系。18F-EF3的药代动力学、生物学分布、代谢产物均与18F-FMISO相似,在注射后4 h,两者有相似的瘤内分布,但18F-EF3对乏氧的特异性较18F-FMISO差,比18F-FMISO有更快的血清除率,说明18F-EF3并不比18F-FMISO更具优势[14]。此外Mahy等[15-16]对18F-EF3进行了临床研究,发现在头颈部鳞状细胞癌中有摄取和滞留,具有一定的应用前景。18F-EF5注入人体后,能快速、均匀地分布到所有组织,并且在体内的稳定性高,是一种非侵入性评估肿瘤乏氧的有效方法[17-18]。18F-EF5注入肿瘤患者体内后,4~6 h肿瘤组织显像清晰,且辐射剂量在安全范围内,不同类型的肿瘤均可采用18F-EF5进行PET/CT乏氧显像[19]。
3 DORA衍生物类肿瘤乏氧显像剂
部分DORA衍生物类肿瘤乏氧显像剂结构式示于图4。
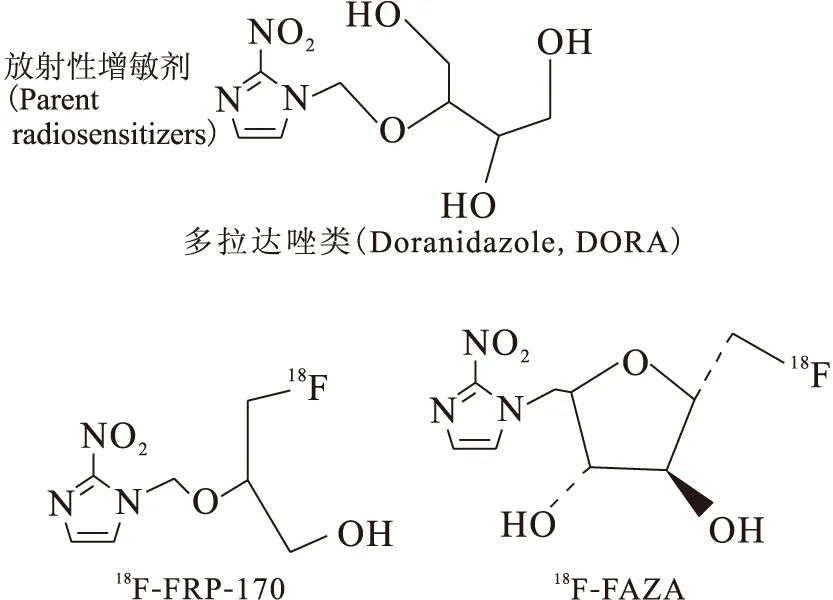
生物标志物(Biomarker analogs):18F-FRP-170,18F-FAZA图4 DORA衍生物类肿瘤显像剂Fig.4 DORA derivative tumor imaging
3.118F-氟代氨氯酶素糖苷
18F-FAZA中2-硝基咪唑的支链是一个五元环。18F-FAZA可特异性聚集于乏氧细胞内,其肿瘤/肌肉放射性摄取比值、肿瘤/血流放射性摄取比值均较高,有较好的生物动力学。与18F-FMISO相比,18F-FAZA在肿瘤中的摄取较低,但具有更快的血液和非靶组织清除率,主要经肾脏排泄,肠道内放射性低,对于腹部肿瘤显像具有明显的优势。多项研究已证实18F-FAZA作为乏氧显像剂的可行性以及较高的图像质量,并可根据其显像结果确定乏氧区,从而制定放疗方案,且高的18F-FAZA摄取值是肿瘤预后不良的独立预测因子[20-22]。
3.2 1-[2-氟-1-(羟甲基)-乙氧基]甲基-2-硝基咪唑
1-[2-氟-1-(羟甲基)-乙氧基]甲基-2-硝基咪唑(18F-FRP-170)是一种新的乏氧放射增敏剂。与18F-FMISO相比,2-硝基咪唑支链上的羟基置换成了醚键,具有较低的亲水性。18FRP-170可以浓聚在活的乏氧细胞中,但是不能在低代谢的乏氧细胞如凋亡细胞中摄取。18FRP-170的SUV值与TpO2有显著的关系。在胶质细胞瘤中,18FRP-170[23]的高摄取代表该区域存在高密度的乏氧细胞,从而确定乏氧区域。18FRP-170与脱氧葡萄糖在诊断缺血但存活的心肌时同样有效,PET显像适用于缺血但存活心肌的定量估测或者急性心肌损害的准确诊断。由此可以得出18FRP-170是一种新的有前途的乏氧显像剂,对于临床乏氧区域的诊断有很大帮助[24]。
4 18FDG-2-硝唑等杂合化合物
部分18FDG-2-硝唑等杂合化合物结构式示于图5。放射性示踪剂被动扩散进入乏氧细胞,为获得较高摄取值和较长滞留时间的乏氧显像剂,将对乏氧敏感的2-硝基咪唑和活性传输分子如葡萄糖、络氨酸结合,以促进细胞摄取。Patt等[25]将2-硝基咪唑基团与18FDG直接相连,得到18FDG-2-硝唑(18FDG-2-Nim)。18FDG-2-Nim的优点是合成产率高,在肿瘤细胞中有初始摄取,但在乏氧组织中不能很好地滞留,从而影响了应用。此外还有18F-GAZ、18F-FNT等,未见放射性显像评价。
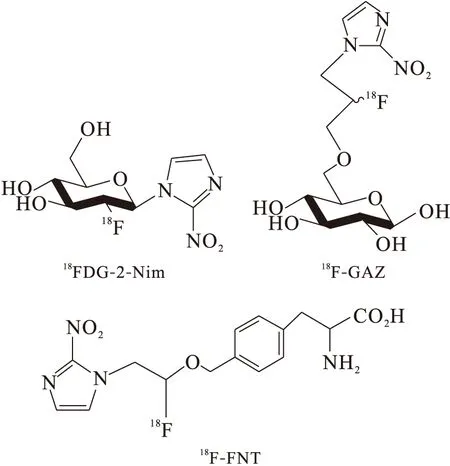
图5 部分18FDG-2-硝唑等杂合化合物结构式Fig.5 18FDG-2-Nim derivative tumor imaging
5 18F-silamisonidazoles衍生物
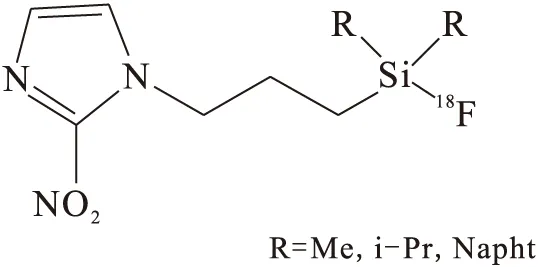
图6 18F-silamisonidazales衍生物Fig.6 18F-silamisonidazales derivative
18F-silamisonidazoles衍生物结构式示于图6。Bernard-Gauthier等[26]提供一种合成方法,将硅-氟化物受体(SIFA-IE)进行同位素交换,从而进行18F标记。这种方法不需要标记物与前体分离,并且反应条件温和。Yoann等[27]利用这种方法合成了18F-氟硅苯叔丁基-MISO(18F-SiFA-MISO)。18F-氟硅苯叔丁基-MISO在体内稳定,其中硅与18F的亲和力要比碳与18F大,18F-SiFA-MISO具有亲油性(lgD=2.12),在正常组织中清除慢,但是在乏氧组织中有摄取,还需要进一步的实验研究来验证其作为肿瘤乏氧显像剂的可能性。
6 68Ga-标记的硝基咪唑类衍生物
68Ga-标记的硝基咪唑类衍生物结构式示于图7。68Ga-NOTA-NI、68Ga-DOTA-NI、68Ga-SCN-NOTA-NI、68Ga-SCN-Bz-DOTA-NI都是68Ga标记的硝基咪唑类乏氧显像剂。其中68Ga-NOTA-硝基咪唑(68Ga-NOTA-nitroimidazole)和68Ga-SCN-Bz-DOTA-硝基咪唑(68Ga-SCN-Bz-DOTA-nitroimidazole)在注射60 min后的瘤/肉放射性摄取比值为0.65,比18F-FAZA和18F-FMISO在同一时间点低。68Ga标记的硝基咪唑类衍生物的优点在于68Ga通过发生器(68Ga/68Ge)生成,不需要使用回旋加速器,从而节省成本。但是68Ga标记的硝基咪唑类衍生物作为乏氧显像剂并没有超过18F-FMSIO,临床研究及应用前景有限。
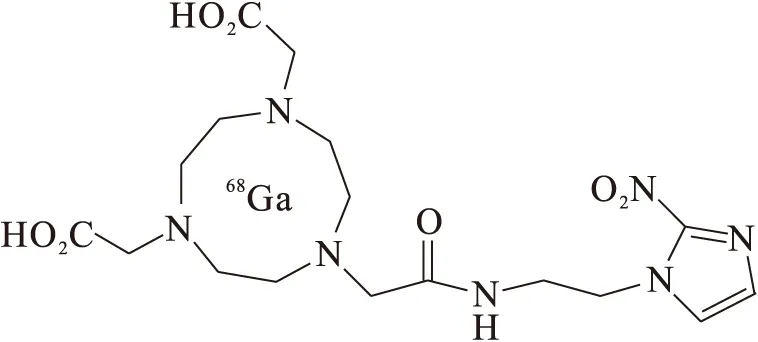
图7 68Ga标记的硝基咪唑类衍生物Fig.7 68Ga-labeled NOTA complex containing a 2-nitroimidazole moiety
7 糖基-硝基咪唑类化合物(124I-IAZA类似物)
124I是一个半衰期为4.2 d的正电子核素,但124I并没有被广泛应用,原因如下:(1)124I正电子衰变的分支比(0.24)比18F的正电子衰变的分支比(0.97)低;(2) 具有较高的能量导致了较长的辐射范围和较差的影像分辨率;(3)124I衰变非常复杂,包括几种高能量的γ射线。
7.1124I-碘代硝基咪唑核苷
Reischl等[28]比较了124I-碘代硝基咪唑核苷(124I-IAZA)(图8)、18F-FAZA和18F-FMISO三种显像剂,其中18F-FAZA具有明显高的肿瘤/本底值(5.19±0.73),而18F-FMISO和124I-IAZA分别为3.98±0.66和2.06±0.26。尽管124I半衰期比18F长,但是124I-IAZA并没有更好的肿瘤/正常组织放射性摄取比值,临床意义不大。
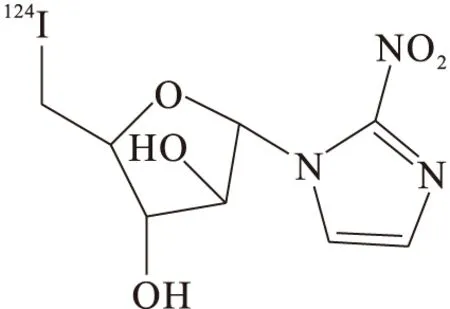
图8 124I-IAZA结构式Fig.8 Structural formula of 124I-IAZA
7.2124I-半乳糖苷-2-硝基咪唑
124I-半乳糖苷-2-硝基咪唑[29](124I-IAZG)(图9)水溶性强,在荷瘤小鼠血液中清除快,注射后在肿瘤细胞中的显像随时间缓慢持续的下降,但肿瘤/正常组织放射性摄取比值增加。与18F-FMISO比较,并未表现出更好的优势。
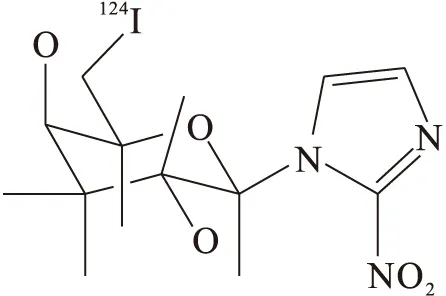
图9 124I-IAZG的结构式Fig.9 Structural formula of 124I-IAZG
7.3124I-吡喃半乳糖苷-2-硝基咪唑
124I-吡喃半乳糖苷-2-硝基咪唑(124I-IAZGP)[30-31]在体内清除速率快、安全,但在肿瘤组织中摄取不足,作为肿瘤乏氧显像剂应用于临床的前景有限。
8 [64Cu]ATSM-Nim
64Cu标记的双-三氯甲级砜(bisthiosemicarbazone, BTS)衍生物是另一个研究热点,以64Cu-ATSM为代表,[64Cu]ATSM-Nim结构式示于图10,其显像机制并不明确,初步认为其通过异常线粒体还原机制选择性滞留于乏氧细胞,具有较高的细胞摄取量和更快的从正常氧合组织清除的速率。利用硝基咪唑明确的显像机制,将64Cu-ATSM与2-硝基咪唑进行杂合,显示在乏氧细胞中并没有更高的肿瘤摄取值,应用前景有限[32]。
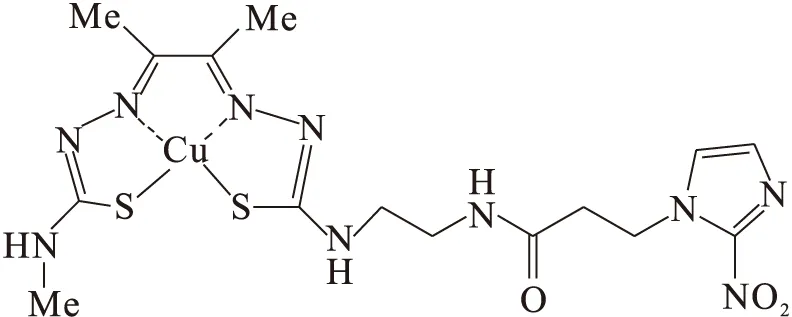
图10 [64Cu]ATSM-Nim结构式Fig.10 [64Cu]ATSM-Nim structural formula
9 总结和展望
PET因其具有更高的空间分辨率和更精确的定量定位分析能力,能提供有价值的功能和代谢方面的信息,对检测肿瘤乏氧具有更大的优势。乏氧组织显像剂[33-37]有重要的临床应用价值和广阔的应用前景,尤其是在肿瘤的诊断、治疗方案的选择以及预后评价方面具有优越性,随着研究的不断深入,乏氧显像剂将在临床诊治中发挥越来越重要的作用。目前最好的应用于临床的肿瘤乏氧显像剂只有18F-FMISO和64Cu-ATSM。而18F-FMISO存在很多缺陷,64Cu-ATSM显像机制并不明确,且64Cu核素生产成本高,对加速器要求高,限制了其临床应用。硝基咪唑类肿瘤乏氧显像剂因其显像机理明确,药代动力学和药理作用清楚,随着各种硝基咪唑的衍生物不断深入研究,更理想的适用于临床应用的肿瘤乏氧显像剂值得期待。
本文对正电子标记的硝基咪唑类肿瘤乏氧显像剂进行了综述。对硝基咪唑类肿瘤乏氧显像剂进行化学结构修饰,按结构分MISO衍生物类(18F-FETNIM、18F-FPIMO、18F-HX4等)、ETA衍生物类(18F-FETA、18F-EF系列)、DORA衍生物类(18F-FAZA、18F-FRP-170)、124I-IAZA类似物、68Ga标记的硝基咪唑类衍生物等。由于常规乏氧显像剂存在着各自的缺陷,一系列新的化合物被提出,如2-硝基咪唑和64Cu-ATSM杂合形成的64Cu-ATSM-Nim,利用氟-硅化合物受体进行同位素交换等方法合成的18F-SiFA-MISO,对寻找性能更优的硝基咪唑类肿瘤乏氧显像剂起到很大作用。此外随着计算机辅助药物分子设计技术的发展对于有效缩短新药筛选时间、研究药物作用机理提供很大帮助。
随着测定方法的不断改进及不同测定技术的合理联合应用,对肿瘤氧合状态的精确测定将会有效的应用于临床,乏氧显像有着重要的临床应用价值和广阔的应用前景。
[1] Tuula T, Kaisa L, Jarmo K, et al.18F-fluoroerythronitroimidazole radiation dosimetry in cancer studies[J]. J Nucl Med, 2002, 43: 1674-1680.
[2] Tove G, Lise B, Paivi M, et al. Comparison of the biodistribution of two hypoxia markers [18F] FETNIM and [18F] FMISO in an experimental mammary carcinoma[J]. Eur J Nucl Med Moi Imaging, 2004, 31: 513-520.
[3] Li L, Hu M, Zhao W, et al.18F-FETNIM PET/CT hypoxia imaging in non-small cell lung cancer: preliminary clinical observation[J]. Chinese-German Journal of Clinical Oncology, 2010, 9(6): 330-333.
[4] Laetitia V, David G, Anne T, et al. Hypoxia imaging of uterine cervix carcinoma with18F-FETNIM PET/CT[J]. Clin Nucl Med, 2012, 37: 1065-1068.
[5] Hu M, Xing L, Mu D, et al. Hypoxia imaging with18F-fluoroerythro-nitroimidazole integrated PET/CT and immunohistochemical studies in non-small cell lung cancer[J]. Clin Nucl Med, 2013, 38: 591-596.
[6] Chen L, Zhang Z, Hartmuth C K, et al.18F-HX4 hypoxia imaging with PET/CT in head and neck cancer: a comparison with18F-FMISO[J]. Nuclear Medicine Communications, 2012, 33: 1096-1102.
[7] Ludwig J D, Natasja G L, Marco H M J, et al. Preclinical evaluation and validation of [18F]-HX4, a promising hypoxia marker for PET imaging[J]. PNAS, 2011, 108: 14620-14625.
[8] Morten B, Steen J, Michael R H, et al. PET imaging of tumor hypoxia using18F-labeled pimonidazole[J]. Acta Oncologica, 2013, 52: 1300-1307.
[9] Fumihiko Y, Mizuho A, Yoshiya F, et al. Synthesis and evaluation of 4-bromo-1-(3-[18F]fluoropropyl )-2-nitro-imidazole with a low energy LUMO orbital designed as brain hypoxia targeting imaging agent biol[J]. Pharm Bull, 2002, 25(5): 616-621.
[10]Janet S R, Philip D H, Lay K C, et al. Characterization of [18F]-fluoroetanidazole, a new radiopharmaceutical for detecting tumor hypoxia[J]. J Nucl Med, 1999, 40: 1072-1079.
[11]Barthel H, Wilson H, Collingridge D R, et al.Invivoevaluation of [18F]-fluoroetanidazole as a new marker for imaging tumor hypoxia with positron emission tomography[J]. British Journal of Cancer, 2004, 90: 2232-2242.
[12]Evans S M, Kachur A V, Shiue C Y, et al. Noninvasive detection of tumor hypoxia using the 2-nitroimidazole [18F] EF1[J]. J Nucl Med, 2000, 41: 326-327.
[13]Mahy P, de Bast M, Leveque P H, et al. Preclinical validation of the hypoxia tracer 2-(2-nitroimidazol-1-yl)-N-(3, 3, 3-[18F] trifluoropropyl)-acetamide, [18F]-EF3[J]. Eur J Nucl Med Mol Imaging, 2004, 31: 1263-1272.
[14]Mahy P, de Bast M, Gillart J, et al. Detection of tumor hypoxia: comparison between EF5 adducts and [18F]-EF3 uptake on an individual mouse tumor basis[J]. Eur J Nucl Med Mol Imaging, 2006, 33: 553-556.
[15]Mahy P, de Bast M, de Groot T, et al. Omparative pharmacokinetics, biodistribution, metabolism and hypoxia-dependent uptake of [18F] EF3 and [18F] FMISO in rodent tumor models[J]. Radiother Oncol, 2008, 89: 353-360.
[16]Mahy P, Geets X, Lonneux M, et al. Determination of tumour hypoxia with [18F]-EF3 in patients with head and neck tumours: a phase I study to assess the tracer pharmacokinetics, biodistribution and metabolism[J]. Eur J Nucl Med Mol Imaging, 2008, 35: 1282-1289.
[17]Jonna S, Heidi H, Katri K, et al. Uptake of [18F] EF5 as a tracer for hypoxic and aggressive phenotype in experimental head and neck squamous cell carcinoma[J]. Translational Oncology, 2014, 7: 323-330.
[18]Gaber K, Marko S, Olli E, et al.18F-EF5: a new PET tracer for imaging hypoxia in head and neck cancer[J]. J Nucl Med, 2008, 49: 1944-1951.
[19]Lilie L L, Antti S, James B S, et al. Radiation dosimetry and biodistribution of the hypoxia tracer18F-EF5 in oncologic patients[J]. Cancer Biother Radio, 2012, 7(27): 412-419.
[20]Gyorgy B H, Leonie B B, Johannes A L, et al. Head and neck tumor hypoxia imaging by18F-fluoroazomycin-arabinoside (18F-FAZA)-PET a review[J]. Clin Nucl Med, 2014, 39(1): 44-48.
[21]Hayashi K, Furutsuka K, Takei M, et a1. High-yield automated synthesis of [18F]-fluoroazomycin arabinoside ([18F] FAZA) for hypoxia-specific tumor imaging[J]. Appl Radiat Isot, 2011, 69(7): 1007-1013.
[22]Mortensen L S, Busk M, Nordsmark M, et al. Accessing radiation response using hypoxia PET imaging and oxygen sensitive electrodes: a preclinieal study[J]. Radiother Oncol, 2011, 99(3): 418-423.
[23]Takaaki B, Kazunori T, Toshiaki S, et al. Standardized uptake value in high uptake area on positron emission tomography with18F-FRP170 as a hypoxic cell tracer correlates with intratumoral oxygen pressure in gliblastoma[J]. Mol Imaging Biol, 2014, 16: 127-135.
[24]Ichiyo S, Toshihiro K, Masayuki K, et al. Imaging of hypoxic lesions in patients with gliomas by using positron emission tomography with 1-(2-[18F] fluoro-1-[hydroxymethyl] ethoxy)methyl-2-nitroimidazole, a new18F-labeled 2-nitroimidazole analog[J]. J Neurosurg, 2010, 113: 358-368.
[25]Patt M, Sorger D, Scheunemann M, et al. Adduct of 2-[18F] FDG and 2-nitroimidazole as a putative radiotracer for the detection of hypoxia with PET: synthesisinvitro- andinvivo- characterization[J]. Appl Radiat Isot, 2002, 57(5): 705-712.
[26]Bernard-Gauthier V, Wangler C, Schirrmacher E.18F-labeled silicon-based fluoride acceptors: potential opptunities for novel positron emitting radiopharmaceuticals[J]. Biomed Res Int, 2014: 454-503.
[27]Yoann J, Rabah A, Laurent B, et al. Synthesis of new18F-radiplabeled silicon-based nitroimidazole compounds[J]. Bioorganic & Medicinal Chemistry, 2013, 21: 3680-3688.
[28]Reischl G, Dorow D S, Cullinane C, et al. Imaging of hypoxia with [124I] IAZA in comparison with [18F] FMISO and [18F] FAZA-first small animal PET results[J]. J Pharm Pharm Sci, 2007, 10: 203-211.
[29]Christopher C R, Peter B, Pat Z, et al. Tumor hypoxia imaging in orthotopic liver tumors and peritoneal metastasis: a comparative study featuring dynamic18F-MISO and124I-IAZG PET in the same study cohort[J]. Eur J Nucl Med Mol Imaging, 2008, 35(1): 39-46.
[30]O’Donoghue J A, Guillem J G, Schöder H, et al. Pilot study of PET imaging of124I-iodoazomycin galactopyranoside (IAZGP), a putative hypoxia-imaging agent, in patients with colorectal cancer and head and neck cancer[J]. Ejnmmi Research, 2013, 3(1): 1-10.
[31]Riedl C C, Brader P, Zanzonico P B, et al. Imaging hypoxia in orthotopic rat liver tumors with iodine124I-labeled iodoazomycin galactopyranoside PET[J]. Radiology, 2008, 248: 561-570.
[32]Bonnitcha P D, Bayly S R, Theobald M B M, et al. Nitroimidazole conjugates of bis (thiosemicarbazonato)64Cu(Ⅱ): potential combination agents for the PET imaging of hypoxia[J]. Inorg J Biochem, 2010, 104(2): 126-135.
[33]汪建军,张剑英,朱霖.18F标记乏氧组织显像剂的研究进展[J].同位素,2004,7(4):241-246.
[34]Egesta L, Ilaria G, Arturo C, et al. PET radiopharmaceuticals for imaging of tumor hypoxia: a review of the evidence[J]. Am J Nucl Med Mol Imaging, 2014, 4(4): 365-384.
[35]李莉,李美佳,郑妙.乏氧组织显像剂研究最新进展[J].国外医学·放射医学核医学分册,1999,23(3):134-139.
[36]汪会,徐慧琴.肿瘤乏氧显像剂的研究进展[J].国际放射医学核医学杂志,2012,36(6):366-370.
[37]Melinda W, Frank W. Positron emission tomography radiotracers for imaging hypoxia[J]. J Label Compd Radiopharm, 2013, 56: 244-250.
Progress of Tumor Hypoxia Imaging Agents Containing Nitroimidazole for Positron Emission Tomography
YU Qian, WANG Zhen-guang*, CHEN Cheng-cheng, LIU Si-min, SHI Bin
PET/CT Center, The Affiliated Hospital of Qingdao University, Qingdao 266000, China
Hypoxia imaging agents can selectively accumulate in hypoxic tissues or cells. With the advance of PET imaging technique, tumor hypoxia imaging for PET has great clinical value for guiding tumor therapy, evaluating therapeutic efficacy and estimating prognosis.18F-FMISO is the widely studied PET tumor hypoxia imaging agent containing nitroimidazole, but it still has some disadvantages. Up to now, more and more novel PET tumor hypoxia imaging agents containing nitroimidazole are under investigation. This review briefly introduced some the research progress of tumor hypoxia imaging agents containing nitroimidazole for PET.
tumor hypoxia; PET; nitroimidazole hypoxia imaging
2014-12-16;
2015-08-03
于 倩(1983—),女,山东聊城荏平县人,硕士研究生,药师,放射性药物化学专业
*通信联系人:王振光(1967—),男,山东烟台海洋人,博士,高级医师,从事肿瘤核素显像研究
R817
A
0253-9950(2015)06-0385-08
10.7538/hhx.2015.37.06.0385
