响应曲面法优化鲜地龙可溶性蛋白提取工艺
2015-01-17索绪斌王伟明
何 超, 索绪斌, 张 涵, 王伟明*
(1.黑龙江省中医药科学院,黑龙江哈尔滨150036;2.广东药学院,广东广州51006)
响应曲面法优化鲜地龙可溶性蛋白提取工艺
何 超1, 索绪斌2, 张 涵1, 王伟明1*
(1.黑龙江省中医药科学院,黑龙江哈尔滨150036;2.广东药学院,广东广州51006)
目的优化鲜地龙中可溶性蛋白的提取工艺。方法冰浴超声提取法,采用响应曲面Box-Benhnken设计,考察搅碎时间、料液比、提取液的pH对可溶性蛋白得率的影响,对鲜地龙可溶性蛋白冰浴超声提取工艺进行优化。结果冰浴超声提取鲜地龙蛋白的最佳工艺条件为加入2倍量pH 7.46的缓冲液后搅碎256 s,再加入4.63倍的缓冲液冰浴超声15 min,此条件下蛋白质得率为21.01%。结论冰浴超声法简单、快速、高效,工艺稳定可行,适用于鲜地龙可溶性蛋白提取。
响应面法;鲜地龙;可溶性蛋白;冰浴超声
地龙为环节动物门钜蚓科动物参环毛蚓Pheretima aspergillum(E.perrier)、通俗环毛蚓Pheretima vulgaris chen、威廉环毛蚓Pheretima guillelmi(Michaelsen)或栉肓毛蚓Pheretima pectinifera Michaelsen的干燥体。前1种俗称 “广地龙”,后3种俗称 “沪地龙”[1]。地龙在我国药用历史悠久,《本草纲目》上就记载了地龙的作用。现代中医药理论认为地龙有清热定惊,通络,平喘,利尿的功效[2]。近代药理研究表明地龙有抗凝血溶血的双重作用、改善微循环和心脑血管病理状态、调节肝脏功能等作用[3-4]。可溶性蛋白是地龙中的主要活性物质,国内外研究表明其是地龙溶血栓、抗血栓的主要活性物质[5-6]。
已有研究显示鲜地龙中的蛋白种类及含有量都比干地龙丰富[7],而查阅文献发现对地龙蛋白提取工艺的研究很少,且研究对象多为干地龙[8-9]。因而实验旨在于优化对鲜地龙可溶性蛋白的提取工艺,对于地龙药材的合理、有效利用具有重要意义。
1 材料、试剂和仪器
本实验所用鲜地龙均来自东莞郊区,从野外收集后在极近自然环境中养殖保存以备实验之用。
考马斯亮蓝G250(Ameresco-0615,Biosharp进口分装);牛血清白蛋白 (上海蓝季科技发展有限公司);所用其他试剂均为国产分析纯试剂;所用水均为纯化水。
SG280-B4榨汁/搅拌器 (中山市好妈咪电器厂);TGL-16C高速离心机 (上海安亭科学仪器厂);Sartorius BAS 124S型分析天平(赛多利斯科学仪器 (北京)有限公司);JJ500型电子天平(常熟市双杰测试仪器厂);PHS-3C型pH计 (上海雷磁);KQ5200B超声波清洗器 (昆山市超声仪器有限公司);759型紫外可见分光光度计 (上海菁华科技仪器有限公司)等。
2 方法与结果
2.1 可溶性蛋白测定[9]以牛血清白蛋白为对照品,采用Brodford法测定提取液中可溶性蛋白的量,本实验中未特别说明的蛋白含有量均以牛血清白蛋白计。
考马斯亮蓝G250溶液的配制:称取100 mg考马斯亮兰G250,用50 mL 95%的乙醇超声分散后于50~60℃水浴中充分溶解2 h,再加入120 mL 85%的磷酸50~60℃水浴2 h,用去离子水定容至1 L,过滤,滤液置棕色瓶内避光保存备用。
2.1.1 标准曲线的制备 精密称取24.4 mg标准牛血清白蛋白(BSA)以0.9%NaCl溶液溶解后定容于25 mL量瓶中,作为标准贮备液,备用。精密吸取标准贮备液2.00、2.75、3.50、4.25、5.00 mL分别置于10 mL量瓶中,以0.9%NaCl溶液定容至刻度,得质量浓度分别为 195.2、268.4、341.6、414.8、488.0μg/mL的BSA溶液。向5支5 mL具塞试管中依次加入0.10 mL上述BSA溶液,以0.9%NaCl溶液补至0.25 mL,加入5 mL考马斯亮蓝G250溶液,充分摇匀后放置15 min,于595 nm处测定吸光度值。以标准蛋白质量 (μg)为横坐标,吸光度为纵坐标,绘制标准曲线,得线性方程为Y=0.005 9x+0.085 1,r2=0.998 6,在19.52~48.80μg范围内线性良好可用于定量测定。
2.1.2 精密度考察 精密吸取线性项下质量浓度为341.6μg/mL的对照品溶液0.10 mL,按方法测定吸光度,重复测定6次,计算RSD为0.36%,表明仪器精密度良好。
2.1.3 重复性考察 精密吸取6份线性项下质量浓度为341.6μg/mL的标准品溶液0.10 mL,按方法测定吸光度,计算样品中可溶性蛋白含量,RSD为2.07%。
2.1.4 加样回收率 取已测定蛋白量的鲜地龙提取液 (含可溶性蛋白8.90 mg),分别加入BSA6.25、7.80、9.35 mg,每个样品平行3份,以0.9%NaCl溶液稀释至适宜浓度,依法测定吸光度,结果平均回收率为106.1%,RSD为2.1%。
2.1.5 稳定性研究 取线性项下高、中、低质量浓度的对照品溶液,依法测定加入考马斯亮蓝G250摇匀后15、20、30、40、50、60 min时的吸光度,计算RSD为1.7%,表明该法在显色后15~60 min内稳定性良好,适于含量测定。
2.2 样品测定
2.2.1 样品溶液制备 鲜地龙洗净沙土后以10%乙醇麻醉,洗至无醇味后解剖除去腹腔中的泥沙及杂物。用滤纸吸干其表面附着的水,精密称量后,加入2倍量缓冲液,搅碎,再加提取液至所需体积,冰浴超声15min。10 000 r/min离心5min后取上清液,稀释至适宜浓度即可。精密吸取0.10 m L样品溶液,照 “2.1.1”项下操作,测定样品吸光度值,计算蛋白量。
2.2.2 样品中蛋白测定 参照 《中国药典》2010年版一部附录ⅨH水分测定法测定鲜地龙含水量。依照公式 (1)计算可溶性蛋白提取率,式中r为鲜地龙的含水量。

2.3 鲜地龙可溶性蛋白提取工艺优化
2.3.1 单因素预试验 选择冰浴超声提取法,考察了搅碎时间、料液比、提取液的pH对可溶性蛋白得率的影响。
2.3.1.1 料液比考察 平行取多个样品,依照样品制备方法,分别加入2、4、6、8、10、12、14倍pH 7.4的提取液,搅碎30 s,冰浴超声15 min,离心后依法测可溶性蛋白的提取率。以蛋白得率为纵坐标,提取溶剂倍数为横坐标,制作蛋白得率(%) -提取溶剂倍数曲线,实验结果表明6倍量pH 7.4的提取液可得蛋白提取率最高,而后随着提取液的增加,蛋白提取率反而降低。
2.3.1.2 提取溶剂的pH考察 平行取多个样品,依照样品制备方法,分别加入6倍量的pH分别为6.8、7.0、7.4、7.8和8.0的提取液,搅碎30 s,冰浴超声15 min,离心后依法测可溶性蛋白得率。以蛋白得率为纵坐标,提取液pH为横坐标,制作蛋白得率 (%)-提取液pH曲线,实验结果表明在一定的pH范围内,提高提取液的pH可以提高蛋白提取率,但超过7.4后,再提高提取液的pH反而不利于可溶性蛋白的提取,因而提取液最适宜pH应为7.4。
2.3.1.3 搅碎时间考察 平行取多个样品,依照样品制备方法,加入6倍量pH 7.4的提取液,分别搅碎 30、120、210、300、390 s,冰浴超声15 min,离心后依法测可溶性蛋白的提取率。以提取率为纵坐标,提取时间为横坐标,制作蛋白得率(%) -搅碎时间 (s)曲线,实验结果表明,总体上随着搅碎时间的增加,蛋白得率升高,但其在120~210 s处有一个平台,说明其中可能有上升再下降的趋势,结合搅碎时的观察,随着搅碎时间的延长,样品胶状严重不利于离心,且设备发热严重。
综合各因素,最终选择提取液倍数4~8,提取液pH 7.0~7.8,搅碎时间30~330 s进行后续响应面设计,优化提取工艺。
2.3.2 Box-Behnken响应曲面法(RSM)优化提取工艺 依据单因素试验结果,根据Box-Behnken响应曲面设计原理,考察搅碎时间、料液比、提取液的pH对可溶性蛋白得率的影响。采用Design-Expert7.1.6统计分析软件设计实验,分析结果。实验水平因素安排见表1,响应面分析实验设计及结果见表2。

表1 响应曲面法实验因素水平Tab.1 Factors and levels of RSM test

表2 鲜地龙可溶性蛋白提取工艺优化实验设计及结果Tab.2 Conditions and results for extraction optim ization
对表2的实验结果回归拟合得到多元二次回归方程模型:
R1=-994.458 69-0.168 78A+19.353 87B+ 260.749 38C-2.658 33×10-3AB+0.032 125AC-1.984 38BC-1.070 33×10-4A2-0.307 0B2-17.145 31C2;式中A为搅碎时间,B为提取溶剂倍数,C为提取溶剂的pH,R1为可溶性蛋白得率。
对该模型的方差分析结果见表3。由方差分析结果可知该模型 (P=0.00 04,P<0.05)显著,相关系数R2为0.961 6,模型调整系数Radj为0.912 2,失拟项 (P=0.563 7,P>0.05),表明失拟项相对于绝对误差不显著,该模型对实验的拟合程度良好,能较好的反映各因素与响应值之间的真实关系,可利用该模型对鲜地龙可溶性蛋白得率进行分析预测。
对模型回归方程的系数的显著检验分析可知,一次项A、B,交互项AC、BC,二次项A2、B2、C2均为显著影响项,表明各因素对可溶性蛋白得率的影响不是简单的线性关系。由F值的大小可以推断,在所选择的试验范围内,3个因素对可溶性蛋白得率影响的顺序为搅碎时间>提取溶剂倍数>提取溶剂pH。
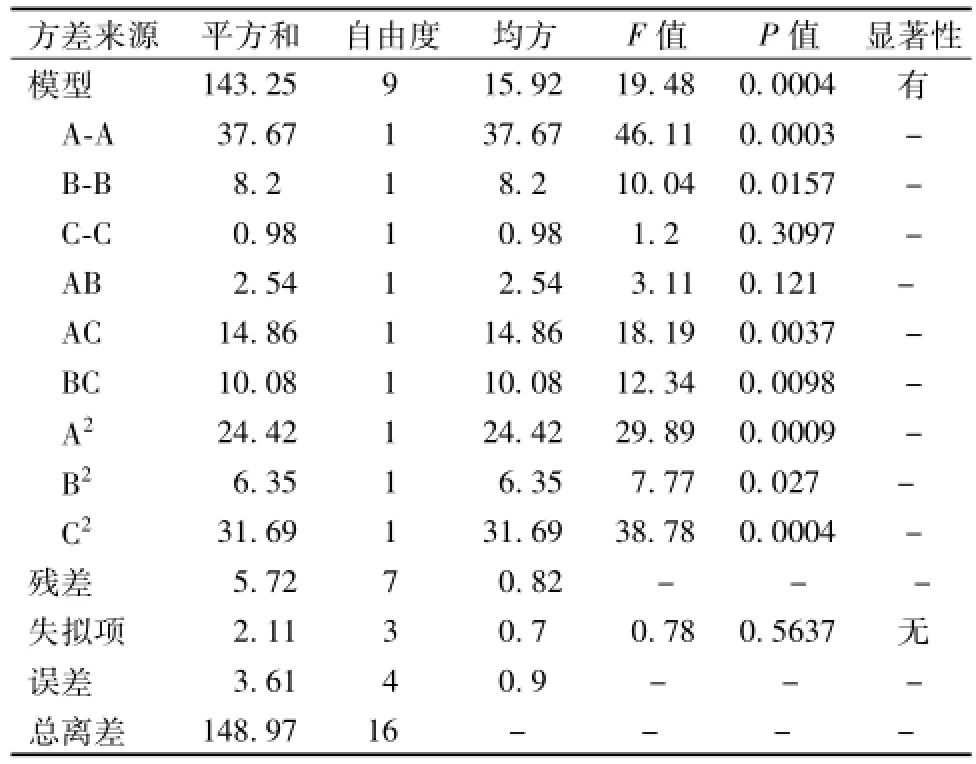
表3 方差分析Tab.3 ANOVA regression analysis
搅碎时间、提取溶剂倍数及提取溶剂pH3个因素间的交互作用对鲜地龙蛋白得率的影响如图1~3所示。
分析图1A~3A可知,当搅碎时间 (A)、提取溶剂倍数 (B)及提取溶剂pH(C)3个因素均取值较小时,响应曲面较陡,说明在各要素均处于较低水平时,各要素对蛋白得率R1的影响显著;而B、C均处于较高水平时,R1的响应面几乎为平面,说明,此时BC对R1的影响较小。
分析图1B~3B可知,各要素的影响与响应面分析结果一致;AC、BC等高线图均呈明显的椭圆形,说明搅碎时间和提取溶剂pH及提取溶剂倍数和提取溶剂pH两个因素之间的交互作用均显著,与方差分析结果一致。
经过Box-Behnken设计优化提取条件,鲜地龙可溶性蛋白提取的最佳工艺条件为:搅碎257 s,提取溶剂6.63倍,提取溶剂的pH为7.46,此时可溶性蛋白的理论得率为19.98%。

图1 搅碎时间和提取溶剂倍数对蛋白得率影响的效应面图及等高线图Fig.1 M ultip le effects of grinding time and extraction solven t on protein yield response surface map and contour plots

图2 搅碎时间和提取溶剂pH对蛋白得率影响的效应面图及等高线图Fig.2 Effects of grinding time and extraction solvent pH on protein yield response sur facemap and contour plots

图3 提取溶剂倍数和提取溶剂pH对蛋白得率影响的效应面图及等高线图Fig.3 Effects ofmu ltip le extraction solvent and pH on protein yield response surfacemap and contour m ap
2.3.3 验证试验 按最优提取工艺条件进行3次验证试验,结果蛋白质平均得率21.01%,RSD 1.34%,与理论值的相对误差为5.11%,说明该优选工艺重复性好,稳定可行。
3 讨论与结论
地龙中成分含有量最为丰富的物质即为蛋白质,近年来关于地龙药效的研究也表明蛋白质类成分是其主要的活性成分[10-12]。对于地龙蛋白的获取,以前多采用动物组织中可溶性蛋白获取的通用方法[13-14],采用高速匀浆或者低温冷浸,离心取上清液,无机盐或有机试剂沉淀,透析除盐,冷冻干燥获取粗蛋白。这些方法要么对设备要求高,要么有处理周期长、处理量小的缺点。而煎煮或者回流等热提方法本身容易破坏蛋白质的结构。本实验在冰浴超声提取方法优化的同时,对地龙蛋白的低温冷浸法进行了较深入的研究,发现低温冷浸法不仅提取周期长,而且蛋白得率不是很高,工艺重现的难度也较大。采用冰浴超声提取方法,不仅简单可行,而且蛋白提取率高、提取周期短。优化后的工艺粗蛋白得率可达21.01%,可以用于鲜地龙可溶性蛋白的提取。
本研究利用响应曲面分析法对冰浴超声法提取鲜地龙可溶性蛋白的工艺进行优化。结果表明此方法具有良好的应用性和预测性,能提供较准确的变量和误差信息,为鲜地龙可溶性蛋白的进一步研究提供了技术基础。
[1]国家药典委员会.中华人民共和国药典:2010年版二部[S].北京:中国医药科技出版社,2010:113.
[2]高学敏.中药学[M].北京:中国中医药出版社,2002:480-481.
[3]Mihara H.Fibrinolytic enzymes extracted from the earthworm. Lumbricus rubellus:a possible thrombolytic agent[J].Nihon Seirigaku Zasshi,1991,53(7):231-243.
[4]Trisina J,Sunardi F,Suhartono MT,et al.A protein extract from Lumbricus rubellus,possesses antithrombotic and thrombolytic activities[J].Biomed Biotechnol,2011,10(1155):1.
[5]Yan X M,Kim CH,Lee C K,etal.Intestinalabsorption of fibrinolytic and proteolytic lumbrokinase extracted from earthworm,eisenia and rei[J].Physiol Pharmacol,2010,14(2):71-75.
[6]Hwang C M,Kim D I,Huh S H,et al.In vivo evaluation of lumbrokinase,a fibrinolytic enzyme extracted from Lumbricus rubellus,in a prosthetic vascular graft[J].Cardiovasc Surg(Torino),2002,43(6):891-894.
[7]陈丽艳,张 迎,綦 菲,等.地龙的鲜品和干品可溶性蛋白及纤溶酶活性的对比研究[J].中国实验方剂学杂志,2012,18(8):89-92.
[8]毛泉明,张 宁,王忆勤,等.地龙中蛋白质的提取工艺研究[J].上海中医药杂志,2010,44(3):74-77.
[9]杨丰云,付延明,郭立伟,等.响应面分析法优化湿法超微粉碎地龙蛋白的提取工艺[J].中国实验方剂学杂志,2012,18(10):33-37.
[10]张兰娥,李清华,康 白,等.地龙蛋白肽的成分分析及对血管紧张素转化酶活力的影响[J].天然产物研究与开发,2013,25(12):1740-1742,1747.
[11]杨 明,陈学东,彭 韡.地龙蛋白组分Ⅲ对鼻咽癌裸鼠移植瘤微血管密度的影响[J].湖南中医药大学学报,2008,28(4):39-40.
[12]傅炜昕,董占双,李铁英,等.免疫活性地龙肽的制备及其对小鼠NK细胞活性的影响[J].中国医科大学学报,2007,36(6):650-652.
[13]卢 欢,朱和平,严国俊,等.正交设计优选地龙的提取工艺[J].现代中药研究与实践,2009,23(1):58-61.
[14]王子佳,李红梅,弓爱君,等.蛋白质分离纯化方法研究进展[J].化学与生物工程,2009,26(8):8-11.
Extraction optim ization for fresh earthworm protein by response surface m ethodology
HE Chao1, SUO Xu-bin2, ZHANG Han1, WANGWei-ming1*
(1.Heilongjiang Academy of Chinese Medicine Sciences,Harbin 150036,China;2.Guangdong College of Pharmacy,Guangzhou 51006,China)
response surfacemethodology(RSM);fresh earthworm;soluble protein;ice-bath ultrasound
R284.2
A
1001-1528(2015)04-0758-05
10.3969/j.issn.1001-1528.2015.04.014
2014-08-28
国家自然科学基金资助项目(80303288);黑龙江省应用技术研究与开发计划项目院所创新专项(2013G1081)
何 超(1989—),女,硕士生,从事中药研发。E-mail:hechao.1990@163.com
*通信作者:王伟明,女,博士,研究员,硕士生导师,从事中药及保健品研发。E-mail:zyyiy@163.com
