单叶蔓荆子提取工艺研究
2015-01-16张金莲李志强余书琦曾昭君
张金莲, 李志强, 余书琦, 曾昭君, 陈 香
(江西中医药大学,江西南昌330004)
单叶蔓荆子提取工艺研究
张金莲, 李志强, 余书琦, 曾昭君, 陈 香
(江西中医药大学,江西南昌330004)
目的优化单叶蔓荆子的提取工艺。方法在优化提取温度和时间的基础上,采用L9(34)正交表,以乙醇体积分数、乙醇用量、粉碎度和提取次数为考查因素,以浸膏得率、总黄酮含有量和蔓荆子黄素含有量为考查指标,采用综合加权评分法对测定结果进行分析。结果优化后的提取工艺为药材经粉碎机粉碎,过40目筛,加8倍量50%的乙醇,提取时间1 h,提取3次。结论该方法可行、稳定。
单叶蔓荆子;提取工艺;综合加权评分法;正交设计
蔓荆子为常用中药,以 “蔓荆实”之名始载于 《神农本草经》,列为上品[1],为马鞭草科植物单叶蔓荆Vitex trifolia L.var.simplicifolia Cham.或蔓荆Vitex trifolia L.的干燥成熟果实,有疏散风热、清利头目之功效[2]。该植物主产于我国江西、山东、浙江、安徽、福建等地[3-4],临床上常用于治疗风热感冒头痛、齿龈肿痛、目赤多泪、头晕目眩,尤其在治疗以头痛为主的多种疼痛症状方面疗效显著[5-6]。黄酮类化合物是蔓荆子镇痛、抗菌、消炎等药理作用的主要药效成分[7-10],其中蔓荆子黄素含有量是衡量其优劣的重要依据[2]。但中药的药效是多种物质共同作用的结果,故本实验以江西主产的单叶蔓荆子为研究对象,以浸膏得率、总黄酮含有量和蔓荆子黄素含有量为评价指标,优选该中药的提取工艺。
1 仪器和材料
1.1 仪器 ultimate 3000高效液相色谱仪,包括ultimate 3000自动进样器、ultimate 3000柱温箱、ultimate 3000色谱工作站(美国Thermo Fisher Scientific公司);UV-2550型紫外分光光度计(日本岛津仪器公司);Sartorius BS124电子天平 (北京赛多利斯仪器系统有限公司);HH-2数显恒温水浴锅 (国华电器有限公司);高速万能粉碎机 (天津市泰斯特一仪器有限公司);SZ-93自动双重纯水蒸馏器 (上海亚荣生化仪器厂);KQ3200超声波清洗器 (昆山超声仪器厂);GZX-9146MBE型数显鼓风干燥箱(上海博讯实业有限公司)。
1.2 对照品及试剂 蔓荆子黄素对照品 (中国药品生物制品检定所,批号111554-200503);芦丁对照品 (四川维克奇生物科技有限公司)。分析纯亚硝酸钠 (天津市大茂化学试剂厂);分析纯硝酸铝 (西陇化工股份有限公司);分析纯氢氧化钠 (天津市恒兴化学试剂制造有限公司);色谱纯甲醇 (美国Merck公司);水为超纯水 (自制);其他试剂均为分析纯 (国药集团化学试剂有限公司)。
1.3 实验药材 单叶蔓荆子购自江西新建县厚田镇,经江西中医药大学中药资源学科组赖学文副教授鉴定为马鞭草科植物单叶蔓荆Vitex trifolia L.var.simplicifolia Cham.的干燥成熟果实。
2 方法与结果
2.1 浸膏得率 精密称取10 g单叶蔓荆子 (M),按L9(34)正交试验表中的条件进行提取,然后合并提取液,过滤,置于恒定质量的蒸发皿中,水浴上浓缩蒸干,得到蔓荆子提取物 (m)。按 《中国药典》2010版ⅨH水分测定法第一法来测定提取物的含水量 (%),得浸膏得率(%)=m×(1-含水量%)÷M×100%,结果见表3。
2.2 蔓荆子黄素测定
2.2.1 色谱条件[2]Diamonsil-C18色谱柱(250 mm×4.6 mm,5μm);流动相为甲醇-0.4%磷酸水溶液 (60∶40);柱温30℃;体积流量1.0mL/min;进样量10μL;检测波长258 nm;理论塔板数按蔓荆子黄素计算,不得低于2 000。色谱图见图1。
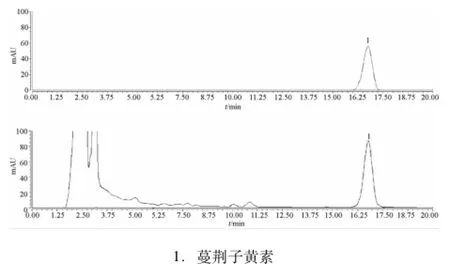
图1 对照品和蔓荆子提取物的HPLC色谱图
2.2.2 供试品溶液的制备 精密吸取 “2.1”项下的蔓荆子提取物,用甲醇溶解,定容至25 mL量瓶中,摇匀,即得供试品溶液。经0.45μm微孔滤膜滤过,取续滤液备用。
2.2.3 对照品溶液的制备 精密称定蔓荆子黄素对照品,置于50mL量瓶中,用甲醇溶解,定容,摇匀,即得对照品溶液,每1mL含蔓荆子黄素30μg。
2.2.4 线性关系考察 精密吸取蔓荆子黄素对照品溶液4、8、16、20、24、32μL,依次注入液相色谱仪中,以峰面积为纵坐标 (Y),对照品进样量为横坐标 (X)绘制标准曲线,得曲线方程Y=55.986X-0.169 3(r2=0.999 8,n=6)。结果表明,蔓荆子黄素在0.12~0.96μg范围内,进样量与峰面积呈现良好的线性关系。
2.2.5 精密度试验 精密吸取蔓荆子黄素对照品溶液10μL,“2.2.1”项条件下重复进样6次,记录峰面积值。结果测得RSD为1.31%,说明精密度良好。
2.2.6 稳定性试验 取同一供试品溶液,“2.2.1”项条件下于0、2、4、8、12、24 h进样10μL,记录峰面积值。结果测得RSD为0.27%,说明该溶液24 h内稳定性良好。
2.2.7 重复性试验 取3号蔓荆子提取物,按 “2.2.2”项下方法制备供试品溶液6份, “2.2.1”项条件下测定。结果测得RSD为0.87%,表明该方法重复性良好。
2.2.8 加样回收试验 精密称取3号蔓荆子提取物,并精密加入蔓荆子黄素对照品,按 “2.2.2”项下制备供试品溶液,“2.2.1”项条件下进行测定。结果测得蔓荆子黄素的平均加样回收率为102.23%,RSD为1.44%,结果见表1。
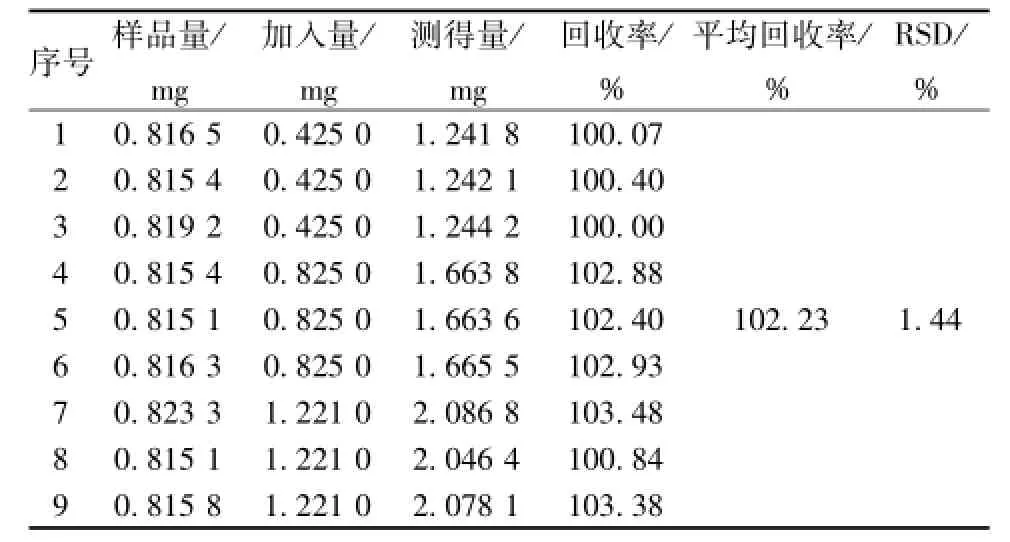
表1 加样回收率试验结果
2.3 蔓荆子总黄酮的测定[11-12]
2.3.1 对照品溶液的制备 精密称取芦丁对照品11.24 mg,置于50 mL量瓶中,用70%乙醇溶解,定容,摇匀,即得对照品溶液,每1 mL含无水芦丁0.224 8 mg。
2.3.2 测定方法 精密吸取 “2.1”项下蔓荆子提取物,用70%乙醇溶解,依次加入5%亚硝酸钠溶液1 mL(放置6min)、10%硝酸铝溶液1mL(放置6min)、4%NaOH溶液10mL,摇匀。之后加入70%乙醇,定容至25 mL量瓶中,放置20 min,采用紫外分光光度法于504 nm处测定吸光度。
2.3.3 线性关系考察 精密吸取 “2.3.1”项下对照品溶液1.0、2.0、3.0、4.0、5.0、6.0 mL,按 “2.3.2”项下方法测定,以吸光度 (A)为纵坐标,对照品质量浓度(C)为横坐标绘制标准曲线,得回归方程A=0.009 5C-0.032 1(r2=0.999 2)。结果表明,芦丁在8.992~53.952 μg/mL范围内线性关系良好。
2.3.4 精密度试验 精密吸取芦丁对照品溶液,按“2.3.2”项下方法操作,连续测定6次,记录吸收值。结果测得RSD为2.17%,说明精密度良好。
2.3.5 稳定性试验 精密吸取同一供试品溶液,按“2.3.2”项下方法操作,分别在0、15、30、60、90、120 min测定,记录吸收值。结果测得RSD为0.73%,说明该溶液在120 min内稳定性良好。
2.3.6 重复性试验 取3号蔓荆子提取物,按 “2.3.2”项下方法制备供试品6份进行测定,记录吸收值。结果测得RSD为1.40%,说明该方法重复性良好。
2.3.7 加样回收试验 精密称取3号蔓荆子提取物,加入芦丁对照品,按 “2.3.2”项下方法制备供试品6份进行测定,计算回收率。结果测得平均回收率为97.88%,在95%~105%范围内,RSD为0.75%。
2.4 正交试验
2.4.1 正交试验设计 在单因素试验的基础上,选择乙醇体积分数 (A)、乙醇用量 (B)、粉碎度 (C)、提取次数(D)为考查因素,每个因素选择3个水平,设定因素水平表,见表2。

表2 正交因素水平
2.4.2 正交试验结果 按照L9(34)正交设计表的条件进行试验,分别测定浸膏得率、提取物总黄酮含有量和蔓荆子黄素的含有量,计算提取率,并进行综合加权评分。由于单叶蔓荆子的主要黄酮类化合物为蔓荆子黄素,且其含有量为 《中国药典》2010年版规定的蔓荆子质量评价指标,故在正交试验结果的总体评价中,以蔓荆子黄素的提取率为主,权重系数为0.7;总黄酮提取率和浸膏得率为辅,权重系数分别为0.2和0.1,以综合值进行统计分析,综合评分值M=(0.1X/17.82+0.7Y/0.163+0.2Z/3.205)×100,结果见表3~4。
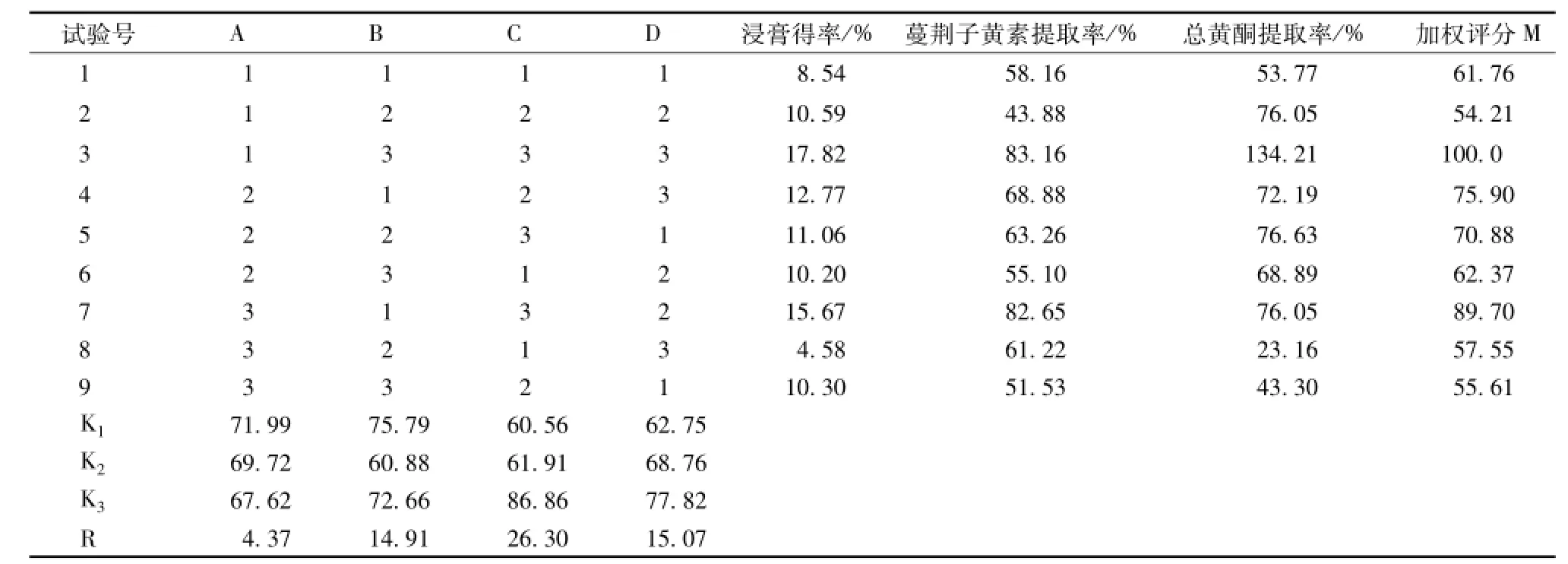
表3 正交试验方案及结果
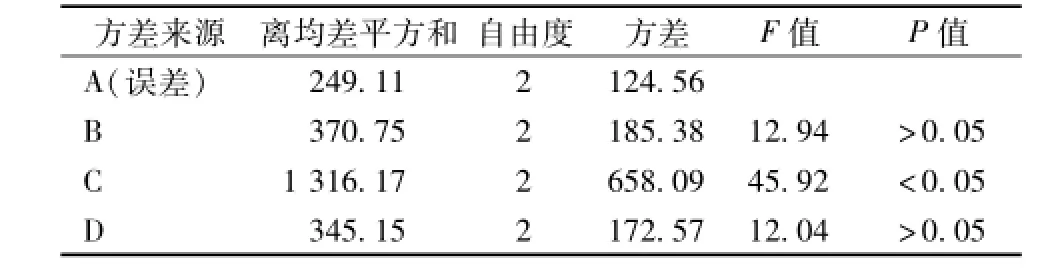
表4 方差分析结果
分析表明,根据极差R的大小,可以判断各因素对试验结果的影响。由表3可以看出,R3>R4>R2>R1,所以各因素对试验指标影响的主次顺序为C>D>B>A,即药材的粉碎度影响最大,其次为提取次数和溶剂用量,而乙醇体积分数影响最小。表4方差分析发现,C(粉碎度)对试验结果有显著性影响 (P<0.05),而B(乙醇用量)和D(提取次数)则无显著性影响 (P>0.05)。同时在比较F值大小时,可以判断各因素对试验结果影响的主次顺序为C>D>B,与直观分析结果相同。综上所述,确定A1B1C3D3为最适宜的提取工艺,即药材经粉碎机粉碎,过40目筛,加8倍量50%的乙醇,提取3次,每次1 h。
2.5 优选工艺验证 为了保证提取工艺的重复性和可行性,对优选的方案A1B1C3D3进行验证试验,结果见表5。由表可知,该工艺稳定可行,重复性好。
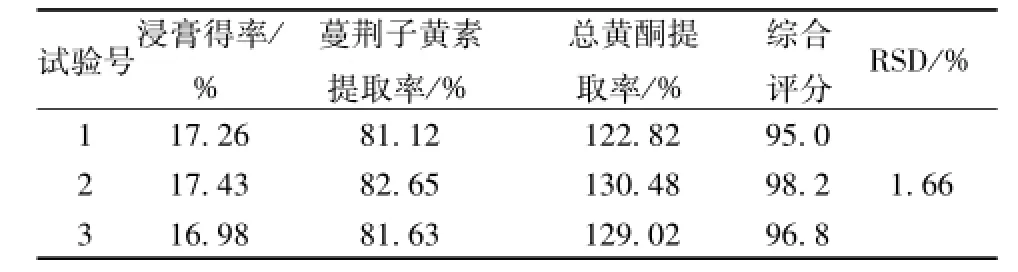
表5 验证试验
3 讨论
3.1 提取溶剂的选择 蔓荆子的主要活性成分为黄酮类化合物,多以苷元的形式存在,脂溶性较强[13-14]。该类成分以蔓荆子黄素为主,难溶于水,易溶于甲醇、乙醇、氯仿等溶剂,其中乙醇是中药大生产提取常用的溶媒,易于回收,价格便宜,因此选择乙醇为提取溶剂。
3.2 单次提取时间的选择 通过比较单次提取时间(0.25、0.5、1.0、1.5、2.0 h)对蔓荆子浸膏得率、总黄酮含有量和蔓荆子黄素含有量的影响,发现提取时间越长,其得率和含有量越高,而且在1.0 h、1.5 h、2.0 h内无显著性差异。综合考虑提取效率和资源节约,故确定单次提取时间为1.0 h。
3.3 测定波长的选择 取供试品溶液,以70%乙醇为空白对照,加入显色剂,按紫外分光光度法在450~800 nm范围内扫描。结果供试品溶液在504 nm处产生最大吸收,故选择504 nm为测定波长。
3.4 考察指标选择 蔓荆子疏散风热、清利头目的功效不是某个单一成分作用的结果,而是由多种物质共同作用所致,故应综合考虑浸膏得率、总黄酮、蔓荆子黄素等多个考察指标。由于蔓荆子黄素是 《中国药典》规定的检测指标,也是蔓荆子药效的主要物质之一,故在分配权重系数时,蔓荆子黄素定为0.7,总黄酮定为0.2,浸膏得率定为0.1,这种多指标综合加权评分法可避免单一评价的片面性,使分析指标更全面,同时对关键影响因素又给予相应侧重,使分析结果更为客观。虽然有效成分是中药发挥药效的物质基础,但由于中药成分复杂多样,故应在成分考察的基础上,对相关动物模型进行深入研究,结合反映药效的指标来优化提取工艺,为蔓荆子提取物的生产工艺提供可靠的参考依据。
[1]刘红燕,彭艳丽,万 鹏.蔓荆子本草学考证[J].山东中医杂志,2006,25(2):126-128.
[2]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:340-341.
[3]中国科学院 《中国植物志》编写委员会.中国植物志:第53卷第1分册[M].北京:科学出版社,1984:91-92.
[4]福建省科学技术委员会 《福建植物志》编写组.福建植物志:第4卷[M].福州:福建科学技术出版社,1989:538-542.
[5]辛海量,胡 园,张巧艳,等.蔓荆子的化学成分研究[J].第二军医大学学报,2006,27(9):1038-1040.
[6]刘素君.蔓荆子的研究近况[J].乐山师范学院学报,2008,23(5):39-41.
[7]王 冬,李秋红,周 凯.蔓荆子的化学、药理与炮制研究进展[J].中医药学报,2008,36(1):69-71.
[8]田 华,杜 婷,黄开合,等.蔓荆子的药理作用研究进展[J].中国医药导报,2013,10(9):29-30.
[9]陈鸿雁,程伟贤,冯 宇,等.单叶蔓荆子黄酮类化学成分研究[J].天然产物研究与开发,2008,20(4):582-584.
[10]陈柳生,康大力.蔓荆子中化学成分的研究[J].海峡药学,2008,20(7):90-92.
[11]殷 红,胡永洲,杨鑫骥,等.正交设计研究杭白菊总提取物及总黄酮提取工艺[J].中国中药杂志,2004,29(8):24-26.
[12]宋秋烨,陈 梅,吴启南.淡竹叶中总黄酮提取工艺研究[J].中国中医药信息杂志,2007,14(3):46-47.
[13]辛海量,胡 园,张巧艳,等.正交试验优选蔓荆子提取工艺研究[J].药学服务与研究,2006,6(5):342-344.
[14]尹文清,陈柳生,王力生,等.正交设计优选蔓荆子中总黄酮的提取工艺[J].中草药,2007,38(2):216-217.
R284.2
:B
:1001-1528(2015)06-1363-04
10.3969/j.issn.1001-1528.2015.06.048
2014-04-12
江西省卫生厅中医药科研计划课题资助项目 (2013Z003);江西中医药大学道地药材及特色中药资源研究专项资助项目(ZX1016)
张金莲 (1969—),女,硕士,副教授,硕士生导师,从事中药学教学研究。Tel:(0791)87118995,E-mail:jxjzzjl@ 163.com
