醋炙对甘遂3种三萜类成分的影响及肠上皮细胞的毒性
2015-01-13王文晓杨艳菁曹亮亮丁安伟
王文晓, 杨艳菁, 曹亮亮, 张 丽, 丁安伟
(南京中医药大学江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏南京210023)
醋炙对甘遂3种三萜类成分的影响及肠上皮细胞的毒性
王文晓, 杨艳菁, 曹亮亮, 张 丽*, 丁安伟
(南京中医药大学江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏南京210023)
目的研究甘遂醋炙前后3种三萜类成分(大戟二烯醇、kansenone、11-oxo-kansenonol)含有量变化及其对肠上皮细胞的毒性。方法采用HPLC法分别在210、255、270 nm测定甘遂和醋甘遂饮片中该3种成分的量。采用MTT法检测3种成分对大鼠小肠隐窝上皮细胞IEC-6细胞增殖的影响。结果醋炙后大戟二烯醇、kansenone、11-oxokansenonol含有量均降低,降低率分别为13.43%、15.15%、14.79%。对IEC-6细胞的IC50分别为71.41、15.27和14.53μmol/L。结论甘遂醋炙后3种三萜类成分含有量的降低与醋炙减毒有一定的相关性。
甘遂;醋炙;IEC-6;大戟二烯醇;kansenone;11-oxo-kansenonol
甘遂为大戟科大戟属植物甘遂Euphorbia kansui T.N.Liou ex T.P.Wang的干燥块根,味苦,性寒,有毒,素有峻下逐水圣药之称[1]。但甘遂强烈的皮肤刺激性,严重的肝脏、胃肠道毒性以及促炎、诱发肿瘤等毒性[2],严重制约了其临床的安全应用。历代中医采用醋制法降低甘遂的毒性和刺激性,缓和其泻下作用。研究表明,甘遂的毒性成分主要集中在石油醚和乙酸乙酯部位中的二萜与三萜类成分[3-4]。然而既往甘遂醋炙减毒的物质基础报道多集中在甘遂中二萜类成分毒性方面,较少涉及甘遂中三萜类化合物的毒性以及与醋炙减毒相关性的研究[5-7]。因此,本实验拟以大鼠小肠隐窝上皮细胞 (IEC-6)为研究对象,探讨甘遂中大戟二烯醇、kansenone、11-oxo-kansenonol这3种三萜类成分对肠上皮细胞的毒性并比较醋炙前后该3种成分的含有量变化,为进一步阐明甘遂醋炙减毒的物质基础提供依据。
1 仪器与材料
1.1 仪器 Waters 2695高效液相色谱仪(美国Waters公司)、Waters 2996 PDA检测器、BP211D型电子天平(精确到0.01 mg)、SW-CJ-1FD超净工作台 (苏州净化设备有限公司)、CO2恒温培养箱(日本SANYO公司)、倒置显微镜(日本Olympus公司)、powerwave X340全波长酶标仪(美国Bio-Tek公司)。
1.2 试剂 甲醇 (色谱纯,江苏汉邦科技有限公司),乙腈 (色谱纯,美国Tedia公司),水为重蒸水,DMEM高糖培养基干粉(Gibco,赛默飞世尔科技有限公司),胎牛血清 (维森特生物技术有限公司,批号085-150),磷酸缓冲盐 (PBS,博士微生物工程有限公司,批号 AR0030),胰蛋白酶(韩国Bio-sharp公司,批号27250-018),MTT(北京索莱宝科技有限公司,批号M8180)。
1.3 实验材料
1.3.1 药材 甘遂药材购自陕西宝鸡赤沙乡,经南京中医药大学王春根教授鉴定为大戟科Euphorbiaceae植物甘遂Euphorbia kansui T.N.Liou ex T. P.Wang的干燥块根,批号20131008。取生甘遂,大小分档,除去杂质,即为甘遂生品。取净甘遂,照 《中国药典》2010年版一部醋炙法 (附录ⅡD)加醋拌匀,闷透,待醋被吸尽后,将炒锅加热到260℃左右,不断翻炒,9 min后出锅,放凉,即为甘遂醋炙品。每100 kg甘遂用醋30 kg。颜色加深,略有焦斑。
1.3.2 对照品 大戟二烯醇、kansenone、11-oxokansenonol为实验室自制,经HPLC法检测,纯度均大于98%。化学结构见图1。
1.3.3 细胞 大鼠小肠隐窝上皮细胞株IEC-6(购自ATCC细胞库)。
2 方法与结果
2.1 甘遂醋炙前后三萜类成分变化
2.1.1 供试品溶液的制备 分别称取生甘遂、醋甘遂粉末 (过4号筛)各0.2 g,精密称定,置于具塞锥形瓶中,精密加入甲醇10 mL,密塞,称定质量,超声提取 (功率250 W,频率50 kHz)30 min,放冷,密塞再称定质量,用甲醇补足减少的质量,摇匀,滤过,取续滤液,即得。
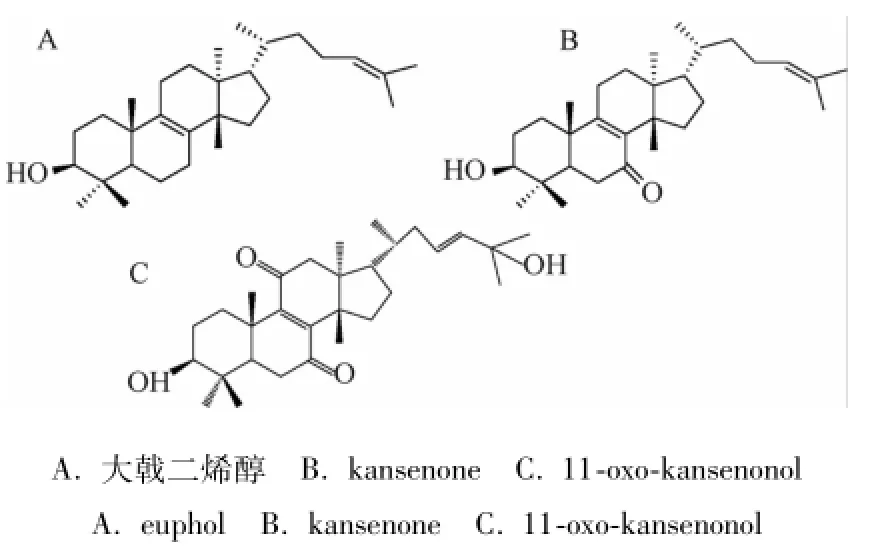
图1 成分化学结构Fig.1 Structure of coMpounds
2.1.2 对照品溶液的制备 精密称取大戟二烯醇、kansenone、11-oxo-kansenonol对照品适量,加甲醇制成分别为1.082、0.894、1.100 mg/ML的对照品贮备液。取各对照品贮备液适量,制成含大戟二烯醇、kansenone、11-oxo-kansenonol分别为259.6、14.31、13.20μg/mL的1号混合对照品溶液。
2.1.3 色谱条件 Agilent Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5μm);流动相为水(A)-乙腈 (B),梯度洗脱 (0~13 min,50%~20% A;13~19 min,20%~15%A;19~22 min,15%~10%A;22~30 min,10%A;30~35 min,10%~50%A)。体积流量1.0 mL/min;检测波长210 nm(大戟二烯醇)、255 nm(kansenone)、270 nm(11-oxo-kansenonol);柱温30℃;进样量20 μL。此条件下样品中大戟二烯醇、kansenone、11-oxo-kansenonol与其他成分可达到基线分离。见图2。
2.1.4 方法学考察
2.1.4.1 线性关系考察 精密量取1号混合对照品溶液5 mL置10 mL量瓶中,加甲醇至刻度,摇匀,得2号混合对照品溶液,同法,采用逐步稀释法,分别制得3~6号混合对照品溶液。按“2.1.3”项下色谱条件,精密吸取上述各对照品溶液20μL注入高效液相色谱仪,每份溶液平行进样2次。按标准曲线法以峰面积计算,以各对照品峰面积平均值为纵坐标 (Y),对照品质量浓度(μg/mL)为横坐标 (X),绘制标准曲线,得各成分回归方程为:大戟二烯醇Y=231 828.110X-611 120.995 0(r=0.999 3);kansenone Y= 13 397.678X+714.039 8(r=0.999 6);11-oxo-kansenonol Y=4 444.400 X+251.422 9(r= 0.999 6)。表明大戟二烯醇、kansenone、11-oxokansenonol的进样量分别在0.162~5.192μg,0.009~0.282μg,0.008 3~0.264μg之间呈良好的线性关系。
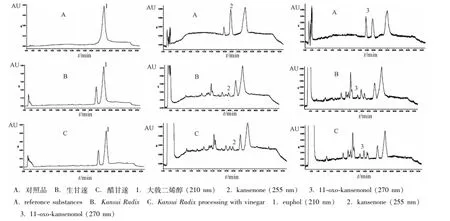
图2 甘遂醋炙前后HPLC图Fig.2 HPLC chromatograMs of Kansui Radix before and after beging p rocessed w ith vinegar
2.1.4.2 精密度试验 在上述色谱条件下,以4号混合对照品溶液为考察对象,依法测定,连续进样6次,得大戟二烯醇、kansenone、11-oxo-kansenonol峰面积的RSD分别为0.8%、1.0%、1.1%。
2.1.4.3 重复性试验 精密称取同一批甘遂生品6份,均依法处理并进行测定。计算得大戟二烯醇、kansenone、11-oxo-kansenonol的RSD分别为1.1%、1.3%、1.8%。
2.1.4.4 稳定性试验 取供试品溶液,分别于0、2、4、6、8、12 h进样20μL,测定峰面积,计算得大戟二烯醇、kansenone、11-oxo-kansenonol峰面积的RSD分别为1.1%、0.9%、1.4%。
2.1.4.5 加样回收率试验 取已知含有量的甘遂生品粉末约0.1 g,共6份,精密称定。分别加入各对照品适量,按 “2.1.1”项下方法制备供试品溶液,依法测定峰面积,计算回收率,结果见表1。2.1.5 样品测定 分别取甘遂、醋甘遂粉末约0.2 g,精密称定,按 “2.1.1”项下方法制备供试品溶液,依法测定,每份溶液连续进样2次。以峰面积平均值按标准曲线法计算各供试品样品中大戟二烯醇、kansenone、11-oxo-kansenonol的量,变化率计算公式为:(生品平均值-醋品平均值)/生品平均值×100%。结果见表2。
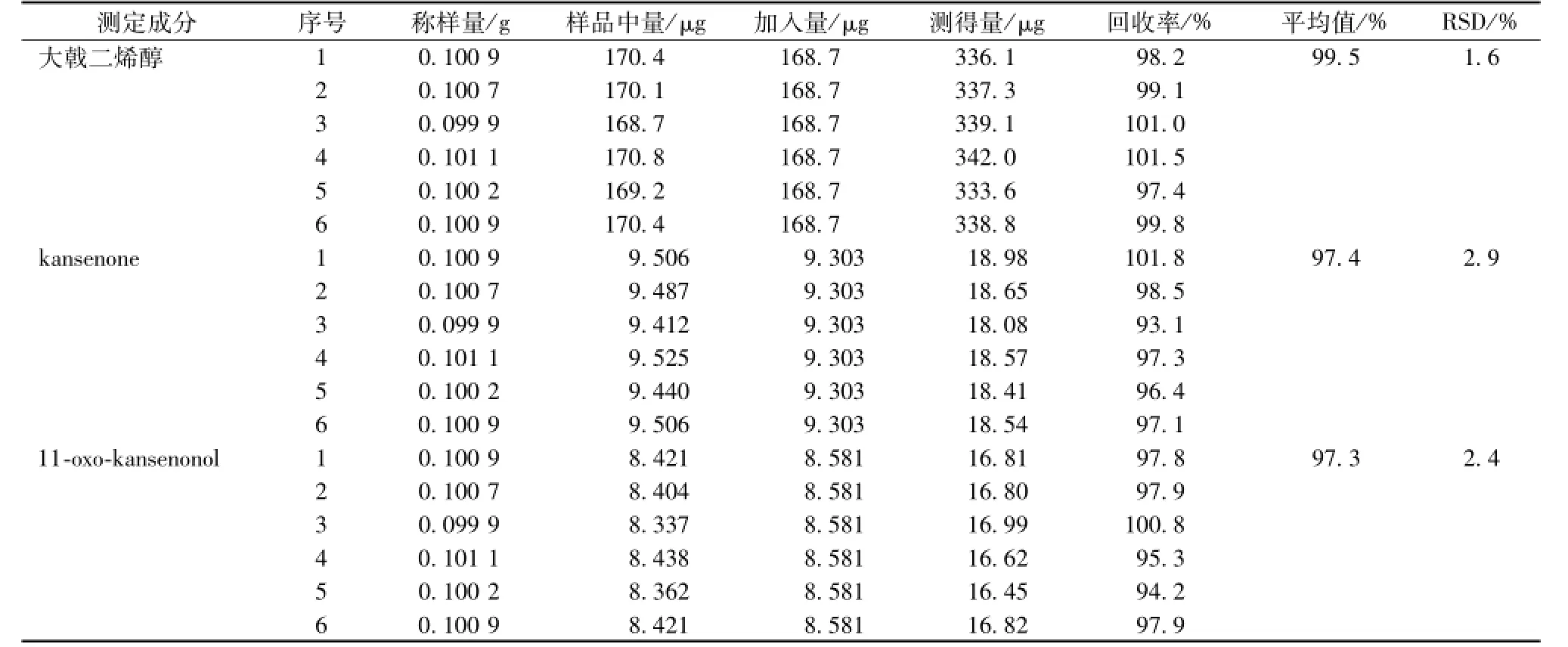
表1 加样回收试验结果Tab.1 Results of recovery tests

表2 甘遂炮制前后成分测定结果 (n=6)Tab.2 Results of quantitative deterMination of Kansui Radix before and after beging processed(n=6)
2.2 对肠上皮细胞的毒性实验
2.2.1 供试品的制备 取大戟二烯醇、kansenone、11-oxo-kansenonol适量,精确称定,加DMSO溶解制成质量浓度为10 mg/mL的样品贮备液,以0.22μm滤器推滤除菌,4℃保存备用。实验时以DMEM培养液稀释至所需质量浓度(C1~C5),其中大戟二烯醇质量浓度 (C1~C5)分别为1.5、3.0、6.0、12.0、24.0μg/mL;kansenone和11-oxo-kansenonol的质量浓度(C1~C5)分别为0.75、1.5、3.0、6.0、12.0μg/mL。
2.2.2 细胞培养 IEC-6细胞常规培养于含10%胎牛血清的DMEM培养液中,置于37℃,5% CO2的饱和湿度细胞培养箱中培养。每天换液,取对数生长期细胞用于本实验。
2.2.3 MTT法测定大戟二烯醇、kansenone、11-oxo-kansenonol对IEC-6细胞相对增殖抑制率(IC50) 取对数生长期的IEC-6细胞,用含0.03%EDTA-0.25%胰蛋白酶液消化,用含10%胎牛血清的培养液制成单细胞悬液,调整细胞密度为1×105个/mL,每孔100 mL接种于96孔板中,置于37℃,5%CO2的饱和湿度培养箱中培养。孵育24 h后,轻轻吸弃上清,随机分为空白对照组、大戟二烯醇给药组、kansenone给药组、11-oxo-kansenonol给药组。各给药组分别加入100 mL不同质量浓度 (C1~C5)的供试品溶液,每个质量浓度设6复孔。空白对照组加入等体积的DMEM细胞培养液,置于37℃,5%CO2的饱和湿度培养箱中培养48 h后,每孔加入新鲜配制的5 mg/mL的MTT溶液20μL,继续培养4 h,轻轻吸弃上清,每孔加入DMSO溶液150μL,水平摇床混匀后,酶标仪于 490 nm波长处测定吸光度(A)。按下式计算甘遂各供试品对IEC-6细胞增殖的相对抑制率 (IR)。
IR%=(1-A给药组均值/A空白对照组均值)×100%
2.2.4 数据分析 实验数据采用SPSS 20.0软件进行统计分析,各组定量检测数据以x±s表示,两组间比较采用t检验,多组间比较采用单因素方差(one-way ANOVA)分析,组间比较采用LSD检验。
2.2.5 实验结果 实验结果表明,kansenone、11-oxo-kansenonol对IEC-6均有较强的增殖抑制作用,且随浓度的增加,抑制作用增强。大戟二烯醇、kansenone、11-oxo-kansenonol对IEC-6细胞的IC50分别为71.41、15.27、14.53μmol/L。实验结果见图5。

图5 大戟二烯醇、kansenone、11-oxo-kansenonol对IEC-6细胞增殖的影响(n=6)Fig.5 Dose-dependen t inhibition effects of euphol,kansenone and 11-oxo-kansenonol on IEC-6 cell proliferation(n=6)
3 讨论
肠黏膜屏障具有保护胃肠黏膜免受酸、碱、酶、细菌和毒素等肠道内容物损伤的作用[8]。但在创伤、应激等情况下,其结构和功能可受到严重损害,从而引起一系列病理生理的变化[9]。隐窝细胞的增殖是肠黏膜病理性损伤后,修复重建上皮完整性和维护黏膜屏障的关键[8]。由于甘遂的毒性主要表现在胃肠道部位,故本实验采用肠上皮细胞进行相关的研究。大鼠小肠隐窝上皮细胞(IEC-6)保持了小肠上皮干细胞未分化的特性,与增殖性隐窝细胞没有明显差别[10],其广泛用于研究小肠上皮细胞的生长、分化、代谢等功能,药物作用以及各种致病因素作用下的肠黏膜的病理生理改变及其发病机制等,是研究和检查黏膜愈合、细胞增殖反应等较合适的体外模型[11-12]。
《中国药典》2010年版甘遂含量测定项下采用C8柱、乙腈-水 (95∶5)、检测波长210 nm测定甘遂中大戟二烯醇的量,因kansenone、11-oxokansenonol与大戟二烯醇具有相同的母核,极性较小,宜采用C8柱,且均具有共轭结构,在紫外下有较强吸收,故本实验采用高效液相色谱-多波长检测法,根据3个成分的最大吸收波长,在C8色谱柱上同时检测大戟二烯醇(210 nm)、kansenone(255 nm)和11-oxo-kansenonol(270 nm)。
本实验室前期研究表明,乙酸乙酯部位为甘遂的毒性部位,而大戟二烯醇、kansenone、11-oxokansenonol 3种成分均由乙酸乙酯部位分离纯化得到[13]。本实验结果表明醋炙后3种成分的含有量均有一定程度的降低,分析其原因可能是由于在醋炙过程中经历酸性高温的环境后,引发了氧化、水解或重排等反应,导致含有量改变和结构转化。在前期研究中发现,甘遂醋炙后其乙酸乙酯部位对小鼠肠损伤明显低于醋炙前,本实验中亦观察到kansenone、11-oxo-kansenonol对IEC-6细胞的增殖有较强的抑制作用,且呈浓度依赖性。由此,推测甘遂经醋炙后对IEC-6细胞的减毒效应可能与其醋炙后大戟二烯醇、kansenone、11-oxo-kansenonol等3种成分的减少有关,为进一步探讨醋炙减毒物质基础提供了依据。但本实验所用药材饮片仅为主产地一批,且主要研究了三萜类毒性代表性物质炮制前后的含有量变化,因此,后续将对多产地多批次的药材以及炮制后化学成分的转化及其产物毒性评价做进一步研究。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:81.
[2]郑维发.甘遂醇提物中4种二萜类化合物的体内抗病毒活性研究[J].中草药,2004,35(1):65.
[3]耿 婷,黄海燕,丁安伟,等.甘遂炮制前后各部位刺激性和泻下作用研究[J].中南药学,2008,6(4):385-388.
[4]曹雨诞,张 丽,李 媛,等.甘遂的毒性成分、炮制方法及炮制减毒机制的研究进展[J].中国药房,2011,22(19):1817-1818.
[5]颜晓静,张 丽,李 璘,等.醋制降低甘遂对人正常肝细胞毒性研究[J].中国中药杂志,2012,37(11):1667-1671.
[6]李征军,李 媛,高 兰,等.甘遂不同炮制品中二萜类成分的变化研究[J].中成药,2011,33(12):2121-2125.
[7]Zhang L,Gao L,Li Z J,etal.Bio-guided isolation of the cytotoxic terpenoids froMthe roots of Euphorbia kansui against human normal cell lines L-O2 and GES-1[J].Int J Mol Sci,2012,13(9):11247-11259.
[8]HiroshiM,Wu D C,Daniel K,et al.Impaired defense of intestinalmucosa in mice lacking intestinal trefoil factor[J].Science,1996,274(5285):262-265.
[9]石 刚,陈嘉勇,徐鹏远.肠道粘膜屏障的损伤与保护[J].肠外与肠内营养,2004,11(1):61-63.
[10]Quaroni A,Wands J,Trelstad R L,et al.Epithelioid cell cultures froMrat small intestine.Characterization by morphologic and immunologic criteria[J].J Cell Biol,1979,80(2):248-265.
[11]Carrol KM,Wong T T,Drabik D L,etal.Differentiation of rat small intestinalepithelial cells by extracellularmatrix[J].AMJ Physiol,1988,254(3 Pt1):G355-360.
[12]冉新泽,粟永萍,程天民.等.大鼠小肠上皮细胞培养体系的建立及其影响因素的探讨[J].中国现代医学杂志,1997,7(5):8-11.
[13]高 兰,颜晓静,李征军,等.醋制降低甘遂对小鼠胃肠道氧化损伤作用机制研究[J].中国实验方剂学杂志,2013,19(10):257-260.
Triterpenes change of processing Kansui Radix w ith vinegar and their toxicity to intestinal epithelial cells
WANGWen-xiao, YANG Yan-jing, CAO Liang-liang, ZHANG Li*, DING An-wei
(Jiangsu Collaborative Innovation Center of ChineseMedicinal Resources Industrialization,and Nationaland Local Collaborative Engineering Center of ChineseMedicinal Resources Industrialization and Formulae InnovativeMedicine,Nanjing University of ChineseMedicine,Nanjing 210046,China)
AIMTo study the content changes of euphol,kansenone and 11-oxo-kansenonol froMKansui Radix before and after processingwith vinegar and their toxicity to intestinalepithelial cells.METHODSThe assay of triterpenes in processing Kansui Radix with vinegarwasmeasured at210 nm,255 nMand 270 nMby HPLC,respectively.The MTT assay wasemployed to examine the growth inhibition of IEC-6 cellswhich were pretreated with these triterpenes.RESULTSThe contents of the three kinds of triterpenes decreased during the processing,and the reduction rates were 13.43%,15.15%,and 14.79%,respectively.The IC50values of IEC-6 cells were 71.41,15.27,and 14.53μmol/L,respectively,after being pretreated with triterpenes.CONCLUSIONThe experimental data indicate that there is a certain correlation between the reduction in the three kinds of triterpenes' contents and the attenuation during processing with vinegar.
Kansui Radix;processing with vinegar;IEC-6;euphol;kansenone;11-oxo-kansenonol
R283
:A
:1001-1528(2015)05-1045-05
10.3969/j.issn.1001-1528.2015.05.026
2014-07-24
国家自然科学基金项目 (30973940,81373972);国家重点基础研究发展计划 (973) 项目 (2011CB505300,2011CB505303);江苏省 “六大人才高峰”项目 (2010年度);江苏省政府留学奖学金项目 (JS-2009-061);江苏高校优势学科建设工程资助项目(ysxk-2014)
王文晓,硕士生。Tel:18252066631,E-mail:zwangwenxiao@163.com
*通信作者:张 丽,教授,从事中药炮制与质量控制研究,Tel:(025)85811519,E-mail:zhangliguanxiong@163.com
