抗代谢类抗肿瘤药物对人肿瘤细胞中核苷酸代谢的影响
2015-01-12刘昊昆胡文艺孙立新沈阳药科大学药学院沈阳110016
王 迪,魏 岚,刘 希,刘昊昆,胡文艺,孙立新(沈阳药科大学药学院,沈阳 110016)
·药剂·
抗代谢类抗肿瘤药物对人肿瘤细胞中核苷酸代谢的影响
王 迪,魏 岚,刘 希,刘昊昆,胡文艺,孙立新*(沈阳药科大学药学院,沈阳 110016)
目的 研究抗代谢类抗肿瘤药物对人肿瘤细胞核苷酸代谢的影响。方法 采用离子对高效液相色谱法测定药物作用前后12种人肿瘤细胞中的12种核苷酸组分的含量,通过对主成分分析并结合单因素方差分析及受试者工作曲线分析、寻找与药物作用相关的标记物。结果 对照组与加药组之间核苷酸代谢模式存在差异,筛选出贡献较大的组分为ATP、ADP、GMP和UDP,结合ROC曲线分析可知ATP、GMP和UDP具有一定的诊断准确性。结论 ATP、UDP和GMP为药物作用相关的最佳生物标记物。
抗代谢药;人肿瘤细胞;核苷酸;生物标记物
肿瘤从本质上说是一种基因病,其发生是某些染色体上的DNA损伤而使基因突变的结果,涉及不同染色体上多种基因的变化[1]。研究显示,肿瘤细胞的基因经常在不同位点发生修饰,从脱氧核糖核酸碱基对改变的点突变到染色体交换等明显问题都有发生。而基因是DNA的一部分,核苷酸为DNA的基本组成单位,基因突变必将导致细胞内核苷酸水平的改变。
肿瘤细胞代谢极其旺盛,肿瘤的发生发展势必伴随着细胞内外微环境的变化。在癌症进展早期,核苷酸的缺乏将增加DNA复制压力并导致基因不稳定性增加[2]。据研究报道,肿瘤细胞从一个生长期转变为另一个生长期时常伴有核苷酸库、核苷库以及碱基库更新速率的变化,例如,与平台期相比,增殖期在利用嘌呤前体物质方面更高效[3]。在各种癌症病人的血浆中,游离脱氧核糖核酸的水平会升高,这在伴有肿瘤转移的病人中尤其明显,而病人治疗后游离脱氧核糖核酸保持着高水平通常是预后差的标志[4]。因此,肿瘤的发生、发展和治疗均与机体核苷酸水平密切相关。
目前,已有通过细胞核苷酸库的变化来探索药物作用机制的报道[5-10],但对细胞内核苷酸类代谢物的分析多集中于三磷酸核苷酸,而对单、双及三磷酸核苷酸同时测定的报道较少。本实验选择抗代谢类抗肿瘤药物5-氟尿嘧啶(5-Fu)、阿糖胞苷(Ara-C)和甲氨蝶呤(MTX)作为外界扰动,给予细胞刺激,考察细胞中12种单、双及三磷酸核苷酸的代谢变化,寻找与药物作用相关的生物标记物,从分子水平对其作用机制进行探讨。
1 仪器与材料
1.1 仪器 L-2130高效液相色谱仪购于Hitachi High-Technologies公司;Multiskan MK3酶标仪购于赛默飞世尔(上海)仪器有限公司。
1.2 材料 ATP-Na2、dUTP-Na3、CTP-Na2、UTPNa2、dATP-Na3、dGTP-Na4和dCTP-Na3对照品,购于美国Sigma-Aldrich公司;GDP-Na2、GMP-Na2、UDP-Na2、ADP-Na2和AMP-Na2对照品,购于上海源叶生物科技有限公司;氟尿嘧啶注射液购于天津金耀集团有限公司;注射用甲氨蝶呤购于山西普德药业有限公司;注射用盐酸阿糖胞苷购于浙江海正药业股份有限公司;四丁基氢氧化铵(质量分数10%)水溶液购于天津市科密欧化学试剂有限公司;甲醇(色谱级)购于山东禹王实业有限公司;三氯乙酸、磷酸二氢钾、氢氧化钾、二甲亚砜均为分析纯,购于天津博迪化工股份有限公司;高糖DMEM培养基、RPMI-1640培养基购于美国Gibico公司;四季青胎牛血清购于杭州四季青生物工程有限公司;TBD标准胎牛血清购于天津市灏洋生物制品科技有限责任公司;MTT(溴化-3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四氮唑)、HEPES(4-羟乙基哌嗪乙磺酸)、胰蛋白酶购于美国Amresco公司;PBS(磷酸盐缓冲液)购于北京中杉金桥生物技术有限公司;注射用硫酸链霉素购于山东鲁抗医药股份有限公司;注射用青霉素钠购于华北制药股份有限公司。
2 方法
2.1 细胞培养及抗肿瘤活性测定 所有细胞由本实验室传代保种。人宫颈癌Hela细胞、人口腔癌KB细胞、人乳腺癌MCF-7细胞、人胃癌SGC7901细胞、人成纤维肉瘤HT1080细胞、人前列腺癌PC3细胞和人前列腺癌DU145细胞,采用RPMI-1640培养液培养,其中含有体积分数10%TBD标准胎牛血清、2.0g·L-1碳酸氢钠、2.4g·L-1HEPES、10万单位·L-1青霉素、10万单位·L-1链霉素;人肺癌A549细胞、人肝癌HepG2细胞、人乳腺癌T47D细胞、人卵巢癌SKOV3细胞和人横纹肌肉瘤A204细胞采用高糖DMEM培养液培养,其中含有体积分数10%四季青胎牛血清、2.4g·L-1HEPES、3.7g·L-1碳酸氢钠、10万单位·L-1青霉素、10万单位·L-1链霉素。所有细胞置于37℃、含体积分数5%CO2饱和湿度的培养箱中培养。
采用MTT法测定3种抗肿瘤药物对细胞的生长抑制作用[11-12]。取对数生长期的细胞,经胰酶消化后制成5×104·mL-1的细胞悬液,分别接种于96孔板中,每孔200μL,置于37℃、体积分数5% CO2饱和湿度的培养箱中培养24h,弃去培养液,每孔加不同质量浓度的药液及空白培养液200μL,每组均设6复孔,置于37℃、体积分数5%CO2饱和湿度条件下培养48h后,除去培养液,每孔加入5mg·mL-1MTT溶液20μL,培养箱中继续培养4h后,加入150μL DMSO终止反应。用酶标仪在492nm处测定A值。计算药物对细胞的抑制率,并进一步求得半数有效剂量IC50。
2.2 细胞给药及样品提取 选择处于对数生长期的细胞,经胰酶消化制成细胞悬液,以1×106数目接种到不同的培养瓶中,随机分为对照组及给药组,置于37℃、体积分数5%CO2饱和湿度条件下培养24h,用培养液将药物适当稀释,以IC50值作为给药质量浓度,向给药组细胞的培养瓶中加入适量药物,对照组细胞的培养瓶中加入等量的新鲜培养液,继续培养48h。
样品提取方法参照文献方法[13]后弃去培养液,经PBS清洗,用体积分数6%三氯乙酸沉淀蛋白后获得上清液,贮存于-80℃,进行HPLC分析前以150μL 0.5mol·L-1KOH调pH至中性。
2.3 核苷酸分析 采用离子对高效液相色谱法对细胞中12种核苷酸类代谢物进行分析[13]。色谱条件如下。色谱柱:Phenomenex Synergi Hydro C18(250mm ×4.6mm,4μm);流动相:A相为体积分数25%甲醇水溶液,含有5.6mmol·L-1氢氧化四丁基铵、50mmol·L-1KH2PO4,pH为6.93,B相为体积分数0.25%甲醇水溶液,含有8mmol·L-1氢氧化四丁基铵、10mmol·L-1KH2PO4,pH为6.93;线性梯度洗脱程序:0~50min,48%~60%A;50~68min,60%~100%A;68~77min,100%A;流速:0.8mL·min-1;检测波长:254nm;柱温:25℃;进样量:20μL。
2.4 统计分析 通过SPSS 16.0软件进行数据处理,利用单因素方差分析(one-way analysis of variance significant test,ANOVA)进行显著性检验分析,评估对照组和给药组细胞核苷酸类代谢物的差异(P<0.05为差异有统计学意义);通过SIMCA-P 11.5Demo软件对数据进行主成分(PCA)分析,筛选药物作用相关的生物标记物。结合受试者工作(ROC)曲线对潜在生物标记物进行进一步验证。
3 结果与讨论
12种细胞中核苷酸含量及药物作用后细胞中核苷酸测定结果见表1~4。
3种药物作用于细胞后均引起细胞内核苷酸组分的含量发生了不同程度的变化,如ATP、ADP水平显著降低,CTP、UTP水平升高等。内源性的ATP在细胞的新陈代谢及各种生化反应的能量供给中扮演着角色,研究表明本实验中选用的3种药物作用于细胞后,可引起细胞线粒体功能的紊乱,导致线粒体通透性转换孔开放,线粒体膜电位降低,ROS形成增加等[14-16],进而引发细胞凋亡[17-19]。线粒体功能损伤及凋亡可能是细胞中ATP水平降低的原因。由于ATP不足,细胞为了维持正常的生理活动,积极利用ATP中的另一高能磷酸键,最终造成细胞内ADP水平下降;但在ATP生成减少的同时,也可引起ADP的堆积,最终使得ADP含量并未显著降低,而T47D、PC3细胞分别给予5-Fu、Ara-C刺激后,反而引起ADP含量增加。
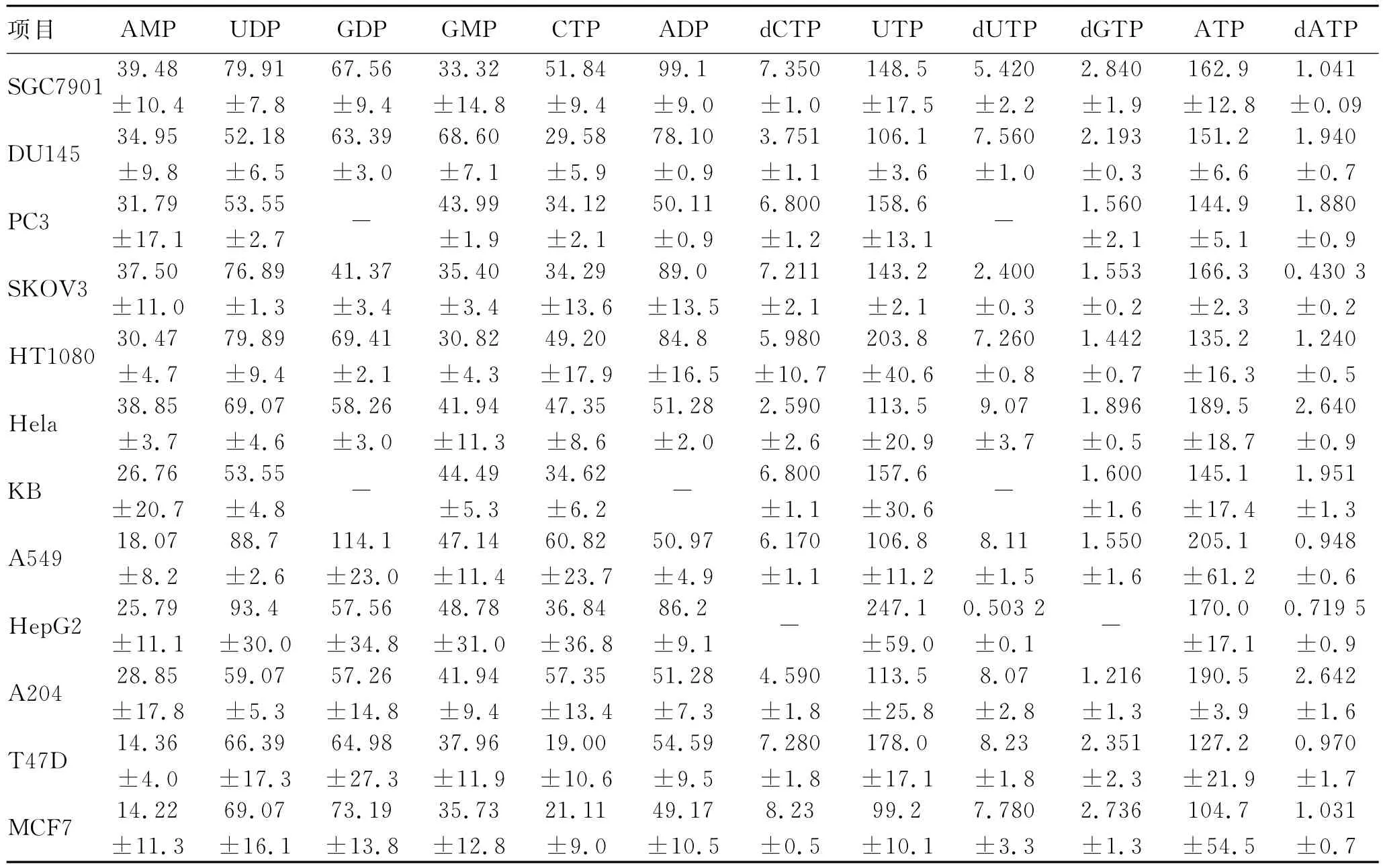
表1 对照组细胞中12种核苷酸的含量Tab.1 Contents of 12nucleotides in cells of control group(μg/108cells)
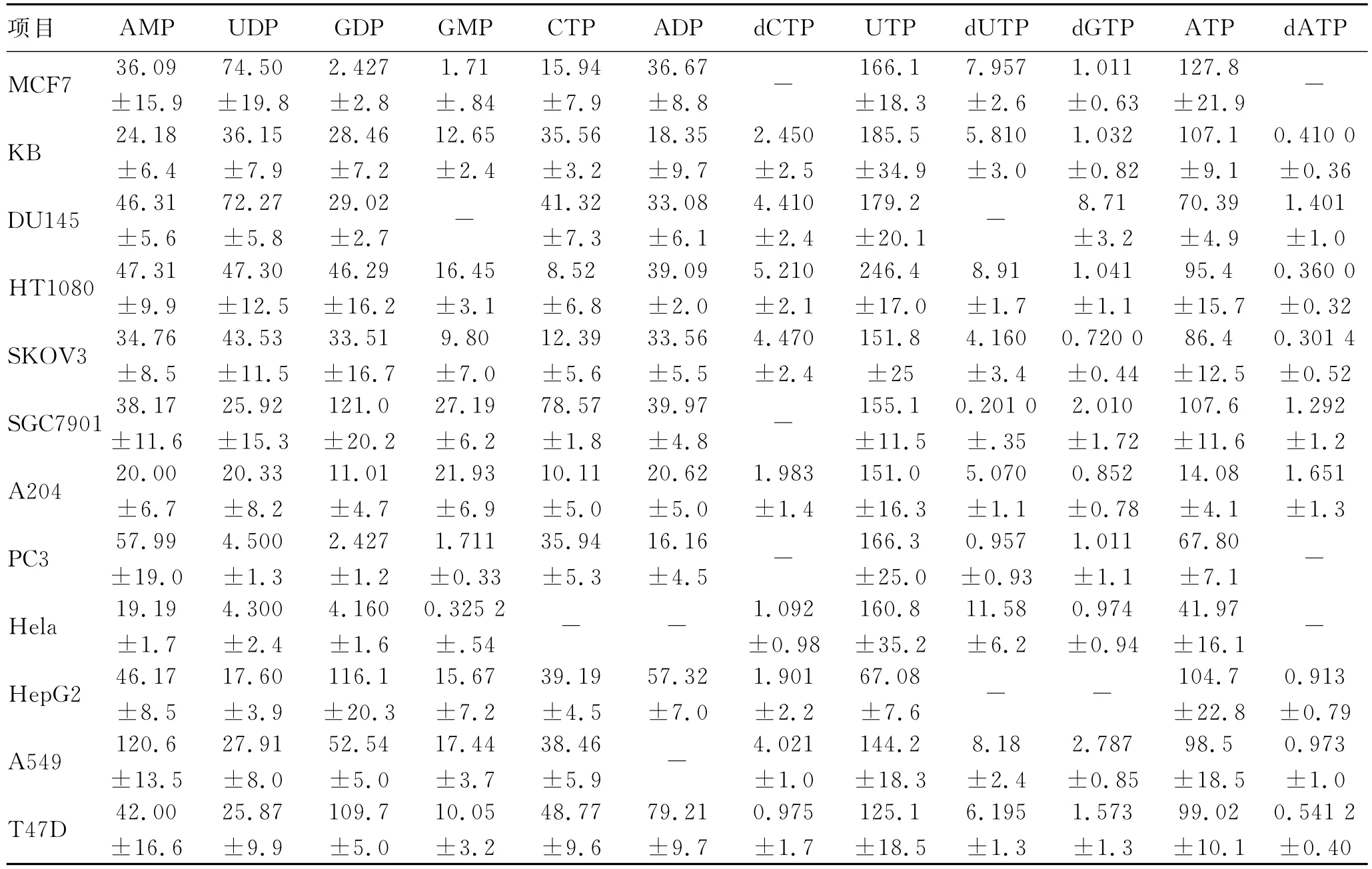
表2 5-Fu给药组细胞中12种核苷酸的含量Tab.2 Contents of 12nucleotides in cells of 5-Fu-treated group(μg/108cells,n=3)

表3 Ara-C给药组细胞中12种核苷酸的含量Tab.3 Contents of 12nucleotides in cells of Ara-C-treated group(μg/108cells,n=3)
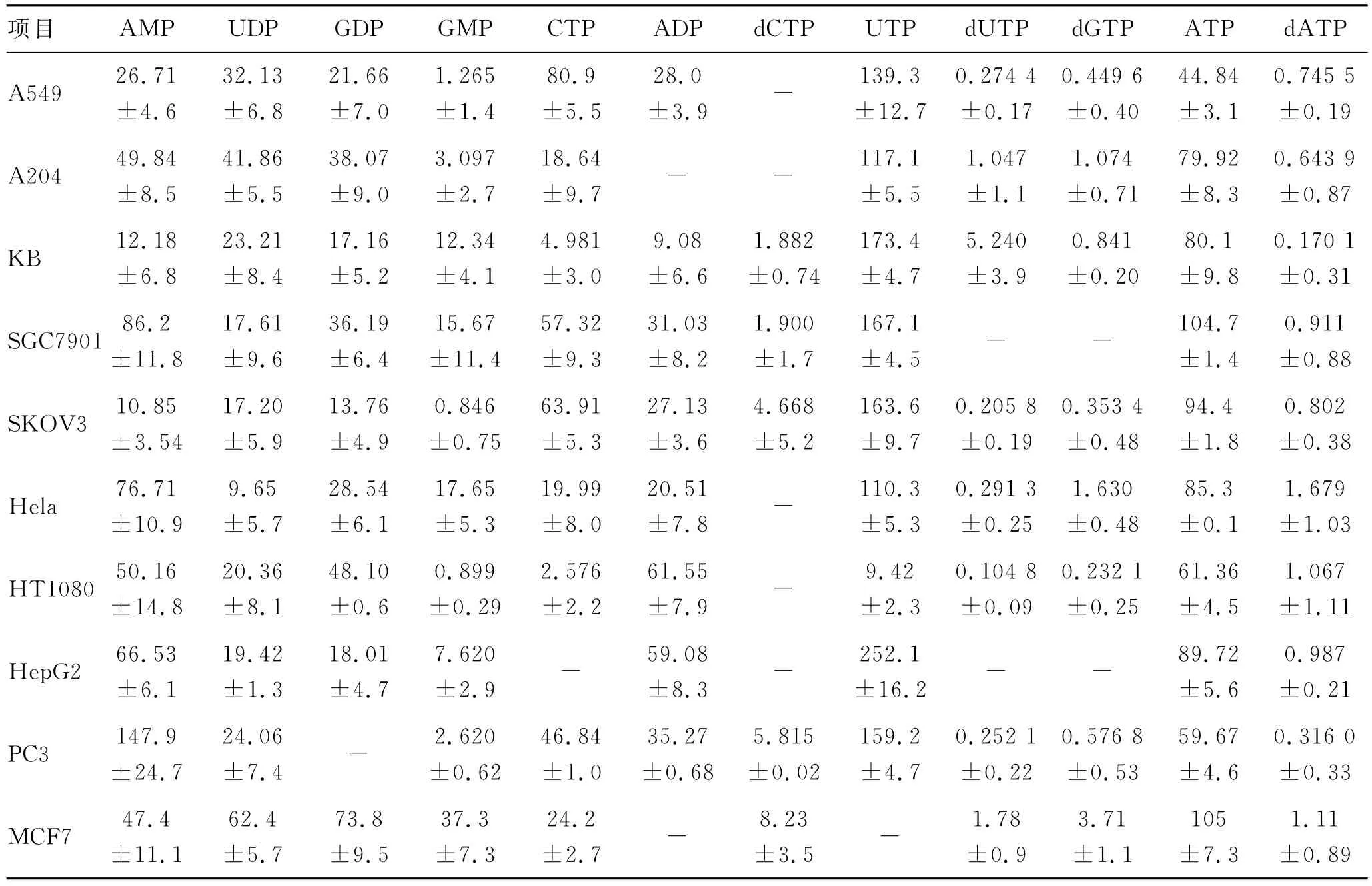
表4 MTX给药组细胞中12种核苷酸的含量Tab.4 Contents of 12nucleotides in cells of MTX-treated group(μg/108cells,n=3)
对于CTP和UTP,与未加药组相比,发现多数癌细胞受刺激后这2种组分的变化趋势极为相似,推测可能与嘧啶核苷酸的合成代谢有关。在生物体内,UTP在CTP合成酶的作用下,与谷氨酰胺作用生成CTP,由此可见,CTP是在UTP的基础上合成的,因此,当细胞受到外界刺激后,UTP与CTP的变化具有同步性。
以5-Fu刺激细胞后,除HepG2和T47D细胞外,细胞内UTP含量均升高;仅在MCF7和DU145细胞内检测到UDP含量升高;对于dATP、dGTP、dCTP,除A549和HepG2外,在细胞内含量均下降,提示DNA的合成异常;SGC7901、A204和HepG2细胞内dUTP水平下调,其他细胞内dUTP含量均呈现上调,该现象可能与5-Fu代谢有关。5-Fu为嘧啶类物质,其在细胞内乳清酸磷酸核糖基转移酶(OPRT)和胸苷磷酸化酶(TS)的作用下,转变为氟脱氧尿苷酸(FdUMP),最终代谢为dFUTP;也可经尿苷磷酸化酶的作用转变为氟尿苷酸(FUMP)和FUTP,抑制胸苷酸合成酶(TS)并掺入DNA和RNA合成中,抑制细胞增殖。TS可将dUMP转化为TMP,受抑制后,造成dUMP积累,最终引起细胞内dUTP和FdUTP含量升高,FdUTP和dUTP共同竞争DNA的合成,引起dUTP的积累;而TMP合成受阻时,胸苷激酶将补救合成TMP和FdUMP,则TMP水平升高反馈调节dUMP水平下降,最终可引起dUTP水平下降;另外细胞内dUTP焦磷酸酶通过催化dUTP水解为dUMP,同时也可促进FdUTP转化为FdUMP,阻止dUTP和FdUTP的积累;因此细胞内dUTP含量的变化是多态性的。此外,FUTP与UTP竞争掺入RNA合成,最终引起UTP的积聚。研究表明,不同癌细胞中尿苷磷酸化酶、胸苷磷酸化酶的活性不同,Pizzorno等[20]以人结肠癌HCT8细胞和HT29细胞株为研究对象,前者尿苷激酶的活性高于胸苷激酶的活性,将2种细胞株置于相同质量浓度的5-Fu中,发现在相同的作用时间内,HT28细胞中FdUMP质量浓度显著高于HCT8细胞;在HT28细胞中,FdUMP抑制TS后引起dUTP持续积累,而在HCT8细胞中未发现该现象,由此说明HCT8细胞主要以RNA介导的细胞毒性为主,而HT28细胞以干扰DNA合成为主。因此,细胞种类的差异可能是核苷酸变化差异的原因。
MTX作用于细胞后,也引起了细胞内核苷酸组分代谢的变化。除MCF7和HepG2细胞外,dATP、dCTP和dGTP水平下降;提示DNA合成异常。不同细胞内dUTP变化趋势各不相同,该现象可能与MTX的作用机制有关。MTX在叶酰多聚谷氨酸合成酶的催化下形成MTX聚谷氨酸(MTXPG),其可抑制起始嘌呤(de novo purine,DNP)合成所需的转移酶和胸腺嘧啶核苷酸合成酶(thymidylate synthase,TS),最终引起细胞内dUTP含量减少;另外MTX可导致DNA键断裂,dUTP可间接地通过细胞修复掺入DNA中,引起dUTP减少[21];因此细胞受MTX作用后,细胞内dUTP水平的波动也具有多态性。实验中GMP和GDP的水平下调(MCF7细胞除外),这与其抑制四氢叶酸合成,进而抑制嘌呤合成的作用机制有关。有研究报道,在嘌呤的合成过程中,MTX可抑制5-氨基咪唑-4-羧基酰胺核糖核苷酸(5-aminoimidazole-4-carboxamide ribonucleotide,AICAR)的甲酰基转移酶,导致AICAR堆积,后者通过抑制5′-单磷酸腺苷脱氨酶和腺苷脱氨酶的活性,从而抑制了5′-单磷酸腺苷和腺苷的降解,最终使细胞内外的5′-单磷酸腺苷和腺苷增多[22],本实验也检测到AMP水平显著提高。另外,MTX可在肝醛氧化酶的作用下代谢为7-羟基MTX(7-OHMTX),MTX和7-OHMTX的聚谷氨酰胺形式对TS、甘氨酰胺核苷酸甲酰基转移酶(GARFT)均具有抑制能力,GARFT可催化甲酰基从10-甲酰四氢叶酸转变为甘氨酰胺核苷酸,该反应为嘌呤生物合成途径中的一个步骤[23]。Sokoloski等[7]以白血病细胞株HL60为研究对象,研究发现,GARFT受抑制后引起细胞内ATP水平下降,UTP水平升高。本实验除Hela和MCF7细胞外,研究发现,UTP水平均呈现上调,推测可能与细胞内GARFT受抑制有关。但在HT 1 080、MCF7和A204细胞中CTP水平下调,与UTP变化趋势不一致,可能与参与嘧啶代谢的酶活性相关,有待于进一步研究。
给予Ara-C后细胞内UTP含量上升,除Hela和MCF7细胞外,细胞内CTP含量也升高;dATP、dGTP下降。实验中检测到DU145、Hela和MCF7细胞内dCTP含量升高,可能与Ara-C作用机制相关,Ara-C为嘧啶类抑制剂,进入细胞后首先在脱氧胞苷激酶(DCK)的作用下磷酸化成Ara-CMP,然后通过一磷酸和二磷酸嘧啶核苷酸激酶转化为Ara-CDP和Ara-CTP。Ara-CTP是Ara-C药理作用的主要活性形式,后者能强有力地抑制DNA多聚酶,或直接以伪代谢物形式与dCTP竞争掺入到DNA合成中,造成细胞内dCTP积累;有研究报道,细胞内脱氧核苷酸酶Ι(dNT-Ι)的mRNA表达与Ara-C活性具有相关性[24],dNT-Ι水平升高会使细胞内dCTP含量上升,其会和Ara-CTP竞争与DNA的相互作用,使Ara-C的作用减弱;而在T47D细胞和PC3细胞内的dCTP水平下降,可能与细胞内脱氧胞苷激酶活性较低或缺陷有关。另外,实验中发现,PC3和DU145细胞内GMP水平显著升高,具体原因尚不明确。
采用单因素方差分析对比对照组和给药组,结果表明,给药前后UDP、ADP、ATP和GMP具有显著性差异,推测药物使肿瘤细胞内核苷酸代谢模式发生了变化。初步推断具有显著性差异的核苷酸可能为药物作用相关的生物标记物。
对测定结果进行PCA分析,结果见图1和图2。图1中的每一个点代表一个样本,样本的位置由细胞样本中所含核苷酸组分的质量浓度决定,根据物以类聚的原则,处于相似生理病理状态的细胞通常具有相似的水平,可分布在相似的位置。由图1可知,对照组细胞和加药组细胞被分为两类,组内的细胞样本较为分散,可能是由细胞种类的差异以及药物与细胞间相互作用的差异引起的。图2中的每一个点代表了样本中所检测的核苷酸组分,载荷点距离零点位置越远,表明其所代表的核苷酸在不同组之间的质量浓度差异越大,对各细胞在score plot上的分型贡献越大。从图2可知,ATP、GMP、UDP和ADP离零点相对较远,对2组之间的分型贡献相对较大,可能为药物作用相关的标记物。
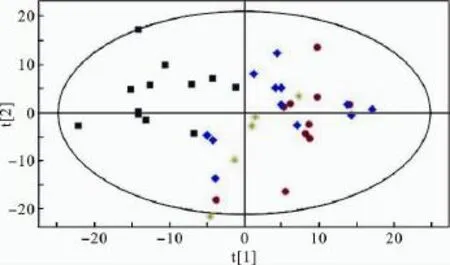
图1 对照组和给药组细胞的得分图(对照组;Ara-C给药组;5-FU-给药组;MTX给药组)Fig.1 PCA score plot of cells from control group and drugtreated groups(control group;Ara-C-treated group;5-FU-treated group;MTX-treated group)
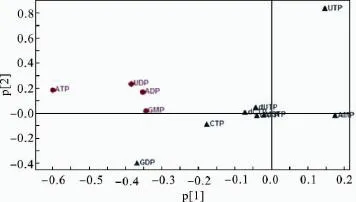
图2 体现对照组和给药组细胞相互关系的载荷图
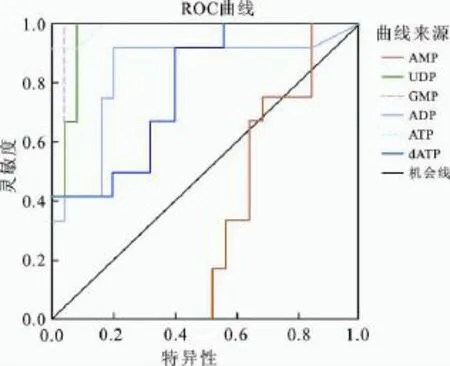
图3 核苷酸类物质区分对照组和给药组细胞能力的ROC曲线分析Fig.3 ROC curve of the ability of nucleotide metabolites to discriminate cells in control group and drug-treated groups
为了寻找出更具有诊断价值的生物标记物,我们在上述数据分析的基础上,采用SPSS 16.0软件对对照组和给药组的测定结果进行了ROC曲线分析。实验中一般以ROC曲线下面积(AUC)值来表征统计结果:AUC值越接近于1,诊断效果越好;在0.5~0.7时有较低准确性,在0.7~0.9时有一定准确性,在0.9以上时有较高准确性。AUC结果ATP(0.990)>GMP(0.987)>UDP(0.963)>dCTP(0.798)>dATP(0.783)。GMP、ATP和UDP具有更高的诊断准确性,因此将其识别为与药物作用相关的生物标记物。
4 结论
本研究将临床常用的3种抗代谢类抗癌药物作为外界扰动作用于12种肿瘤细胞,采用离子对高效液相色谱法分析其中的核苷酸类代谢物,并针对核苷酸的代谢变化进行了初步分析。结合PCA分析、ANOVA、ROC曲线分析结果,将GMP、ATP和UDP识别为药物作用相关的生物标记物。虽然本研究并未对所有的核苷酸在药物作用后的变化机制全部进行解释,但是所得结论足以说明生物体内生理生化过程与核苷酸的代谢变化密切相关。因此,可通过检测该类物质的水平波动来阐明药物作用靶点、揭示药物作用机制等。
[1]郭青龙.肿瘤药理学[M].北京:化学工业出版社,2007:3.
[2]Bester A C,Roniger M,Oren Y S,et al.Nucleotide deficiency promotes genomics instability in early stages of cancer development[J].Cell,2011,145(3):435-446.
[3]Grune T,Siems W G,Gerber G.Determination of the ultraviolet absorbance and radioactivity of purine compounds separated by high-performance liquid chromatography application to metabolic flux rate analysis[J].J Chromatogr,1991,553(1/2):193-199.
[4]张军,卢煜明.血浆(清)游离核酸的临床应用[J].临床检验杂志,2002,20(特刊):13-17.
[5]Nouri K,Yazdanparast R.Effects of 3-hydrogen kwadaphnin on intracellular purine nucleotide contents and their link to K562cell death[J].Food Chem,2011,128(1):81-86.
[6]Pizzorno G,Sun Z R,Handschumacher R E.Aberrant cell cycle inhibition pattern in human colon carcinoma cell lines after exposure to 5-fluorouracil[J].Biochem Pharmacol,1995,49(4):553-557.
[7]Sokoloski J A,Beardsley P G,Sartorelli A C.Induction of HL-60leukemia cell differentiation by tetrahydrofolate inhibitors of de novo purine nucleotide biosynthesis[J].Cancer Chemother Pharmacol,1991,28(1):39-44.
[8]Iwasaki H,Huang P,Keating M J,et al.Differential incorporation of Ara-C,Gemcitabine,and fludarabine into replicating and repairing DNA in proliferating human leukemia cells[J].Blood,1997,90(1):270-278.
[9]Van Moorsel C J A,Bergman A M,Veerman G,et al.Differential effects of gemcitabine on ribonucleotide pools of twenty-one solid tumour and leukaemia cell lines[J].Biochim Biophys Acta,2000,1474(1):5-12.
[10]Cohen S,Megherbi M,Jordheim LP,et al.Simultaneous analysis of eight nucleoside triphosphates in cell lines by liquid chromatography coupled with tandem mass spectrometry[J].J Chromatogr B,2009,877(30):3831-3840.
[11]程亚涛,徐昕,王鹏龙,等.9种黄酮类化合物对肿瘤细胞的抑制活性及构效关系研究[J].西北药学杂志,2014,29(2):187-190.
[12]程林兵,杨光明,李俊松,等.狼毒生品及炮制品的体外抗肿瘤活性研究[J].西北药学杂志,2014,29(2):152-156.
[13]Zhang C C,Liu Z,Liu X,et al.Targeted metabolic analysis of nucleotides and identification of biomarkers associated with cancer in cultured cell models[J].Acta Pharmaceutica Sinica B,2013,3(4):254-262.
[14]Matsunaga T,Tsuji Y,Kaai K,et al.Toxicity against gastric cancer cells by combined treatment with 5-fluorouracil and mitomycin C:implication in oxidative stress[J].Cancer Chemother Pharmacol,2010,66(3):517-526.
[15]Kim C N,Wang X,Huang Y,et al.Overexpression of Bcl-xl inhibits Ara-C-induced mitochondrial loss of cytochrome C and other perturbations that activate the molecular cascade of apoptosis[J].Cancer Res,1997,57(15):3115-3120.
[16]Huang C C,Hsu P C,Hung Y C,et al.Ornithine decarboxylase prevents methotrexate-induced apoptosis by reducing intracellular reactive oxygen species production[J].Apoptosis,2005,10(4):895-907.
[17]Aota K,Azuma M,Yamashita T,et al.5-fluorouracil induces apoptosis through the suppression of NF-κB activity in human salivary gland cancer cells[J].Biochem Biophys Res Commun,2000,273(3):1168-1174.
[18]Heenen M,Laporte M,Noel J C,et al.Methotrexate induces apoptotic cell death in human keratinocytes[J].Arch Dermatol Res,1998,290(5):240-245.
[19]Iacobini M,Menichelli A,Palumbo G,et al.Involvement of oxygen radicals in cytarabine-induced apoptosis in human polymorphonuclear cells[J].Biochem Pharmacol,2001,61(8):1033-1040.
[20]肖芳,钟才高,张洪霞.Cr(VI)对L-02肝细胞线粒体能量代谢的影响[J].实用预防医学,2006,13(5):1190-1194.
[21]Pizzorno G,Sun Z R,Handschumacher R E.Aberrant cell cycle inhibition pattern in human colon carcinoma cell lines after exposure to 5-fluorouracil[J].Biochem Pharmacol,1995,49(4):553-557.
[22]Hattangadi D K,Demasters G A,Walker T D,et al.Influence of p53and caspase 3activity on cell death and senescence in response to methotrexate in the breast tumor cell[J].Biochem Pharmacol,2004,68(9):1699-1708.
[23]Fotoohi A K,Assaraf Y G,Moshfegh A,et al.Gene expression profiling of leukemia T-cells resistant to methotrexate and 7-hydroxymethotrexate reveals alterations that preserve intracellular levels of folate and nucleotide biosynthesis[J].Biochem Pharmacol,2009,77(8):1410-1417.
[24]Galmarini C M,Cros E,Graham K,et al.5′-(3′)-nucleotidase mRNA levels in blast cells are a prognostic factor in acute myeloid leukemia patients treated with cytarabine[J].Haematologica,2004,89(5):617-619.
Effects of antimetabolite agents on the metabolism of nucleotides in human tumor cells
WANG Di,WEI Lan,LIU Xi,LIU Haokun,HU Wenyi,SUN Lixin*(School of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110016,China)
Objective To study the effects of antimetabolite agents on the nucleotide pools in human tumor cells.Methods Contents of twelve nucleotides in twelve human tumor cells of control group and drug-treated group were determined by ion-pair HPLC method.Several data processing methods were combined for the identification of potential biomarkers associated with the action of drugs,including principal component analysis(PCA),one-way analysis of variance significant test(ANOVA),and receiver operating characteristic(ROC)curve.Results A significant difference has been found in nucleotides between control group and drugtreated group.The dominant metabolites were ATP,ADP,GMP and UDP,which were further validated by ROC curve analysis.Conclusion ATP,GMP and UDP were recognized as the best potential biomarkers associated with the drug action.
antimetabolite agents;human tumor cells;nucleotide;potential biomarkers
10.3969/j.issn.1004-2407.2015.01.016
R94
A
1004-2407(2015)01-0059-07
2014-06-10)
地方高校国家级大学生创新创业训练计划项目(编号:201210163007)
王迪,女,2011级药学专业本科生
*通信作者:孙立新,女,教授,博士生导师
