多指标加权评分正交试验优选消痤散提取工艺
2015-01-11杨全伟刘新国徐宏峰余南才
刘 敏 杨全伟 刘新国 徐宏峰 余南才
武汉市第一医院药学部,武汉 430022
·实验研究·
多指标加权评分正交试验优选消痤散提取工艺
刘 敏 杨全伟 刘新国 徐宏峰 余南才△
武汉市第一医院药学部,武汉 430022
目的 优选消痤散提取工艺。方法 以加水量、提取次数和煎煮时间为因素进行正交试验,通过高效液相法测定其黄芩苷、芍药苷含量,以黄芩苷和芍药苷提取量和提取干膏收得率进行加权评分。结果 消痤散加10倍量水煎煮,每次煎煮1 h,共提取3次所得黄芩苷、芍药苷含量较高,干膏收得率较高。结论 多指标加权评分正交试验优选消痤散提取工艺为10倍量水煎煮3次,每次煎煮1 h。
正交试验;多指标加权评分;提取工艺;高效液相色谱法
消痤散为武汉市第一医院皮肤科痤疮专病门诊的临床处方,由丹栀逍遥散和桃红四物汤化裁而来,其处方组成为黄芩、柴胡、赤芍、薄荷、甘草等10余味中药,具有疏肝理气,凉血活血等功效,主治肝郁血热型痤疮。有文献[1-2]报道,黄芩中黄芩苷具有抑菌、解热镇痛、保护细胞损伤的作用;赤芍中的芍药苷具有止痛、抗炎、保肝以及多途径抑制自身免疫反应等多种药理作用,可见,二者均为该方的主要有效成分。为了优选该方的提取工艺,本文以黄芩苷和芍药苷的提取量为主要考察指标,并结合提取的干膏收得率,进行正交实验,具体的研究报道如下。
1 材料与方法
1.1 仪器与试剂
Waters 2695系列高效液相色谱仪(美国);Sartorius ME215 S电子天平;黄芩苷对照品(中国食品药品检定研究院提供,批号:110715-201016);芍药苷对照品(中国食品药品检定研究院提供,批号:120705-201017);黄芩、柴胡、赤芍、薄荷、甘草等10味药材由湖北天济中药饮片有限公司提供,经鉴定均符合中华人民共和国药典(2010版,一部)要求;甲醇为色谱纯,其他试剂为分析纯;水为双蒸水。
1.2 黄芩苷的含量测定
1.2.1 色谱条件 色谱柱为ODS HYPERSIC-C18柱(200 mm×4.6 mm,5 μm),流动相为甲醇:0.4%磷酸溶液(40:60),流速为1.0 ml/min,检测波长为280 nm,柱温为30 ℃。
1.2.2 溶液的制备
1.2.2.1 黄苓苷对照品溶液储备液的制备 精密称取黄芩苷12.64 mg,置于50 ml量瓶中,加70%甲醇,摇匀,即得对照品溶液储备液,置于冰箱中备用。
1.2.2.2 供试品溶液的制备 取正交试验所得的溶液,摇匀,精密量取1 ml,置50 ml量瓶中,加70%甲醇稀释至刻度,摇匀,过滤,取续滤液置冰箱中备用。
1.2.2.3 黄苓阴性对照溶液的制备 按处方比例称取除黄芩外的其他药材,用10倍量水回流提取3次,每次提取1 h,所得药液,浓缩至200 ml,摇匀,继续按“1.2.2.2”项“精密量取1 ml……”方法制备,即得,置冰箱备用。
1.2.3 方法专属性 吸取黄苓苷对照品溶液储备液、供试品溶液、黄芩阴性对照溶液各20 μl,进样,依法检测。
1.2.4 线性关系 取上述对照品溶液储备液,分别精密量取2、3、4、5、6 ml分别置于20 ml量瓶中,加70%甲醇稀释至刻度,摇匀,分别进样20 μl,依法检测,计算峰面积,以峰面积、对照品浓度计算线性回归方程。
1.2.5 精密度试验 取线性关系范围内的2号对照品溶液20 μl,连续进样6次,依法检测,计算黄芩苷峰面积RSD。
1.2.6 稳定性试验 精密量取供试品样品(批号:140820)1 ml,置50 ml量瓶中,加70%甲醇稀释至刻度,摇匀,过滤得滤液,分别于1、2、4、8、12、24 h进样20 μl,依法检测,计算黄芩苷峰面积RSD。
1.2.7 重复性试验 取同一批次供试品溶液样品,按“1.2.2.2”项方法平行制备6份样品,分别进样20 μl,依法检测,计算黄芩苷的含量,计算结果平均含量及RSD值。
1.2.8 加样回收率试验 取已知含量的供试品溶液6份,摇匀,精密量取1 ml,分别置于100 ml量瓶中,各精密加入适量的黄芩苷对照品溶液储备液,加70%甲醇稀释至刻度,摇匀,过滤,分别取20 μl续滤液进样,依法检测,计算回收率。
1.3 芍药苷的含量测定
1.3.1 色谱条件 色谱柱为ODS HYPERSIC-C18柱(200 mm×4.6 mm,5 μm),流动相为乙腈:0.1%磷酸溶液(14:86),流速为1.0 ml/min,检测波长为230 nm,柱温为30 ℃。
1.3.2 溶液的制备
1.3.2.1 芍药苷对照品溶液储备液的制备 精密称取芍药苷适量,加稀乙醇使溶解,制成每1 ml含0.616 mg的溶液,作为对照品溶液储备液,置于冰箱中备用。
1.3.2.2 供试品溶液的制备 取正交试验所得的溶液,摇匀,精密量取3 ml,置25 ml量瓶中,加稀乙醇适量,超声处理(功率240 W,频率45 kHz)30 min,取出,放冷,加稀乙醇稀释至刻度,摇匀,滤过,取续滤液,备用。
1.3.2.3 赤芍阴性溶液的制备 按处方比例称取除赤芍外的其他药材,用10倍量水回流提取3次,每次提取1 h,所得药液,浓缩至200 ml,摇匀,继续按“1.3.2.2”项“精密量取3 ml……”方法制备,即得。
1.3.3 方法专属性 吸取芍药苷对照品溶液储备液、供试品溶液、赤芍阴性溶液、赤芍溶液各10 μl,进样,依法检测。
1.3.4 线性关系 精密量取上述对照品溶液储备液1、2、4、6、8 ml分别置于20 ml量瓶中,加70%甲醇稀释至刻度,摇匀,即得,分别进样10 μl,依法检测,以峰面积、对照品浓度计算线性回归方程。
1.3.5 精密度试验 取线性关系项下的2号对照品溶液10 ml置于20 ml量瓶中,加稀乙醇稀释至刻度,摇匀,进样10 μl,连续进样6次,依法检测,计算芍药苷峰面积RSD。
1.3.6 稳定性试验 精密量取供试品样品(批号:140810)3 ml,置于25 ml量瓶中,加稀乙醇适量,继续按“1.3.2.2”项“超声处理……”方法制备供试品溶液,分别于0、1、2、4、8、12 h进样10 μl,依法检测,计算芍药苷峰面积RSD。
1.3.7 重复性试验 取同一批次供试品溶液样品,按“1.3.2.2”项方法平行制备6份,分别进样10 μl,依法检测,计算芍药苷的含量及其RSD值。
1.3.8 加样回收率试验 取已知含量的供试品溶液6份,摇匀,精密量取1 ml,分别置于50 ml量瓶中,各精密加入适量的丹酚酸B对照品,加75%的甲醇稀释至刻度,摇匀,过滤,分别取续滤液20 μl进样,依法检测,计算回收率。
1.4 正交试验设计优选提取工艺
在查阅文献基础上,针对加水量(A)、提取时间(B)、提取次数(C)3个影响因素,以L9(33)表进行正交试验,正交试验因素水平表如下表所示。以黄芩苷、芍药苷总提取量为主要评价指标,干膏收得率为次要指标,权重系数按黄芩苷:芍药苷:干膏收得率=40%:40%:20%来计算综合评分。见表1。
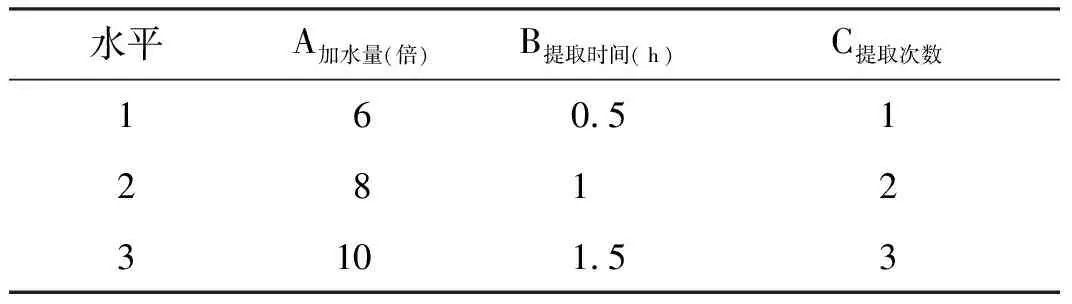
表1 正交试验因素水平表
2 结果
2.1 黄芩苷含量
2.1.1 方法专属性 黄芩苷对照品溶液在14.65 min出现色谱峰,供试品溶液在14.25 min出现色谱峰,黄芩阴性对照溶液在此区间无色谱峰,表明该色谱条件对于该方中黄芩苷的检测具有专属性。见图1。
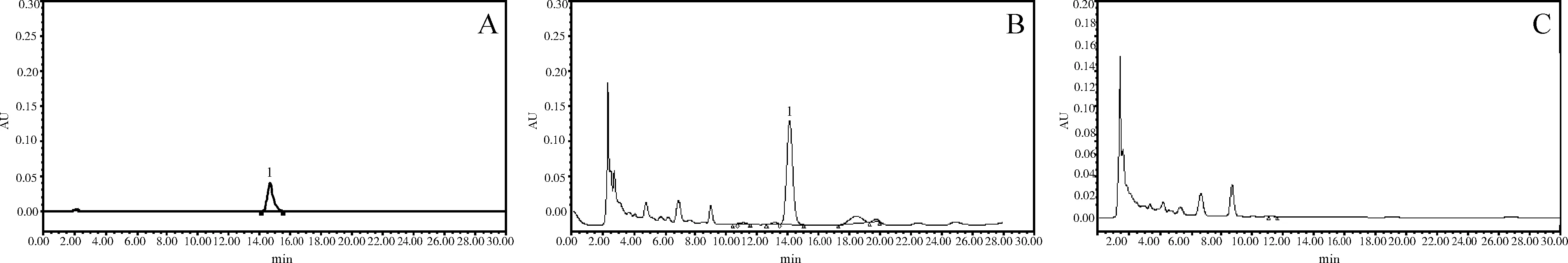
A:黄芩苷对照品溶液;B:供试品溶液;C:阴性对照品溶液;1:黄芩苷峰图1 高效液相色谱图
2.1.2 线性关系 黄芩苷线性回归方程:Y=80 701X-803 399,r=0.999 7,表明黄芩苷在25.28~126.40 μg/ml范围内线性关系良好。2.1.3 精密度试验 黄芩苷峰面积RSD=1.02%,表明仪器的精密度良好。
2.1.4 稳定性试验 黄芩苷峰面积RSD=1.46%,表明供试品溶液中的黄芩苷在24 h内稳定。2.1.5 重复性试验 黄芩苷平均含量为1.477 mg/ml,RSD=0.96%,表明本色谱条件重复性良好。
2.1.6 加样回收率试验 黄芩苷平均回收率为99.21%(RSD=1.85%),表明对于该方中黄芩苷的提取该方法科学可行。
2.2 芍药苷的含量
2.2.1 方法专属性 芍药苷对照品溶液在9.15 min出现色谱峰,供试品在9.25 min左右出现色谱峰,赤芍阴性对照溶液在此区间无色谱峰,表明该色谱条件对于该方中芍药苷的检测具有专属性。见图2。

A:芍药苷对照品溶液;B:供试品溶液;C:阴性对照溶液;1:芍药苷峰图2 高效液相色谱图
2.2.2 线性关系试验 芍药苷线性回归方程:Y=24 014X+57 187,r=0.999 3,表明芍药苷在24.64~172.48 μg范围内线性关系良好。
2.2.3 精密度试验 芍药苷峰面积RSD=1.02%,表明仪器的精密度良好。
2.2.4 稳定性试验 芍药苷峰面积RSD=1.46%,表明供试品溶液中芍药苷在12 h内稳定。2.2.5 重复性试验 芍药苷平均含量为0.310 mg/ml,RSD=0.83%,表明本色谱条件重复性良好。
2.2.6 加样回收率试验 芍药苷平均回收率为100.27%(RSD=1.04%),表明对于该方中芍药苷的提取,该方法科学可行。
2.3 正交试验设计优选提取工艺
消痤散正交试验结果表明:提取条件中A、B、C三因素对综合评分提取量的影响次序分别为C>A>B,最佳提取工艺为A3B3C3,方差分析表明:提取次数、提取水量具有显著性。综合考虑及大生产选择优选工艺为A3B2C3,即10倍量水,提取3次,每次提取1 h为消痤散的最佳提取工艺。见表2-3。

表2 正交试验及结果(n=3)
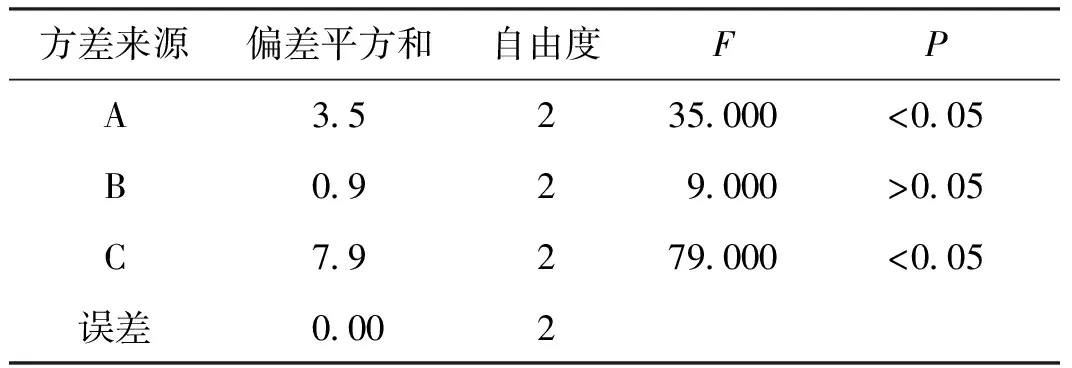
表3 方差分析
F0.05(2,2)=19.00
3 讨论
黄芩的主要活性成分黄芩苷的含量测定,依据2010版《中国药典》方法条件[3],借鉴文献[4-5]报道,综合考察了甲醇:0.1%磷酸溶液、甲醇:0.2%磷酸溶液、甲醇:0.3%磷酸溶液、甲醇:0.4%磷酸溶液、甲醇:0.5%磷酸溶液等不同磷酸浓度的流动相对峰形、分离度和理论塔板数的影响,发现甲醇:0.4%磷酸溶液为较佳的流动相;在此基础上,依据有关文献[6],对于甲醇:0.4%磷酸溶液的比例也进行了研究分析,甲醇:0.4%磷酸溶液(40:60)时峰形、分离度和理论塔板数较好,该方法稳定可行,可用于提取工艺的考察指标。赤芍的主要活性成分芍药苷的含量测定,依据文献[7-8]方法,采用HPLC法,具有操作简单、柱效高、分离度好、图谱清晰、无干扰、结果准确等优点,因而可作为消痤散提取工艺的质量控制方法。
中药有效成分复杂,在研究提取工艺时,除有成分指标外,还应在药效方面对产物进行研究。
[1] 杜庆波.黄芩药理活性研究新进展[J].齐齐哈尔医学院学报,2014,35(1):110-111.
[2] 韩珍,贺戈.白芍总苷的药理作用及其毒性研究进展[J].宁夏医学院学报,2008,30(4):538-541.
[3] 中国药典委员会.中国药典2010版(一部)[M].北京:中国医药科技出版社,2010:282-283.
[4] 路玫,谢东.高效液相色谱法测定利咽口服液中黄芩苷的含量[J].中国医院药学杂志,2000,20(6):330-331.
[5] 朱雪梅,张帆,柴罗纳.高效液相色谱法测定加味柴苓合剂中黄芩苷的含量[J].福建中医药,2009,40(1):53-54.
[6] 张文,张金莲.HPLC法测定黄芩中黄芩苷含量[J].齐齐哈尔医学院学报,2004,25(3):291-292.
[7] 徐先祥,周丽,马燕,等.正交实验优选赤芍提取工艺研究[J].安徽中医学院学报,2008,27(5):41-43.
[8] 郑立运,刘颖,于书仪,等.赤芍中芍药苷提取溶媒的选择[J].黑龙江医药科学,2007,30(4):84.
Optimization of Extraction Process for Xiao Cuo Powder by Orthogonal Test of Multi-index Weighted Score
LIU Min,YANG Quanwei,LIU Xinguo,et al
DepartmentofPharmacy,FirstHospitalofWuhan,Wuhan430022,China
Objective To optimize the extraction process for Xiao Cuo powder.Methods Adding water amount,extraction times and extraction time were used as factors of the orthogonal test and the content of baicalin and paeoniflorin were determined by high performance liquid chromatography(HPLC) method.The extraction rate baicalin and paeoniflorin and the extraction rate of dry extract were weighted by a weighted score.Results The content of baicalin and paeoniflorin were higher by the extraction process of extracted 3 times with 10 times the amount of water and 1 h each time.Conclusion Optimization of extraction process for Xiao Cuo powder by orthogonal test of multi-index weighted score was as following:extracted 3 times with 10 times the amount of water,1 h each time.
orthogonal test;multi-index weighted score;extraction process;high performance liquid chromatography(HPLC)
10.3969/j.issn.1674-4616.2015.04.009
2015-06-11)
△通信作者,Corresponding author,E-mail: 1076128084@qq.com
