阳极氧化法制备TiO2纳米管形貌与光电催化性能表征—氧化时间因素控制
2015-01-08王雪芹孟令辉黄玉东
王雪芹,孟令辉,黄玉东
(哈尔滨工业大学 化工学院,黑龙江 哈尔滨,150001)
阳极氧化法制备TiO2纳米管形貌与光电催化性能表征—氧化时间因素控制
王雪芹,孟令辉,黄玉东*
(哈尔滨工业大学 化工学院,黑龙江 哈尔滨,150001)
采用电化学阳极氧化方法,通过控制氧化反应时间制备了一系列TiO2纳米管,采用SEM、XRD和XPS分别对TiO2纳米管的形貌、物相结构和组成元素进行了分析,并研究了TiO2纳米管的光电催化及光催化降解有机染料的反应活性。结果表明,氧化反应时间的增长会导致TiO2纳米管的管径和长度增加,从而加快光生电子-空穴对的生成效率,提高催化活性;但氧化时间过长时会使TiO2纳米管表面的规整度下降,表面缺陷增多,致使光生电子-空穴对的再结合速率提高,反而使催化活性降低;适宜的阳极氧化时间为120min。
二氧化钛;纳米管;氧化时间;光电催化;染料降解
前言
TiO2基半导体催化剂具有化学稳定性、抗光腐蚀性、无毒性和成本低等优点[1],已经被广泛应用于水处理[2]、光催化裂解水[3]、燃料电池[4]、传感器[5]、超级电容器[6]等研究领域中,成为国内外的研究热点。半导体催化剂的空间结构决定了其比表面积、电子结构、电子-空穴对的转移速率等物理特性[7],因此,TiO2基半导体催化材料的催化性能与其物理形貌密切相关。新型TiO2纳米材料的结构除不同形状的TiO2纳米颗粒[8~10]以外,还包括TiO2纳米管[11,1 2]、TiO2纳米线[6,13]、TiO2纳米棒[14]等,其中TiO2纳米管以其制备方式简单、排列规整、比表面积大等优点[7],在近十几年受到越来越多的重视。
制备TiO2纳米管阵列的常用方法为电化学阳极氧化方法,该方法以Ti片为基体(工作电极),以铂丝(或石墨棒等)为对电极,在电极两端施加电压将Ti片表面氧化,并在电解液中F-的协同作用下,最终在Ti片表面形成排列规整的TiO2纳米管阵列。其中,阳极氧化过程中的施加电压、氧化温度、氧化时间以及电解液的组成等因素都会影响所生成TiO2纳米管的长度、管径、管壁粗糙度、管口清洁度、表面规整度等物理特性[15~19],进而影响到TiO2纳米管的催化性能。Zwilling等人[20~22]首次采用阳极氧化法,在含有氢氟酸的铬酸电解液中制备出TiO2纳米管,但其厚度仅为500nm,并且规整度有限。随后研究发现,电解液的pH值对TiO2纳米管的厚度有一定的影响,在中性pH值范围内,可以得到更长的TiO2纳米管,采用有机溶剂[23],如乙二醇、DMSO、丙三醇等作为电解液可制备出管壁更为光滑的TiO2纳米管,其厚度可达到几百微米。电解液中F-的存在对TiO2纳米管的生成具有至关重要的作用[24,25],F-可与Ti片表面的氧化层生成可溶性的[TiF6]2-,在TiO2表面刻蚀形成点,经过持续的氧化刻蚀作用,最终在Ti片表面形成规整的TiO2纳米管结构。而氧化时间对TiO2纳米管的长度和管径大小有直接的影响,研究表明,氧化时间的提高可以有效增加TiO2纳米管的厚度,但是鲜有研究报道对不同氧化时间下制备的TiO2纳米管的催化性能进行同步表征,不同形貌下TiO2纳米管的光催化性能有待于进一步研究。
通过控制阳极氧化时间,制备了一系列具有不同形貌的TiO2纳米管,研究了氧化时间对TiO2纳米管的形貌、物相结构、元素组成等的影响,并研究了不同TiO2纳米管的光电催化性能和光催化降解有机染料的催化活性。通过对不同氧化时间下TiO2纳米管的形貌进行研究,可以直观地分析出TiO2纳米管的形成过程,并通过对其相应催化活性进行分析,可以深入了解不同形态的TiO2纳米管对其催化性能的影响,为TiO2纳米管的结构设计提供理论依据。
1 实验部分
1.1 TiO2纳米管制备方法
本文选用Ti片(0.1×33×50mm,99.6+%,Advent, UK)为基体,采用电化学阳极氧化法制备TiO2纳米管阵列。首先将Ti片进行前处理,依次采用不同型号的砂纸进行打磨(220#→320#→500#→800#→1200#),然后依次采用丙酮、乙醇和去离子水进行超声清洗,在N2条件下吹干备用。
电化学阳极氧化过程中所采用的电解质溶液由乙二醇/水(体积比9∶1)、柠檬酸(0.11mol/L)和氟化铵(0.15mol/L)组成,采用Ti片为工作电极(阳极),碳棒为对电极(阴极),氧化电压为50V,氧化时间分别为 10min、30min、60min、120min、240min和480min,制备出具有不同形貌的TiO2纳米管,阳极氧化后将Ti片取出采用大量的水冲洗,并采用乙醇浸泡去除残留在TiO2纳米管内部的有机溶剂,然后在N2条件下吹干。制备的TiO2纳米管在450℃下煅烧3h,升温速率为5℃/min,煅烧后自然降温待用。
1.2 TiO2纳米管物理性能表征
采用扫描电镜(SEM,NOVA600,FEI)对在不同时间条件下所制备的TiO2纳米管的微观形貌进行表征,其物相结构采用X射线衍射仪(XRD,Cu靶,D8 Discover,Bruker)进行表征,并通过X射线光电子能谱(XPS,AXISUltra,Kratos)对TiO2纳米管的元素组成进行了分析,其分析条件为:采用AlKα单色X射线发射源,操作电压为10kV,操作电流为15mA。
1.3 TiO2纳米管光电催化性能表征
在不同时间条件下制备的TiO2纳米管的光电催化性能通过光电流响应测试来表征,采用标准三电极工作体系,以TiO2纳米管(工作面积为1×1cm2)为工作电极,Pt丝为对电极,Ag|AgCl(Metrohm,3M KCl)为参比电极,电解液为1.0mol/L KOH溶液,采用365nm的紫外光源(光强为61.8mW/cm2)照射TiO2纳米管,在施加电压为0V的条件下测试TiO2纳米管的光电流响应值,同时计算了光电流稳定时,TiO2纳米管在紫外光照条件下的光电转化效率,其具体计算过程如下:
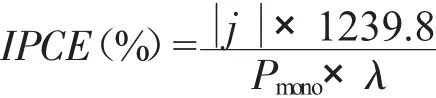
其中,j代表单位面积的TiO2纳米管在光照条件下所产生的光生电流密度,单位为mA/cm2;1239.8代表普朗克常量h和光速c之积,单位为V×nm;Pmono代表照射光源的强度,单位为mW/cm2;λ为照射光源的波长,为365nm。
采用10μmol/L的罗丹明B(RhB)溶液为反应溶剂,在365nm紫外光源照射下,对比不同时间条件下制备的TiO2纳米管的光催化性能,采用紫外-可见吸收光谱测定不同反应时间下RhB在554nm的吸收强度,并由此计算TiO2纳米管对RhB的光催化降解效率。
2 结果与讨论
2.1 TiO2纳米管物理性能表征
2.1.1 TiO2纳米管微观形貌表征
在不同时间条件下制备所得TiO2纳米管的顶端及截面形貌如图1所示。可以看出,当阳极氧化反应为10min时(图1a),Ti片表面形成了一种多孔性的空间网状结构层,并且孔径大小不一,平均孔径约为55nm。而通过其断裂面可以看出,在该空间网状层的下方形成了排列规整的管状结构,长度大约为1μm,说明在阳极氧化条件下,首先形成的氧化层被F-逐渐刻蚀,形成管状结构,而当氧化时间继续增加到30min后(图1b),TiO2纳米管顶端裸露为开口状态,但仍有少许TiO2纳米管顶端被覆盖,此时TiO2纳米管的长度增长到1μm,管径提高到了80nm。随着氧化时间的继续增长,TiO2纳米管的长度逐渐增长,同时管径也逐渐提高,TiO2纳米管的顶端开口处的覆盖物质逐渐消失,当阳极氧化时间为120min时(图1d),所形成的TiO2纳米管排列规整,其管径保持在115nm左右,而长度提高到了4.5μm左右。继续增加氧化反应时间反而使得TiO2纳米管顶端受到过度侵蚀而出现丝絮状物质,当反应时间提高到480min时(图1f),TiO2纳米管的长度提高到了7.1μm,但大部分TiO2纳米管顶端被过度刻蚀而变得不完整,由此可见,TiO2纳米管的形貌受氧化反应时间的不同而具有很大的影响,选择适宜的氧化反应时间,制备出催化效率较高的TiO2纳米管尤为重要。

图1 不同氧化时间条件下TiO2纳米管顶端及截面SEM图Fig.1 The SEM images of TiO2nanotubes prepared in different oxidation time
2.1.2 TiO2纳米管物相结构分析
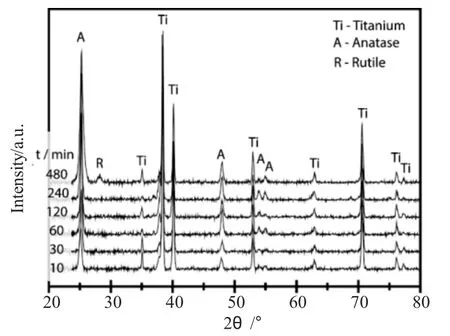
图2 不同氧化时间条件下TiO2纳米管XRD谱图Fig.2 The XRD patterns of TiO2nanotubes prepared in different oxidation time
通过对TiO2纳米管的物相结构进行表征(图2)发现,在不同氧化时间条件下制备得到的TiO2纳米管经过在450℃条件下煅烧3h后,其晶型结构主要转变为锐钛矿(A)结构[26],其特征峰出现在25.3°、38°、47.7°、54.8°位置处,分别对应其101、004、105、204晶面,并且随着阳极氧化时间的提高,TiO2纳米管的锐钛矿峰信号强度增加,说明TiO2的生成量提高,这与由SEM图所观察到的随着氧化时间提高其长度增加的结果是一致的。但当氧化时间为480min时,经过煅烧后有少量的金红石相(R)生成。
2.1.3 TiO2纳米管组成元素分析
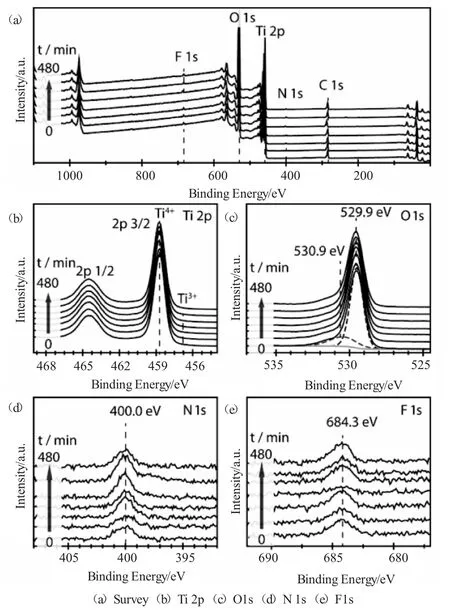
图3 不同氧化时间条件下TiO2纳米管XPS谱图Fig.3 The XPS spectra of TiO2nanotubes prepared in different oxidation time
通过XPS对在不同时间条件下制得的TiO2纳米管进行了元素组成分析,具体结果见图3。(图3a)为不同时间条件下制备的TiO2纳米管的XPS全谱扫描,由图中可以看出,TiO2纳米管的主要组成成分为Ti、O、C,同时还有少量的F和N两种元素掺杂。其中C元素可以认为是在样品测试过程中,来自于外部污染,而N和F元素的掺杂主要来自于阳极氧化过程中电解液中的NH4F。由Ti 2p的高分辨率扫描图(图3b)可以看出,结合能为458.7eV和464.5eV处的特征峰分别归属于Ti 2p 3/2和Ti 2p1/2特征峰[27],其中Ti元素的主要组成为Ti4+,而并未出现Ti3+元素的特征峰。经过对O1s的高分辨率XPS谱图进行拟合(图3c)可以看出,出现在529.9eV位置处的O 1s峰归结于TiO2中O元素的结合能,这表明所制备的纳米管的主要化学组成为TiO2。另外,530.9eV处的特征峰表明有少量Ti-OH的存在。对于N 1s高分辨率谱图来说,所有的N元素峰均出现在400.0eV,此处为Ti-N-O键中N元素的结合能特征峰,说明N元素掺杂进了TiO2的晶格结构中[28],而在不同时间条件下制备得TiO2纳米管中其N元素的掺杂量不受氧化时间的影响,大约在0.8%左右。TiO2纳米管中F元素的特征峰位置出现在684.3eV处(图3e),其主要是由吸附在TiO2纳米管表面的F-构成,在TiO2纳米管后期煅烧的过程中可以将大部分的F-去除掉[27],剩余部分F-的含量大约为1%,基本不受阳极氧化时间变化的影响。
2.2 TiO2纳米管光电催化性能表征
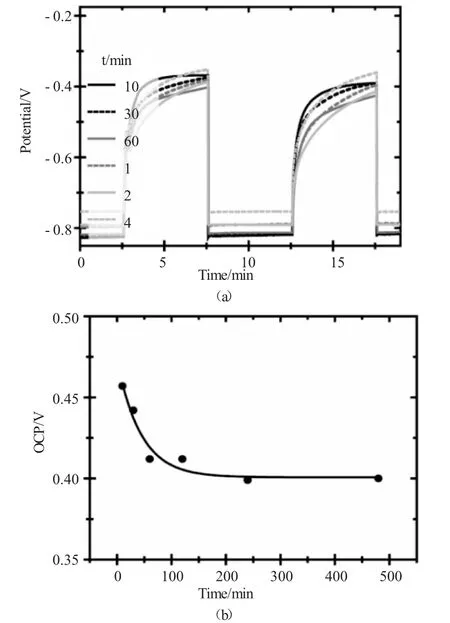
图4 不同氧化时间条件下TiO2纳米管光电压谱Fig.4 The open circuit potential of TiO2nanotubes prepared in different oxidation time
通过光电流-电压响应测试了不同阳极氧化时间条件下制备得TiO2纳米管的光电催化性能,其中在365nm条件下的光生电压值如图4所示。在开路条件下,光生电压值(OCP)的大小代表了光生电子-空穴对的转移和再结合能力,较高的OCP代表TiO2纳米管表面所产生的电子-空穴对可以被有效转移,再结合的效率降低,有利于催化反应的进行。而由(图4b)可以看出,在不同阳极氧化时间条件下制备的TiO2纳米管的光生电压值随着氧化时间的增长呈现出不断下降的趋势,当阳极氧化时间达到240min以后,其OCP值达到稳定状态,这与不同时间条件下所生成的TiO2纳米管的形貌有直接的关系,在较低的氧化时间条件下生成的TiO2纳米管整体结构较为规整,表面缺陷较少,因此所生成的光生电子-空穴对的再结合速率降低,利用率提高,而随着氧化时间的提高,TiO2纳米管表面的缺陷增多,这就为光生电子-空穴对的再结合提供了更多的活性位,导致光生电子-空穴对的再结合速率下降。
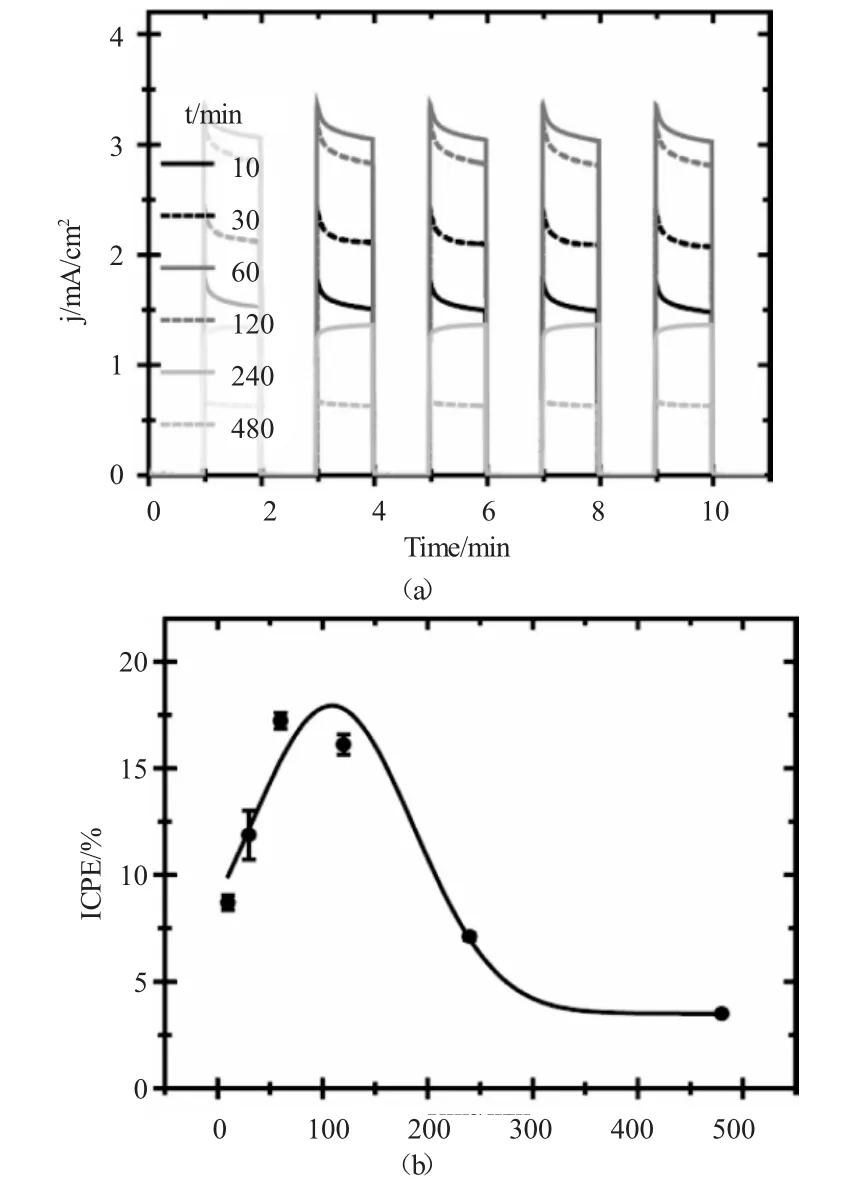
图5 不同氧化时间条件下TiO2纳米管光电流响应谱及光电转化效率Fig.5 The photocurrent response spectrum and IPCE of TiO2nanotubes prepared in different oxidation oxidation time
而光生电流(j)的大小不仅反映出TiO2纳米管在光照条件下产生光生电子的能力,同时还反映出光生电子-空穴对的有效分离而反应产生电流的能力。(图5a)和(图5b)分别反应出不同阳极氧化时间条件下所制备的TiO2纳米管的光生电流密度以及光电转化效率(ICPE)。由(图5a)可以看出,随着氧化反应时间的增加,所制备的TiO2纳米管的光电流密度以及ICPE均逐渐增加,因为随着反应时间的增长,所制备的TiO2纳米管的顶端开口清洁度以及TiO2纳米管的长度都有所提高,导致TiO2纳米管的吸光效率提高,有更多的吸收光子转化成电子被利用;但当氧化时间大于120min以后,其光电流密度和ICPE均迅速降低,这主要是因为,过高的阳极氧化时间条件下所生成的TiO2纳米管表面由于F-的过度刻蚀而出现丝束状缺陷,而这些缺陷就为光生电子-空穴对的复合提供了更多的活性中心,导致光生电子-空穴对利用率下降,催化效率降低。
2.3 TiO2纳米管光催化性能表征
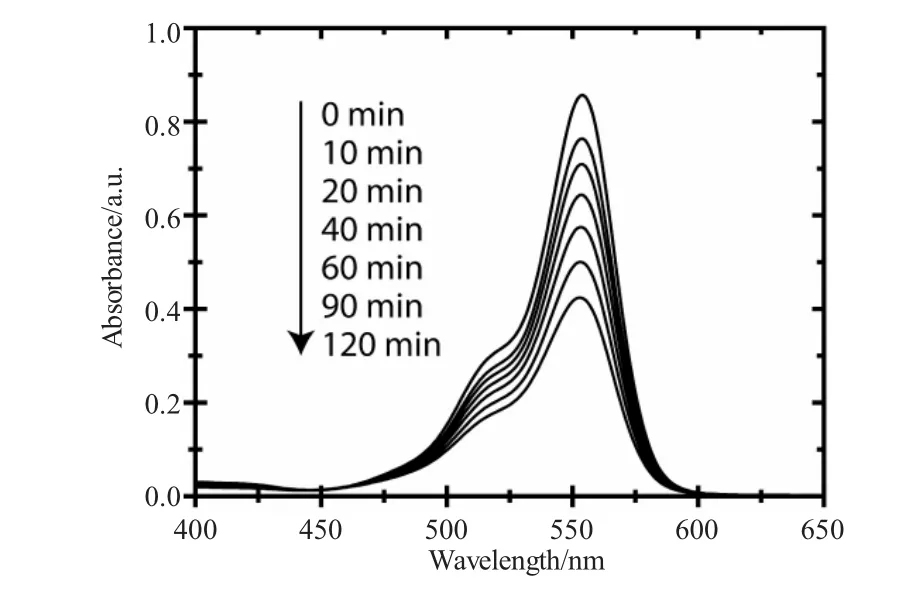
图6 TiO2纳米管催化降解RhB紫外可见吸收光谱Fig.6 The UV-vis spectra of RhB in different irradiation time catalyzed by TiO2nanotubes
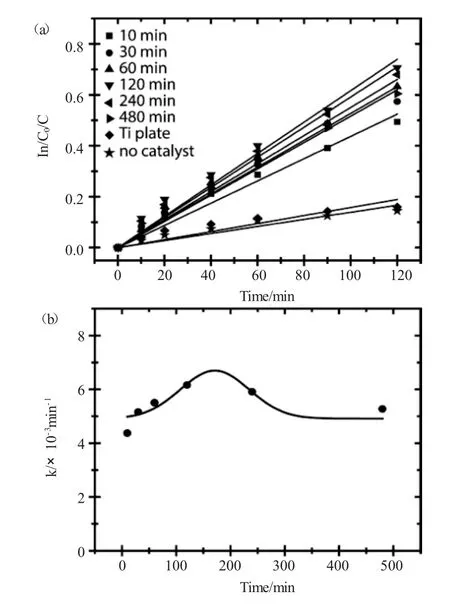
图7 不同氧化时间条件下TiO2纳米管光催化降解RhB反应速率对比Fig.7 The photo-degradation rate of RhB catalyzed by TiO2nanotubes prepared in different oxidation time
TiO2纳米管光催化降解有机染料是测试TiO2纳米管光催化性能的一个重要表征手段。选取RhB为反应物,在365nm紫外光照下测试不同阳极氧化反应时间下制备的TiO2纳米管的光催化效率。图6是以阳极氧化时间为120min条件下制备的TiO2纳米管为催化剂,在不同光照时间条件下,RhB的紫外-可见吸收光谱。由图中可以看出,随着光照时间的延长,RhB在554nm处的吸收峰强度逐渐降低,说明在TiO2纳米管的催化作用下,RhB被有效降解,不同阳极氧化时间条件下制备的TiO2纳米管催化降解RhB的反应速率对比见图7所示。为了更加明确TiO2纳米管的光催化降解效率,同时选择以空白催化剂(no catalyst)和纯Ti片(Ti plate)两组参比试验来对比不同TiO2纳米管的催化效果。由图中可以看出,两组参比试验的催化效率接近,说明未进行阳极氧化反应的Ti片无催化效果,随着阳极氧化反应时间的提高,其光催化降解RhB的效率迅速提高,说明阳极氧化条件下TiO2纳米管的形成有效提高了紫外光的利用率,产生了更多的光生电子-空穴对,光生电子与RhB分子有效结合发生了降解反应,当阳极氧化时间为120min时,TiO2纳米管对于RhB的光催化降解速率达到最大值,随着阳极氧化时间的继续增加,TiO2纳米管的光催化效率逐渐降低,这与图5中光生电流密度以及光电转化效率随阳极氧化时间变化的结果是一致的。
3 结 论
通过调控电化学阳极氧化过程中氧化时间的因素制备了一系列具有不同形貌的TiO2纳米管,并研究了其光电催化性能以及光催化降解有机染料的催化效率,具体结果如下:
(1)随着阳极氧化反应时间的增长,TiO2纳米管的管径和长度都逐渐提高,顶端清洁度提高。当阳极氧化时间为120min时,所形成的TiO2纳米管排列规整,管径为115nm左右,长度约为4.5μm。继续提高反应时间,TiO2纳米管的长度继续增加,但是其顶端由于过度刻蚀而规整度下降。
(2)阳极氧化时间较短时,所生成的TiO2纳米管产生的光生电流密度相对较小,随着阳极氧化时间的不断提高,TiO2纳米管的长度和管径都有所增加,从而提高了紫外光有效利用率,光生电流增大,光电转化效率提高,但过高的氧化时间也会因为造成TiO2纳米管表面规整度下降而降低其光电转化效率。
(3)对不同阳极氧化时间条件下制备的TiO2纳米管的光催化性能进行了表征,随着阳极氧化时间的提高,其光催化效率呈现出先升高后降低的趋势,这与TiO2纳米管的长度和表面规整度有直接的关系。
[1] MACAK J M,TSUCHIYA H,GHICOV A,et al.TiO2nanotubes: Self-organized electrochemical formation,properties and applications,Current Opinion in Solid State and Materials[J].Science,2007,11:3~18.
[2] GUO C,XU J,HE Y,et al.Photodegradation of rhodamine B and methyl orange over one-dimensional TiO2catalysts under simulated solar irradiation[J].Applied Surface Science,2011,257: 3798~3803.
[3] ZHANG Z,HOSSAIN M F,TAKAHASHI T.Photoelectrochemical water splitting on highly smooth and ordered TiO2nanotube arrays for hydrogen generation[J].International Journal of Hydrogen Energy,2010,35:8528~8535.
[4] NAZEERUDDIN M K,HUMPHRY-BAKER R,LISKA P,et al.Investigation of sensitizer adsorption and the influence of protons on current and voltage of a dye-Sensitized nanocrystalline TiO2solar cell[J].The Journal of Physical Chemistry B,2003,107: 8981~8987.
[5] BAO S J,LI C M,ZANG J F,et al.New nanostructured TiO2for direct electrochemistry and glucose sensor applications[J].Advanced Functional Materials,2008,18:591~599.
[6] WANG Q,WEN Z H,LI J H.A Hybrid supercapacitor fabricated with a carbon nanotube cathode and a TiO2B nanowire anode[J].Advanced Functional Materials,2006,16:2141~2146.
[7] ROY P,BERGER S,SCHMUKI P.TiO2nanotubes:synthesis and applications[J].Angewandte Chemie International Edition,2011, 50:2904~2939.
[8] LI X,XIONG Y,LI Z,et al.Large-scale fabrication of TiO2hierarchical hollow spheres[J].Inorganic Chemistry,2006,45: 3493~3495.
[9] NAKASHIMA T,KIMIZUKA N.Interfacial synthesis of hollow TiO2microspheres in ionic liquids[J].Journal of the American Chemical Society,2003,125:6386~6387.
[10] WANG X,Sφ L,SU R,et al.The influence of crystallite size
and crystallinity of anatase nanoparticles on the photo-degrada
tion of phenol[J].Journal of Catalysis,2014,310:100~108.
[11] MOR G K,VARGHESE O K,PAULOSE M,et al.Transparent highly ordered TiO2nanotube arrays via anodization of titanium thin films[J].Advanced Functional Materials,2005,15:1291~1296.
[12] SHRESTHA N K,MACAK J M,SCHMIDT-STEIN F,et al.Magnetically guided titania nanotubes for site-selective photocatalysis and drug release[J].Angewandte Chemie International Edition,2009,48:969~972.
[13] FENG X,SHANKAR K,VARGHESE O K,et al.Vertically aligned single crystal TiO2nanowire arrays grown directly on transparent conducting oxide coated glass:synthesis details and applications[J].Nano Letters,2008,8:3781~3786.
[14] FENG X,ZHAI J,JIANG L.The Fabrication and switchable superhydrophobicity of TiO2nanorod films[J].Angewandte Chemie International Edition,2005,44:5115~5118.
[15] ALBU S P,GHICOV A,MACAK J M,et al.250 μm long anodic TiO2nanotubes with hexagonal self-ordering[J].Physica Status Solidi(RRL)Rapid Research Letters,2007,1:R65~R67.
[16] ALBU S P,SCHMUKI P.TiO2nanotubes grown in different organic electrolytes:Two-size self-organization,single vs.double-walled tubes,and giant diameters,Physica Status Solidi(RRL)Rapid Research Letters,2010,4:215~217.
[17] MACAK J M,ZLAMAL M,KRYSA J,et al.Self-organized TiO2nanotube layers as highly efficient photocatalysts[J].Small,2007, 3:300~304.
[18] PAULOSE M,PRAKASAM H E,VARGHESE O K,et al.TiO2Nanotube arrays of 1000 μm length by anodization of titanium foil:phenol red diffusion[J].The Journal of Physical Chemistry C,2007,111:14992~14997.
[19] BERANEK R,HILDEBRAND H,SCHMUKI P.Self-organized porous titanium oxide prepared in H2SO4/HF electrolytes[J].Electrochemical and Solid-State Letters,2003,6:B12~B14.
[20] ZWILLING V,DARQUE-CERETTI E,BOUTRY-FORVEILLE A,et al.Structure and physicochemistry of anodic oxide films on titanium and TA6V alloy[J].Surface and Interface Analysis, 1999,27:629~637.
[21] GONG D,GRIMES C A,VARGHESE O K,et al.Titanium oxide nanotube arrays prepared by anodic oxidation[J].Journal of Materials Research,2001,16:3331~3334.
[22] ZWILLING V,AUCOUTURIER M,DARQUE-CERETTI E.Anodic oxidation of titanium and TA6V alloy in chromic media.An electrochemical approach[J].Electrochimica Acta,1999,45 :921~929.
[23] RUAN C,PAULOSE M,VARGHESE O K,et al.Fabrication of highly ordered TiO2nanotube arrays using an organic electrolyte[J].The Journal of Physical Chemistry B,2005,109:15754~15759.
[24] MACAKJM,SIROTNAK,SCHMUKIP.Self-organizedporoustitaniumoxidepreparedinNa2SO4/NaFelectrolytes[J].Electrochimica Acta,2005,50:3679~3684.
[25] BAUER S,KLEBER S,SCHMUKI P.TiO2nanotubes:Tailoring the geometry in H3PO4/HF electrolytes[J].Electrochemistry Communications,2006,8:1321~1325.
[26] KAWAHARA T,KONISHI Y,TADA H,et al.A Patterned TiO2(Anatase)/TiO2(Rutile)Bilayer-Type Photocatalyst:Effect of the Anatase/Rutile Junction on the Photocatalytic Activity[J].Angewandte Chemie,2002,114:2935~2937.
[27] ALBU S P,GHICOV A,ALDABERGENOVA S,et al.Formation of double-walled TiO2nanotubes and robust anatase membranes[J].Advanced Materials,2008,20:4135~4139.
[28] YUAN B,WANG Y,BIAN H,et al.Nitrogen doped TiO2nanotube arrays with high photoelectrochemical activity for photocatalytic applications[J].Applied Surface Science,2013,280: 523~529.
The Morphology and Photoelectro-catalytic Performance of TiO2Nanotubes Synthesized by Anodizing Method-Oxidation Time Control
WANG Xue-qin,MENG Ling-hui and HUANG Yu-dong
(College of Chemical Engineering and Technology,Harbin Institute of Technology,Harbin,150001,China)
A series of TiO2nanotubes were prepared by anodizing method in different oxidation time.The morphology,crystal structure and the element composition of these TiO2nanotubes were characterized by SEM,XRD and XPS,respectively.The corresponding photoelectron-catalytic and photocatalytic performance of the TiO2nanotubes were studied by the photo-current density measurement and the photo-degradation of RhB.The results showed that the optimized anodization time was 120mins,at which the incident photon to current conversion efficiency(IPCE)of the TiO2nanotubes reached 18%,and the reaction rate constant of the photocatalytic degradation of RhB reached 6×10-3min-1.
TiO2;nanotubes;oxidation time;photoelectron-catalysis;photo-degradation
TQ426.7
A
1001-0017(2015)01-0005-06
2014-10-17
王雪芹(1985-),女,河北邢台人,在读博士研究生,主要从事光催化半导体材料的研究。
*通讯联系人:黄玉东,Email:ydhuang.hit1@yahoo.com.cn
