亮氨酸拉链蛋白对前脂肪细胞增殖、分化及相关基因表达的影响
2015-01-08王毅飞邢飞跃吴琳英黄晓淳
王毅飞 伊 娜 邢飞跃 吴琳英 黄晓淳
(1广州医科大学内分泌科,广东 广州 510120;2广州市中医院内分泌科,广东 广州510130,3暨南大学生命科学技术学院组织移植与免疫中心,广东广州510632)
脂肪细胞是哺乳动物的一类重要功能细胞,在维持脂类代谢及能量代谢平衡方面发挥关键作用。脂肪细胞的分化经由前脂肪细胞分化为成熟脂肪细胞,是一个复杂的过程,这一过程受到许多转录因子、细胞因子以及激素的调节作用。脂肪细胞分化与调控失常可导致人类多种疾病如肥胖症、2型糖尿病、脂肪肝、高脂血症及乳腺癌等[1,2]。
糖皮质激素(glucocorticoid,GC)诱导亮氨酸拉链 蛋 白 (glucoc orticoid induced leucine zipper,GILZ)被报道是一种糖皮质激素诱导蛋白,具有炎性抑制、保护T细胞凋亡等多项作用[3]。在脂肪细胞形成过程中,作为细胞相关信号通路作用靶点的转录因子,过氧化物增殖活化受体γ2(Peroxisome Proliferative Activated Receptor,PPARγ2)和 CCAAT增强子结合蛋白α(C/EBPα)起了重要的作用。脂肪细胞分化转录因子C/EBPα同样能够启动前脂肪细胞分化中特异性表达的基因的转录。C/EBPα和PPARγ2可以相互激活转录并协同作用,促发脂肪细胞的分化[6-8]。
GILZ作为一种重要的信号蛋白分子和核转录因子,GILZ是否参与了脂肪细胞的增殖、分化,是否通过C/EBPa和PPARγ2的介导等分子机制还非常不清楚。本文对GILZ在脂肪细胞分化中的作用及对脂肪细胞分化相关基因 PPARγ2,C/EBPa,LPL和FAS的mRNA表达的影响进行了探讨,初步探讨GILZ的对前脂肪细胞增殖、分化作用及机制。
1 材料与方法
1.1 主要材料
Lipofectamine 2000脂质体、SlowFade(Invitrogen公司),小牛血清、DMEM(Hyclone公司),HA单抗、油红 O、地塞米松、3-异丁基-1-甲基-黄嘌呤、胰岛素、G418(美国 Sigma),羊抗鼠IRDye 800二抗(LICOR公司),羊抗鼠-CY3二抗(Zymed公司),琼脂糖和 LB培养基(Life Technology公司),PVDF膜(美国 Bio-Rad 公司),HA-GILZ/PcDNA3 重组表达载体、GILZ稳定表达3T3-L1细胞株、BL21(DE3)感受态(本室保存)。其它试剂为国产分析纯。
1.2 方法
1.2.1 MTT法 用含10%胎牛血清DMEM培养液配成单个细胞悬液,以每孔1×103个细胞接种到96孔板,每孔体积200μL。分别培养细胞1~11 d。培养不同天后,每孔加MTT溶液(5 mg/ml)20μL。继续孵育4 h,小心吸弃孔内培养上清液。每孔加150μL DMSO。振荡10 min,使结晶物充分融解。选择570 nm波长,在酶联免疫监测仪上测定各孔光吸收值(A)。以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.2 3T3-L1前脂肪细胞株的诱导分化 将3T3-L1前脂肪细胞接种于12孔或6孔培养板,采用含10%FBS的DMEM完全培养液。在37℃、5%的CO2条件下培养,每2~3天换液1次。待细胞生长至完全融合后2 d,开始诱导分化(第0天,D0):将培养液换为脂肪细胞诱导剂(MID):含0.5 mmol/L 3-异丁基-1-甲基-黄嘌呤(MIX)、0.25 μmol/L 地塞米松和10μg/mL胰岛素的完全培养液48 h。换以含10μg/mL胰岛素的完全培养液孵育48 h。以不含任何诱导剂的完全培养液继续培养,每2天换培养液1次。
1.2.3 油红O染色 取分化的3T3-L1前脂肪细胞。PBS洗3次,4%多聚甲醛固定液固定细胞5 min。去掉多聚甲醛固定液,再加相同体积的多聚甲醛固定液固定细胞至少1 h。去掉多聚甲醛固定液,60%异丙醇洗1次。细胞完全晾干,加油红O工作液于细胞表面,静置10 min。弃油红O染液,立即流水洗至背景透明。倒置显微镜下观察结果,拍摄照片。
1.2.4 油红O染色法生化测定甘油三酯相对含量油红O染色的细胞室温完全晾干,加0.4 mL 100%异丙醇,静置10 min以上,用枪头反复吹打几次,使油红O完全溶解,转移到新的1.5 mL EP管使用,检测500 nm的A值(空白对照100%异丙醇)。
1.2.5 实时荧光定量PCR(Real-time PCR)法检测
检测脂肪细胞分化相关标志基因:PPARγ2,C/EBPa,LPL和 FAS的 mRNA表达。根据它们的Genbank序列设计引物见表1。取MID处理的第9天(D9)培养于6 cm培养皿的3T3-L1前脂肪细胞,按Invitrogen的Trizol说明书进行提取细胞总RNA。在200μL PCR反应管中依次加入如下试剂:RNA抽提物2μg、DEPC处理水(计算补水量总反应至25μL),在PCR仪上70℃ 10 min。立即放入冰浴中,然后依次加入如下试剂:Rnasin 1μL、Oligo(dT)15随机引物2 μL、10 mmol/L dNTP 1 μL、5 ×RT 缓冲液 5 μL、MMLV逆转录酶1μL。42℃ 60 min,95℃ 5 min。取1μL反应物(cDNA模板)进行PCR反应:2μMaster Mix 10 μL、正、反向引物(10 pol/μL)0.5 μL,加ddH2O至反应体系20μL。扩增参数为95℃ 5 min、94 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,40 个循环后72 ℃延伸10 min。由分析软件Opticon Monitor 3搜集数据,测定各样品的Ct值(Cycle threshold)。以管家基因β-actin为内参照对待测样品的Ct值进行校正相对表达量,计算校正值2-△△Ct进行统计分析。

表1 荧光定量PCR引物序列
1.3 统计学处理
组间计量资料比较采用重复测量设计的方差分析或t检验,应用SPSS 13.0软件进行统计分析,P<0.05表示差异有统计学意义。
2 结果
2.1 GILZ过表达对3T3-L1脂肪细胞增殖的影响
MTT法检测GILZ稳定表达3T3-L1细胞从D1到D11细胞的增殖情况。用重复测量设计的方差分析显示,时间效应有统计学意义(F=1859.786,P=0.000),说明3T3-L1脂肪细胞增殖随时间变化;转染与时间之间没有交互作用(F=2.460,P=0.068),说明在GILZ过表达组和对照组,细胞增殖随时间变化的趋势相同;转染主效应没有统计意义(F=0.021,P=0.892)及 t检验 PcDNA3 对照和GILZ 过表达组第1,3,5,7,9,11 天组间没有差异没有统计学意义(P>0.05),说明 GILZ对3T3-L1脂肪细胞增殖没有明显影响(图1)。
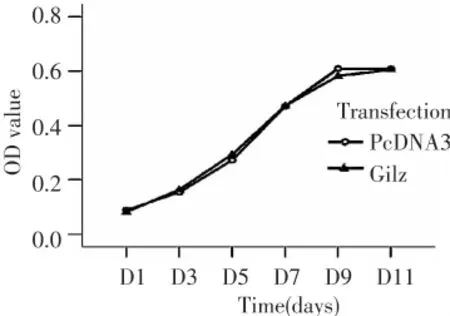
图1 GILZ过表达对小鼠前脂肪细胞3T3-L1增殖的影响(n=3)
2.2 GILZ过表达对脂肪细胞分化的影响
3T3-L1细胞生长融合48 h后,用脂肪细胞诱导基MID处理48 h,然后换成5μg/mL胰岛素的正常培养基(隔天换液)培养9 d,用Oil-Red-O 法染色观察、拍照。可见对照组经MID诱导后,大部分细胞胞浆中脂滴呈桔红色(图2),而GILZ过表达组呈桔红色细胞显著减少。表明GILZ过表达能显著地抑制前脂肪细胞的分化。
2.3 甘油三酯相对含量测定
3T3-L1细胞生长融合48 h后,用脂肪细胞诱导基MID处理48 h,然后换成5μg/mL胰岛素的正常培养基(隔天换液)培养 9 d,Oil-Red-O 法染色,用100%异丙醇溶解Oil-Red-O法染色的细胞,测500 nm吸光值测定分化脂肪细胞内甘油三酯相对含量。经析因分析统计,GILZ表达与诱导之间有交互作用(F=80.023,P=0.000),诱导有主效应(F=181.383,P=0.000),转染有主效应(F=87.267,P=0.000)。可见经MID诱导后,GILZ过表达组与对照组相比,甘油三酯相对含量显著降低(P=0.000,n=3,图2-3),生化检测结果显示 GILZ 过表达也是显著地抑制前脂肪细胞的分化。
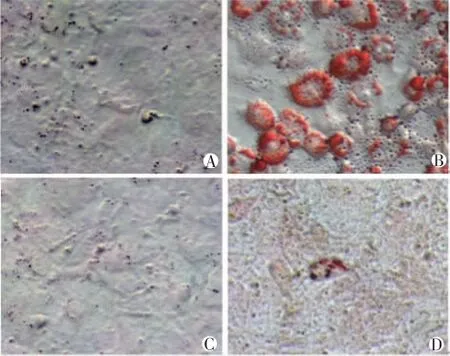
图2 GILZ过表达对3T3-L1前脂肪细胞株诱导分化的影响(×200)

图3 GILZ过表达对3T3-L1前脂肪细胞甘油三酯相对含量的影响
2.4 GILZ过表达对脂肪细胞分化相关标志基因的影响
MID诱导后,用重复测量设计的方差分析显示,实时荧光定量PCR(Real-time PCR)法检测分化过程的3T3-L1 细胞内 PPARγ2,C/EBPα,LPL 和 FAS的mRNA表达,时间效应有统计学意义(分别是F=184.945,P=0.000;F=239.273,P=0.000;F=82.626,P=0.000;F=107.537,P=0.000),说明这些基因表达随时间变化;转染与时间之间有交互作用(F=141.808,P=0.000;F=183.810,P=0.000;F=51.187,P=0.000;F=71.710,P=0.000),说明在GILZ过表达组和对照组,上述基因mRNA表达随时间变化的趋势不同;二组间的上述基因mRNA表达不同,GILZ过表达组低于对照组(F=227.237,P=0.000;F=683.755,P=0.000;F=3471.174,P=0.000;F=788.549,P=0.000)及 t检验0 天没有差异(P >0.05),3,6,9 d 各组之间有差异(P <0.01),说明 GILZ 对上述基因mRNA表达有抑制作用(图2~4)。
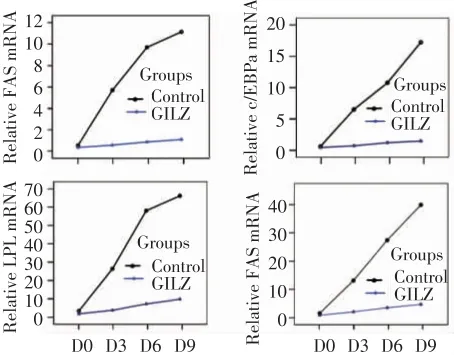
图4 GILZ过表达对脂肪细胞分化相关标志基因的影响
3 讨论
前脂肪细胞(Preadipocyte)是脂肪细胞的一种,由多能干细胞(multipotential stem cell,MSC)或胚胎干细胞(embryonic stem cell,ESC)分化而来。前脂肪细胞在体内和体外都可以分裂增殖并在胞质内聚集脂滴而分化为成熟的脂肪细胞。我们的MTT结果显示GILZ过表达对3T3-L1前脂肪细胞增殖没有明显的影响,先前曾有报道[9]显示GILZ对间充质干细胞增殖也没有影响,表明GILZ的生物学功能可能不在细胞增殖方面。然而,当用脂肪细胞诱导基 MID、胰岛素诱导培养,Oil-Red-O 法染色,可见GILZ未过表达的对照组经MID诱导9 d后,大部分细胞胞浆中脂滴呈桔红色(图2B),而GILZ过表达组呈桔红色细胞明显减少(图2D)。脂肪细胞甘油三酯的含量也显著性降低(0.365±0.012 vs 0.181±0.014,P <0.001),表明 GILZ 过表达可以抑制前脂肪细胞向脂肪细胞的分化。
细胞分化的本质是基因表达模式的转变。前脂肪细胞是在多种转录因子的调控下,激活多个脂肪组织相关基因,并在这些基因的顺序性协调控制下,经过一系列复杂的步骤后才分化成成熟脂肪细胞。目前认为,在脂肪细胞形成过程中,作为细胞相关信号通路作用靶点的转录因子PPARγ2被认为是调控脂肪细胞分化的关键分子,有的称是主控调节子(master regulator)[6,7]。PPARγ2 通过与下游靶基因启动子上的PPAR反应元件(PPAR response elements,PPRE)结合而激活基因表达[10]。它的表达可以促使脂肪细胞分化、诱导细胞周期的撤出(cell cycle withdrawal)及许多细胞系的终末脂肪细胞分化等[11]。PPARα可以调节脂肪酸代谢的各个环节,增加脂肪酸转运蛋白和脂肪酸转运酶的表达,刺激细胞对脂肪酸的摄入和向脂酰CoA的转化[12,13]。PPARα 还能选择性诱导脂蛋白脂肪酶(LPL)基因在脂肪组织的表达,调节脂肪细胞的信号转导,减缓脂解速度,从而降低游离脂肪酸的量。
本组的试验,分别检测了脂肪分化的标志性PPARγ2、C/EBPσ、LPL 和 FAS 基因 mRNA 表达,MID诱导后,实时荧光定量PCR法检测显示,分化过程中GILZ过表达的3T3-L1细胞内脂肪细胞分化基因 PPARγ2,C/EBPα,LPL和 FAS的 mRNA 表达显著降低,表明GILZ过表达可显著性抑制脂肪细胞分化相关标志基因 PPARγ2,C/EBPα,LPL 和FAS的mRNA表达,与分化过程中反映脂滴形成的油红O染色结果相一致。
由于PPARγ2和C/EBPα又是脂肪细胞分化转录因子,我们的结果GILZ可显著性抑制PPARγ2,C/EBP的mRNA表达,意味着GILZ可能通过下调脂肪细胞分化转录因子PPARγ2,C/EBPα的表达而抑制脂肪细胞的分化。
目前,针对GILZ的研究多数都集中于其抑制炎症方面,它与T淋巴细胞关系密切,被认为是调节T淋巴细胞活化的候选转录因子。本研究探讨了GILZ对脂肪细胞的抑制作用极可能是通过影响脂肪细胞分化相关标志基因PPARγ2,C/EBP,LPL和FAS的mRNA表达实现的。而脂肪细胞分化纷繁复杂,多种转录因子协同参与调节分化基因的表达,多种激素和细胞因子对脂肪细胞的发生都发挥着不同的作用。脂肪细胞在人体的糖脂代谢平衡、胰岛素敏感性的维护中起着重要的作用,脂肪细胞正常的分化调控对于维持正常糖脂代谢平衡及预防胰岛素抵抗和糖尿病的发生是必须的,深入研究GILZ对脂肪细胞的分化调控机制有助于更好地了解糖脂代谢障碍及胰岛素抵抗和2型糖尿病的发生机制,为今后寻找小分子抗糖尿病药物奠定基础。
[1]Sharma M,Staels B Peroxisome proliferator-activated receptor γ and adipose tissue-understanding obesity-related changes in regulation of lipid and glucose metabolism[J].J Clin Endocrinol Metab,2007,92(4):386-395.
[2] Shimano H.Obesity and atherosclerosis[J].Nippon Rinsho.2009,67(2):333-337.
[3]D′Adamio F,Zollo O,Moraca R,et al A new dexamethasoneinduced gene of the leucine zipper family protects T lymphocytes from TCR/CD3-activated cell death [J].Immunity,1997,7(6):803-812.
[4]白祥军,李 波,王海平,等.糖皮质激素诱导亮氨酸拉链蛋白与炎症反应关系的研究[J].中国危重病急救医学,2007,19(1):7-10.
[5]Ayroldi E,Migliorati G,Bruscoli S,et al Modulation of T-cell activation by the glucocorticoid-induced leucine zipper factor via inhibition of nuclear factor kappaB[J].Blood,2001,98(3):743-53.
[6] Rosen ED,Sarraf P,Tory AE et al.PPAR gamma is required for the differentiation of adipose tissue in vivo and in vitro[J].Mol Cell,1999,4(2):611-617.
[7]Kubota N,Terauchi Y,Sugiyama HT,et al PPAR gamma mediate high-fat diet induced adipocyte hypertrophy and insulin resistance[J].Mol Cell,1999,4:597-609.
[8]Yeh WC,Cao Z,Mcknight SL et al.Cascade regulation of terminal adipocyte differentiation by three members of the C/EBP family of leucine zipper proteins[J].Gene Dev,1995,15(6):168-81.
[9]Zhang W,Yang N,Shi XM Regulation of mesenchymal stem cell osteogenic differentiation by glucocorticoidinduced leucine zipper(GILZ)[J].J Biol Chem,2008,283(8):4723-4729.
[10]Mandard S,Müller M and Kersten S.Peroxisome proliferatoractivated receptor target genes,Cell[J].Mol Life Sci,2004,61(4):393-416.
[11] Tontonoz P,Hu E,Devine J,et al.PPAR gamma 2 regulates adipose expression of the phosphoenolpyruvate carboxykinase gene[J].Mol Cell Biol,1995,15(1):351-357.
[12]Ge K,Guermah M,Yuan CX,et al.Spiegelman and R.G. Roeder,Transcription coactivator TRAP220 is required for PPARγ2-stimulated adipogenesis [J].Nature,2002,417(8):563-567.
[13]Payne VA,Au WS,Gray SL,et al.Sequential regulation of diacylglycerol acyltransferase 2 expression by CAAT/enhancer-binding protein beta(C/EBPbeta)and C/EBPalpha during adipogenesis[J].J Biol Chem,2007,282(29):21005-21014.
