珍珠菜中黄酮及Megastigmane 类化学成分研究
2015-01-08刘彦飞郝志友陈若芸于德泉
梁 东,刘彦飞,郝志友,陈若芸,于德泉*
1中国医学科学院北京协和医学院药物研究所 天然药物活性物质与功能国家重点实验室,北京 100050;2广西师范大学化学与药学学院 药用资源化学与药物分子工程国家重点实验室培育基地,桂林 541004
珍珠菜Lysimachia clethroides Duby 为报春花科珍珠菜属植物,又名红根草、红头绳(江西)、劳伤药(云南)、酸罐罐(陕西)等[1]。全草入药,广泛分布于华北及长江以南各省区,具有清热解毒、活血调经、利水消肿等功效。现代科学研究证明,珍珠菜属主要化学成分为黄酮和三萜皂苷,主要具有细胞毒、抗菌消炎、免疫调节等多种生物活性[2]。为了有效利用这一资源,本课题组对珍珠菜进行了系统的化学成分研究,前期报道了从中分离得到的14 个三萜皂苷[3]、3 个二苯并-α-吡喃酮[4]、17 个有机酸[5]、4个黄酮苷和1 个δ-truxinate 衍生物[6]以及6 个其他类型化合物[7]。本实验从珍珠菜乙醇提取物中分离得到12 个化合物,分别鉴定为山柰酚(1)、槲皮素(2)、cinchonain Ib(3)、芹菜素-6-C-β-D-吡喃木糖基-8-C-α-L-吡喃阿拉伯糖苷(4)、芹菜素-6,8-二-Cα-L-吡喃阿拉伯糖苷(5)、芹菜素-6-C-α-L-吡喃阿拉伯糖基-8-C-β-D-吡喃木糖苷(6)、芹菜素-6,8-二-Cβ-D-吡喃木糖苷(7)、芹菜素-6-C-β-L-吡喃阿拉伯糖基-8-C-β-D-吡喃葡萄糖苷(8)、芹菜素-6-C-α-L-吡喃阿拉伯糖基-8-C-β-D-吡喃葡萄糖苷(9)、芹菜素-6-C-β-D-吡喃葡萄糖基-8-C-α-L-吡喃阿拉伯糖苷(10)、blumenol A(11)、(3S,5R,6R,7E,9S)-大柱香波龙-7-烯-3,5,6,9-四醇3-O-β-D-吡喃葡萄糖苷(12)。其中包括3 个黄酮苷元(1~3)、7 个黄酮碳苷(4~10)和2 个megastigmane 类化合物(11~12),化合物3~8 和11~12 为首次从该属植物中分离得到。体外活性测试结果显示化合物1~12 均没有明显的细胞毒活性(IC50>10 μM)。
1 仪器与材料
JASCO J-815 型圆二色散光谱仪;INOVA-600、Bruker-500 和Mercury-300 核磁共振仪测定NMR谱;Agilent 1100 系列LC/MSD Trap-SL 型液质联用仪测定ESI-MS;Lumtech 高效液相色谱仪,YMC C-18(250 × 20 mm,5 μm)色谱柱;Gilson 302 型中压色谱仪;反相柱色谱硅胶RP-18(50 μm)为YMC 公司生产;薄层色谱硅胶GF254及柱色谱硅胶(200~300 目)为青岛海洋化工厂生产;葡聚糖凝胶Sephadex LH-20 为GE Pharmacia 公司生产;所用试剂均为分析纯或色谱纯。
珍珠菜于2009 年9 月采于江西庐山,由九江县森林植物研究所谭策铭研究员鉴定,标本(No.21787)保存于中国医学科学院药物研究所标本室。
2 实验方法
2.1 提取与分离
珍珠菜地上部分10.0 kg,用70%乙醇加热回流提取3 次,合并提取液,减压浓缩得浸膏。将浸膏悬浮于水中,依次用石油醚、乙酸乙酯、正丁醇萃取。乙酸乙酯部分(300 g)经硅胶柱色谱分离,以石油醚-丙酮(1∶0~0∶1)、纯甲醇梯度洗脱,得到Frs.A~N 共14 个部分。Fr.H 部分(6.5 g)经Sephadex LH-20 凝胶柱色谱,以二氯甲烷作为流动相洗脱,得到Frs.H-1~6 共6 个流份。Fr.H-1 经硅胶柱色谱和制备型HPLC,以甲醇-水(40∶60)等度洗脱,得到化合物11(15 mg,tR=45.8 min)。Fr.H-6 经Sephadex LH-20 凝胶柱色谱,以二氯甲烷-甲醇(1∶1)作为流动相洗脱得到化合物1(1.5 g)。Fr.K 部分(9.4 g)经Sephadex LH-20 凝胶柱色谱,以二氯甲烷-甲醇(1∶1)作为流动相洗脱,得到化合物2(0.8 g)。Fr.N 部分(10 g)经中压ODS 柱色谱,以甲醇-水(9∶1~0∶1)作为流动相梯度洗脱,得到Frs.1~30 共30 个流份。Fr.N-8 经制备型HPLC,以乙腈-水(18∶82)等度洗脱(7 mL/min),得到化合物3(29 mg,tR=35.5 min)。
正丁醇部分(500 g)经硅胶柱色谱,以二氯甲烷-甲醇-水(10∶1∶0.1~1∶1∶0.1)、100%甲醇作为流动相梯度洗脱,得到Frs.A~H 共8 个部分。Fr.D 部分(66 g)经硅胶柱色谱(二氯甲烷-甲醇-水,3∶1∶0.1~1∶1∶0.25,100% 甲醇)得到Frs.a~g 共7个部分。Fr.D-e 部分(15 g)经中压ODS 柱色谱,以甲醇-水(9∶1~0∶1)作为流动相梯度洗脱,得到Frs.1~30 共30 个流份。Fr.D-e-6 经Sephadex LH-20凝胶柱色谱和制备型HPLC,以甲醇-水(24∶76)等度洗脱,得到化合物12(19 mg,tR=58.4 min)。Fr.D-e-10 经制备型HPLC,以乙腈-水(16∶84)等度洗脱,得到化合物8(5 mg,tR=43.3 min)。Fr.D-e-11经制备型HPLC,以乙腈-水(19∶81)等度洗脱,得到化合物4(15 mg,tR=32.7 min)、5(40 mg,tR=37.3 min)、7(5 mg,tR=40.7 min)和6(30 mg,tR=51.5 min)。Fr.D-f 部分(30 g)经凝胶Sephadex LH-20(甲醇)柱色谱,Frs.1~3 共3 个流份;Fr.D-f-2(17.4 g)经反复中压ODS 柱色谱和制备型HPLC,以甲醇-水(27∶73)等度洗脱,得到化合物9(34 mg,tR=90.5 min)和10(27 mg,tR=108.7 min)。
2.2 细胞毒活性(MTT 法)
收集生长良好的HT-29、HePG2、BGC-823、A549、A375 等五种肿瘤细胞,用含10%小牛血清的RPMI1640 培养基配制成1 ×104cell/mL 细胞悬液,于96 孔培养板内接种,每孔100 μL(含1000 个肿瘤细胞),置37oC,5% CO2温箱内培养24 h 后加药,实验设空白对照,受试样品设3 个浓度(0.1、1、10 μg/mL),每浓度3 个平行孔,置37oC,5% CO2温箱内培养4 d。弃去培养液,每孔加入MTT 溶液(0.4 mg/mL,RPMI 1640 配制)100 μL,37oC 孵育4 h。弃上清液,每孔加入DMSO 150 μL,溶解Fomazan 颗粒,轻度振荡后,用550 型酶标仪在检测波长540 nm,参考波长405 nm 下测定OD 值。结果计算:以药物的不同浓度及对细胞的抑制率作图可得到剂量反应曲线,从中求出半数抑制浓度(IC50)。
3 实验结果
3.1 化合物结构鉴定
化合物1 黄色无定型粉末,ESI-MS m/z 285[M-H]-。1H NMR (DMSO-d6,300 MHz)δ:8.03(2H,d,J=8.7 Hz,H-2',6'),6.91 (2H,d,J=8.7 Hz,H-3',5'),6.43 (1H,d,J=1.8 Hz,H-8),6.18 (1H,d,J=1.8 Hz,H-6)。上述数据与文献[8]一致,故鉴定化合物1 为山柰酚(kaempferol)。
化合物2 黄色无定型粉末,ESI-MS m/z 301[M-H]-。1H NMR (DMSO-d6,300 MHz)δ:7.67(1H,d,J=2.1 Hz,H-2'),7.53 (1H,dd,J=8.4,2.1 Hz,H-6'),6.91 (2H,d,J=8.4 Hz,H-5'),6.39 (1H,d,J=1.8 Hz,H-8),6.18 (1H,d,J=1.8 Hz,H-6)。上述数据与文献[8]一致,故鉴定化合物2 为槲皮素(quercetin)。
化合物3 无色结晶,ESI-MS m/z 453[M +H]+,475[M+Na]+。1H NMR (acetone-d6,500 MHz)δ:7.05 (1H,d,J=1.5 Hz,H-2'),6.82(1H,dd,J=8.0,1.5 Hz,H-6'),6.78 (1H,d,J=8.0 Hz,H-5'),6.64 (1H,d,J=8.0 Hz,H-5″),6.58 (1H,d,J=2.0 Hz,H-2″),6.49 (1H,dd,J=8.0,2.0 Hz,H-6″),6.24 (1H,s,H-6),4.90 (1H,s,H-2),4.56 (1H,dd,J=6.5,1.5 Hz,H-7″),4.29(1H,m,H-3),3.10 (1H,dd,J=15.5,6.5 Hz,H-8″),2.90 (2H,m,H-4),2.86 (1H,dd,J=15.5,1.5 Hz,H-8″);13C NMR (acetone-d6,125 MHz)δ:168.3 (C-9″),156.5 (C-5),153.0 (C-9),151.7(C-7),145.7 (C-3″),145.3 (C-3'),145.1 (C-4'),144.6 (C-4″),135.2 (C-1″),131.8 (C-1'),119.0(C-6″),118.9 (C-6'),116.1 (C-5″),115.6 (C-5'),114.8 (C-2'),114.6 (C-2″),105.7 (C-8),104.7 (C-10),96.0 (C-6),79.3 (C-2),66.0 (C-3),38.1 (C-8″),34.8 (C-7″),29.1 (C-4)。结合其1H NMR,13C NMR 及相关文献[9,10],确定化合物3为cinchonain Ib。NOESY 谱中,H-7″ (δH4.56)与H-2'/ H-6'的空间相关证实了该化合物的相对构型,如图1 所示[11]。在CD 谱(图2)中,在231 nm和283 nm 处有强烈的负Cotton 效应,在256 nm 处有正Cotton 效应,参照文献[10],进一步确定了化合物3 的绝对构型。
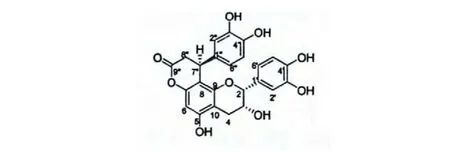
图1 化合物3 的结构Fig.1 Chemical structure of compound 3
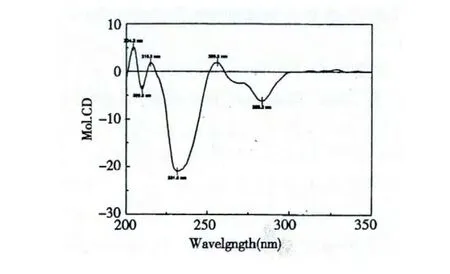
图2 化合物3 的CD 谱图Fig.2 The CD spectrum of compound 3
化合物4 淡黄色粉末,ESI-MS m/z 535[M +H]+。1H NMR (DMSO-d6,600 MHz)δ:8.00 (2H,d,J=8.4 Hz,H-2',6'),6.92 (2H,d,J=8.4 Hz,H-3',5'),6.74 (1H,s,H-3),4.84 (1H,d,J=9.0 Hz,H-1″'),4.59 (1H,d,J=9.6 Hz,H-1″);13C NMR (DMSO-d6,150 MHz)见表1。上述数据与文献[12,13]一致,故鉴定化合物4 为芹菜素-6-C-β-D-吡喃木糖基-8-C-α-L-吡喃阿拉伯糖苷(apigenin-6-C-β-D-xylopyranosyl-8-C-α-L-arabinopyranoside)。
化合物5 淡黄色粉末,ESI-MS m/z 535[M +H]+。1H NMR (DMSO-d6,600 MHz)δ:8.13 (2H,d,J=9.0 Hz,H-2',6'),6.91 (2H,d,J=9.0 Hz,H-3',5'),6.76 (1H,s,H-3),4.71 (1H,m,H-1″'),4.66 (1H,m,H-1″);13C NMR (DMSO-d6,150 MHz)见表1。上述数据与文献[12]一致,故鉴定化合物5为芹菜素-6,8-二-C-α-L-吡喃阿拉伯糖苷(apigenin-6,8-di-C-α-L-arabinopyranoside)。
化合物6 淡黄色粉末,ESI-MS m/z 535[M +H]+。1H NMR (DMSO-d6,500 MHz)δ:7.93 (2H,d,J=8.0 Hz,H-2',6'),6.93 (2H,d,J=8.0 Hz,H-3',5'),6.82 (1H,s,H-3),4.70 (2H,d,J=9.0 Hz,H-1″,1″');13C NMR (DMSO-d6,150 MHz)见表1。上述数据与文献[12]一致,故鉴定化合物6 为芹菜素-6-C-α-L-吡喃阿拉伯糖基-8-C-β-D-吡喃木糖苷(apigenin-6-C-α-L-arabinopyranosyl-8-C-β-D-xylopyranoside)。
化合物7 淡黄色粉末,ESI-MS m/z 533[MH]-。1H NMR (DMSO-d6,600 MHz)δ:7.93 (2H,d,J=9.0 Hz,H-2',6'),6.93 (2H,d,J=9.0 Hz,H-3',5'),6.76 (1H,s,H-3),4.79 (1H,d,J=9.6 Hz,H-1″'),4.64 (1H,d,J=9.6 Hz,H-1″);13C NMR (DMSO-d6,150 MHz)见表1。上述数据与文献[12,14]一致,故鉴定化合物7 为芹菜素-6,8-二-C-β-D-吡喃木糖苷(apigenin-6,8-di-C-β-D-xylopyranoside)。
化合物8 淡黄色粉末,ESI-MS m/z 563[MH]-。1H NMR (DMSO-d6,600 MHz)δ:8.00 (2H,d,J=8.4 Hz,H-2',6'),6.90 (2H,d,J=8.4 Hz,H-3',5'),6.73 (1H,s,H-3),5.29 (1H,br s,H-1″),4.73 (1H,d,J=10.2 Hz,H-1″');13C NMR (DMSO-d6,150 MHz)见表1。上述数据与文献[15,16]一致,故鉴定化合物8 为芹菜素-6-C-β-L-吡喃阿拉伯糖基-8-C-β-D-吡喃葡萄糖苷(apigenin-6-C-β-L-arabinopyranosyl-8-C-β-D-glucopyranoside)。
化合物9 淡黄色粉末,ESI-MS m/z 565[M +H]+。1H NMR (DMSO-d6,600 MHz)δ:8.02 (2H,d,J=8.7 Hz,H-2',6'),6.89 (2H,d,J=8.7 Hz,H-3',5'),6.81 (1H,s,H-3),4.71 (1H,d,J=9.9 Hz,H-1″),4.75 (1H,d,J=10.2 Hz,H-1″');13C NMR (DMSO-d6,150 MHz)见表1。上述数据与文献[12]一致,故鉴定化合物9 为芹菜素-6-C-α-L-吡喃阿拉伯糖基-8-C-β-D-吡喃葡萄糖苷(apigenin-6-Cα-L-arabinopyranosyl-8-C-β-D-glucopyranoside)。
化合物10 淡黄色粉末,ESI-MS m/z 565[M +H]+。1H NMR (DMSO-d6,600 MHz)δ:8.04 (2H,d,J=8.4 Hz,H-2',6'),6.92 (2H,d,J=8.4 Hz,H-3',5'),6.73 (1H,s,H-3),4.78 (1H,m,H-1″'),4.72 (1H,m,H-1″);13C NMR (DMSO-d6,150 MHz)见表1。上述数据与文献[12]一致,故鉴定化合物10为芹菜素-6-C-β-D-吡喃葡萄糖基-8-C-α-L-吡喃阿拉伯 糖 苷 (apigenin-6-C-β-D-glucopyranosyl-8-C-α-Larabinopyranoside)。

表1 化合物4-10a 的13C NMR 数据Table 1 13C NMR data of compounds 4-10a
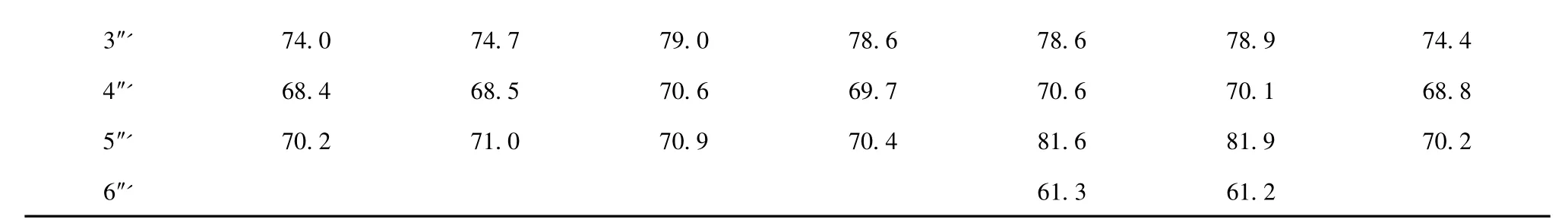
a13C NMR data (δ)were measured in DMSO-d6at 125 MHz for 6 and at 150 MHz for 4-5,7-10.
化合物11 白色结晶(CDCl3),ESI-MS m/z 449[2M+H]+。1H NMR (CDCl3,300 MHz)δ:5.90(1H,br s,H-4),5.82 (1H,dd,J=15.9,5.4 Hz,H-8),5.77 (1H,d,J=15.9 Hz,H-7),4.41 (1H,m,H-9),2.44 (1H,d,J=17.1 Hz,H-2a),2.23 (1H,d,J=17.1 Hz,H-2b),1.89 (3H,s,Me-13),1.29(3H,d,J=6.3 Hz,Me-10),1.07 (3H,s,Me-11),1.00 (3H,s,Me-12);13C NMR (CDCl3,75 MHz)δ:41.2 (C-1),49.6 (C-2),198.4 (C-3),126.8 (C-4),163.3 (C-5),79.0 (C-6),135.6 (C-7),129.0(C-8),68.1 (C-9),23.7 (C-10),24.0 (C-11),22.9 (C-12),19.0 (C-13)。上述数据与文献[17]一致,故鉴定化合物11 为blumenol A,为一megastigmane 类型的降倍半萜。
化合物12 白色无定形粉末,ESI-MS m/z 429[M+Na]+。1H NMR (CD3OD,500 MHz)δ:0.79(3H,s,H3-12),1.09 (3H,s,H3-11),1.14 (3H,s,H3-13),1.21 (3H,d,J=6.5 Hz,H3-10),1.52(1H,dd,J=12.4,1.9 Hz,H-2b),1.69 (1H,t,J=12.0 Hz,H-2a),1.71 (1H,dd,J=12.5,11.7 Hz,H-4b),1.89 (1H,dd,J=12.9,1.9 Hz,H-4a),3.09 (1H,t,J=8.1 Hz,H-2'),3.62 (1H,dd,J=11.9,5.0 Hz,H-6'b),3.80 (1H,dd,J=11.9,2.0 Hz,H-6'a),4.14 (1H,m,H-3),4.28 (1H,quint d,J=6.0,1.0 Hz,H-9),4.35 (1H,d,J=7.8 Hz,H-1'),5.73 (1H,dd,J=15.9,6.3 Hz,H-8),5.99(1H,d,J=15.9 Hz,H-7);13C NMR (CD3OD,125 MHz)δ:40.7 (C-1),44.5 (C-2),73.2 (C-3),42.4(C-4),77.7 (C-5),79.1 (C-6),131.0 (C-7),136.2 (C-8),69.5 (C-9),24.2 (C-10),27.5 (C-11),26.2 (C-12),27.2 (C-13),102.2 (C-1'),75.1(C-2'),78.1 (C-3'),71.6 (C-4'),77.8 (C-5'),62.7 (C-6')。上述数据与文献[18,19]一致,故鉴定化合物12 为(3S,5R,6R,7E,9S)-大柱香波龙-7-烯-3,5,6,9-四醇3-O-β-D-吡喃葡萄糖苷{(3S,5R,6R,7E,9S)-megastigman-7-ene-3,5,6,9-tetrol 3-O-β-Dglucopyranoside}。
3.2 化合物1~12 的细胞毒活性
采用MTT 法,测定了化合物1~12 的细胞毒活性。测试结果显示化合物1~12 均没有明显的细胞毒活性(IC50>10 μM)。
1 Jiangsu New Medical College(江苏新医学院).Dictionary of Traditional Chinese Medicine(中药大辞典).Shanghai:Shanghai People’s Press,1993.1498.
2 Ren FX (任凤霞),Zhang AJ (张爱军),Zhao YM (赵毅民).Research progress on the chemical constituents and pharmacological effects of Lysimachia.Nat Prod Res Dev (天然产物研究与开发),2008,20:131-137.
3 Liang D,Hao ZY,Zhang GJ,et al.Cytotoxic triterpenoid saponins from Lysimachia clethroides.J Nat Prod,2011,74:2128-2136.
4 Liang D,Luo H,Liu YF,et al.Lysilactones A-C,three 6Hdibenzo[b,d]pyran-6-one glycosides from Lysimachia clethroides,total synthesis of lysilactone A.Tetrahedron,2013,69:2093-2097.
5 Liang D,Hao ZY,Liu YF,et al.Bioactive carboxylic acids from Lysimachia clethroides.J Asian Nat Prod Res,2013,15:59-66.
6 Liang D,Liu YF,Hao ZY,et al.Acylated flavonol glycosides and δ-truxinate derivative from the aerial parts of Lysimachia clethroides.Phytochem Lett,2015,11:116-119.
7 Liang D,Liu YF,Hao ZY,et al.Chemical constituents from the aerial parts of Lysimachia clethroides.Chin J Chem,2012,30:1269-1272.
8 Yi Y (易衍),Wu X (巫鑫),Wang Y (王英),et al.Studies on the flavonoids from the flowers of Hylocereus undatus.J Chin Med Mater (中药材),2011,34:712-716.
9 Nonaka G,Nishioka I.Tannins and related compounds.Ⅶ.phenylpropanoid-substituted epicatechins,cinchonains from Cinchona succirubra.Chem Pharm Bull,1982,30:4268-4276.
10 Chen HF,Tanaka T,Nonaka,GI,et al.Phenylpropanoid-substituted catechins from Castanopsis hystrix and structure revision of cinchonains.Phytochemistry,1993,33:183-187.
11 Wungsintaweekul B,Umehara K,Miyase T,et al.Estrogenic and anti-estrogenic compounds from the Thai medicinal plant,Smilax corbularia (Smilacaceae).Phytochemistry,2011,72:495-502.
12 Xie C,Veitch NC,Houghton PJ,et al.Flavone C-glycosides from Viola yedoensis MAKINO.Chem Pharm Bull,2003,51:1204-1207.
13 Rayyan S,Fossen T,Andersen M.Flavone C-glycosides from seeds of fenugreek,Trigonella foenum-graecum L.J Agric Food Chem,2010,58:7211-7217.
14 Shie JJ,Chen CA,Lin CC,et al.Regioselective synthesis of di-C-glycosyl flavones possessing anti-inflammation activities.Org Biomol Chem,2010,8:4451-4462.
15 Du QZ (杜琪珍),Zhao YC (赵永春),Li B (李博).Struc-tural identification and antioxidant activity of flavonoids from flowers of Mucuna sempervirens.Food Sci (食品科学),2011,32:111-115.
16 Dou H,Zhou Y,Chen CX,et al.Chemical constituents of the aerial parts of Schnabelia tetradonta.J Nat Prod,2002,65:1777-1781.
17 Gonzalez AG,Guillermo JA,Ravelo AG,et al.4,5-Dihydroblumenol A,a new nor-isopenoid from Perrottetia multiflora.J Nat Prod,1994,57:400-402.
18 Cai XY (柴兴云),Bai CC (白长财),Song YL (宋月林),et al.Chemical constituents from the leaves of Itoa orientalis.Chin J Nat Med (中国天然药物),2008,6:179-182.
19 Otsuka H,Hirata E,Shinzato T,et al.Stereochemistry of megastigmane glucosides from Glochidion zeylanicum and Alangium premnifolium.Phytochemistry,2003,62:763-768.
