银杏叶聚戊烯醇急性和遗传性毒理学研究
2015-01-11王成章叶建中原姣姣李文君张红玉
王成章,叶建中,原姣姣,李文君,张红玉
1 中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,南京 210042;2 中国林业科学研究院林业新技术研究所,北京 100091
银杏(Ginkgo biloaba L.,G.biloaba L.),又名白果,俗称公孙树,是世界上最古老的孑遗植物之一,原产于中国,于1710 年左右引入欧洲,素有“活化石”、“植物界的熊猫”之称。银杏叶是银杏重要的药用部位,含有黄酮、萜内酯、多糖、聚戊烯醇、挥发油及甾醇等生物活性成分,是传统的中药材[1]。传统中医认为,银杏叶具有益心敛肺、化湿止泻等功效。现代医学表明银杏黄酮对于冠状血管具有扩张作用,能促进血管收缩,降低血清胆固醇,升高血清磷脂,改善磷脂与血清胆固醇比例[2]。银杏内酯具有明显的脑保护作用,有效改善脑组织神经细胞缺血。目前国际市场上开发的银杏叶提取物及制剂在临床上广泛用于心脑血管疾病的预防与防治[3]。银杏叶多糖与某些常用化疗药物具有明显协同抗癌效应,对于抑制肿瘤细胞生长效果明显。银杏叶聚戊烯醇(polyprenols,GBP)是继银杏黄酮和内酯后发现的一类重要天然活性成分,它是由14~24 个异戊烯基单元组成的长链状类脂同系物,与哺乳动物和人体中S-多萜醇(Dolichols,DH)结构十分相似,即ω-(trans)2-(cis)n-cis(α)结构(见图1)[4]。多萜醇中cis(α)异戊醇有一个手性碳原子,是S 构型天然类脂化合物,具有光学活性,而银杏叶聚戊烯醇中cis(α)为不饱和异戊醇[5,6]。

图1 多萜醇与银杏叶聚戊醇的化学结构(n=12~18)Fig.1 Chemical structures of dolichols and polyprenols of G.biloba(n=12-18)
多萜醇含有不饱合双键,具有抗氧化、清除脂质自由基作用,在人体内的生理作用非常广泛。多萜醇及其磷酸盐具有促进人体造血功能的作用,参与调节细胞膜稳定性和通透性。多萜醇磷酸盐作为糖基关键载体在糖蛋白的生物合成过程中起着非常重要的作用,体内多萜醇及其磷酸盐不足将引起脂质代谢、糖类代谢和蛋白质代谢的紊乱,对细胞免疫功能及细胞分裂和再生产生影响,并导致细胞病变[7-9]。多萜醇能治疗再生障碍性贫血、糖尿病、高尿酸、痛风、红斑狼疮等免疫性低下引起的疾病,尤其能抑制B16-F10 黑色素肿瘤转移和辅助化疗P388 白血病肿瘤[10,11]。研究表明,外源性植物聚戊烯醇(plant polyprenols)摄入体内可通过α-异戊二烯还原酶(α-isoprene reductase)的作用代谢成聚戊烯醇磷酸盐(polyprenyl phosphate,Poly-PP)和多萜醇焦磷酸(Dol-PP),再通过多萜醇焦磷酸磷酸酯酶(Dol-PP phosphatase)代谢成多萜醇磷酸盐(Dol-P),最后经多萜醇磷酸酯酶(Dol-P phosphatase)转化为多萜醇,形成多萜醇磷酸酯的生物循环,进行生物的新陈代谢[9]。王成章研究了银杏叶聚戊烯醇化学结构和含量变化规律[4,12]、抗肿瘤、促进肿瘤细胞凋亡、辅助化放疗、保护肝损伤、抗病毒,免疫调节以及抑菌等生物活性[13-19],但尚未见银杏叶聚戊烯醇毒理学评价的相关报道,因而限制了银杏叶聚戊烯醇的功能食品和药品的开发。本研究以银杏叶聚戊烯醇为原料,根据新药非临床安全性评价原则,采用急性口服灌胃试验、Ames 试验、骨髓细胞微核试验和小鼠精子畸形试验,对银杏叶聚戊烯醇急性和遗传性毒理进行评价,为银杏叶聚戊烯醇的应用提供依据。
1 材料与方法
1.1 受试样品和化学试剂
银杏叶聚戊烯醇(GBP),聚戊烯醇≥75%,橙黄色透明油状物,实验室自制。二甲基亚砜(DMSO)和双蒸水均为分析试剂,阳性对照物敌克松(Dexon)、2-氨基芴(2-AF)、1,8-二羟基蒽醌、环磷酰胺和丝裂霉素C(MMC)购于SIGMA 公司。生化试剂盒由中生北控生物科技有限公司。
1.2 方法
1.2.1 动物和菌株
健康ICR 小鼠,雌雄各半,体重18~22 g,上海斯莱克实验动物有限责任公司提供,二级,合格证号:SCXK(沪)2003-0003 号。实验动物环境设施合格证号:SCXK(沪)2002-0004 号。灭菌鼠饲料和无菌水自由食用。菌株TA97、TA98、TA100 和TA102经鉴定基因型符合要求,各菌株过夜培养液细菌浓度均在109个/mL 或以上。
细胞及培养条件CHL 细胞,由江苏省疾病控制中心遗传毒理室提供。完全培养液为含10%小牛血清的DMEM,置37℃、5% CO2培养箱孵育。
1.2.2 急性毒性试验
银杏叶聚戊烯醇(GBP)设计5 个剂量组5 g/kg b·wt.、7.5 g/kg b·wt.、10 g/kg b·wt.、15 g/kg b·wt.、和21.5 g/kg b·wt.,分别称取GBP 样品加色拉油至20 mL 配制成受试物。每组小鼠10 只,雌雄各半。GBP 给药小鼠禁食过夜后分2 次灌胃给予,中间间隔4 h,每次灌胃容量均为20 mL/kg b·wt.,末次灌胃后4 h 给食,自由摄食。空白对照组雌雄各半,给予等体积生理盐水。给药后正常饲养,连续观察记录14 d 内小鼠体重、进食、活动、精神等反应情况。选择GBP 最大给药量的雌雄组,14 d 后测定小鼠血液指标,剖解观察主要脏器(心、肝、脾、肾)的变化。取心、肝、脾、肾,用生理盐水冲洗,滤纸吸干后称重,计算各脏器指数(各脏器重量与体重之比)。
1.2.3 Ames 试验[19]
S9 混合液中S9 浓度为10%,其中S9 是由Aroclor1254 诱导的大鼠肝匀浆。按照试验要求[20],对试验拟用的鼠伤寒沙门氏组氨酸缺陷型菌株进行了组氨酸需求试验、结晶紫敏感试验、抗氨苄青霉素试验、抗四环素试验、紫外线敏感试验和自发回变试验[21],结果显示:各菌株的特性正常,自发回复突变菌落数均在正常范围内,菌株基因型均符合试验要求。
称取GBP 样品500 mg,用二甲基亚砜(DMSO)定容至10 mL,37 ℃提取过夜,离心取上清液,并以此连续用DMSO 作5 倍稀释,共设GBP5 个剂量组(8,40,200,1000,5000 μg/皿)、2 个溶剂对照组(0.1 mL/皿DMSO 和0.1 mL/皿双蒸水)。另设3 个阳性对照组,阳性对照物敌克松(Dexon,50 μg/皿)、2-氨基芴(2-AF,10 μg/皿)和1,8-二羟基蒽醌(50 μg/皿)分别用双蒸水和DMSO 溶解。采用平板掺入法,共测试两次,每次每个剂量设平行样3 个。
1.2.4 微核试验
分别称取GBP 2.5、5、10 g 样品加色拉油到20 mL 配制成受试物,阳性对照取环磷酰胺40 mg 加生理盐水到20 mL 使成为2 mg/mL 的溶液。小鼠按体重随机分入2.5、5、10 g/kg b·wt 各3 个剂量组、1 个溶剂对照组(色拉油)和1 个阳性对照组(环磷酰胺20 mL/kg),每组10 只,雌雄各半。各组均用30 h 两次灌胃法,每次灌胃容量均为20 mL/kg,第2次灌胃后6 h 杀鼠,取股骨骨髓悬于牛血清中直接涂片、固定、染色,镜检嗜多染红细胞1000 个/鼠,计数具有微核的细胞,观察嗜多染红细胞和正染红细胞比率(PCE/NCE)。
1.2.5 畸形试验
分别称取GBP 2.5、5、10 g 样品加色拉油到20 mL 配制成受试物,阳性对照取丝裂霉素C(MMC)2 mg/支加生理盐水10 mL 使成为0.2 mg/mL 的溶液。小鼠按体重随机分入3 个样品剂量组,1 个溶剂对照组(色拉油)和1 个阳性对照,每组5 只雄性小鼠。样品各剂量组和溶剂对照组动物连续灌胃5天,每次灌胃容量均为20 mL/kg,每天一次。阳性对照物丝裂霉素C(MMC)以10 mL/kg 的量一次腹腔注射。各组动物均于处死前6 h 腹腔注射秋水仙素4 mg/kg,实验第12 d 杀鼠取睾丸,拉开精曲细管,低渗,固定,软化,制片,染色,镜检。
1.2.6 统计方法
采用SPSS 16.0 软件进行统计处理计量资料,多组问比较采用单因素方差分析法(One-way ANOVA)和两两比较采用Dunnett 法和LSD 法;计数资料采用卡方检验,P<0.05 差异有统计学意义。
2 结果与分析
2.1 GBP 对小鼠急性经口毒性影响
银杏叶聚戊烯醇(GBP)设计剂量5 g/kg b·wt、7.5 g/kg b·wt、10 g/kg b·wt、15 g/kg b·wt 和21.5 g/kg b·wt,聚戊烯醇溶液用20 mL 色拉油制备。当用量在10 g/kg 以上时,使用未稀释的聚戊烯醇。按照最大给药体积对小鼠灌胃两次后,喂养14 d 未发现动物行为和外表的明显变化,未见死亡。用量达21.5 g/kg 时,动物在灌胃1~2 h 内少动,并在24 h 内胃肠道暂时紊乱。因此用灌胃法不能测定其半数到死量,因为其数量将大于小鼠的最大容许灌胃量,再增加灌胃量将导致小鼠胃肠系统的损伤,小鼠最大给药量21.5 g/kg。GBP 试验组与空白对照组小鼠体重均呈增长趋势,但无显著性差异(P>0.05)(表1)。一般体征观察2 次给药后,除给药当天小鼠少动且进食、饮水稍有减少外,在14 d 的观察期内试验组小鼠活动正常、反应灵敏、进食饮水、尿便等均正常,未出现毒性反应,与空白对照组无明显差异。根据小鼠急性经口毒性分级标准,GBP 属无毒级。
表1 银杏叶聚戊烯醇(GBP)对小鼠体重和急性毒性的影响(±s,n=5)Table 1 Effect of GBP on body weight and acute toxicity of mouse(±s,n=5)

表1 银杏叶聚戊烯醇(GBP)对小鼠体重和急性毒性的影响(±s,n=5)Table 1 Effect of GBP on body weight and acute toxicity of mouse(±s,n=5)
选择GBP 最大给药量雌雄组,14 d 后剖检心、肝、脾、肾重要脏器,GBP 给药组与空白对照组小鼠各脏器均未见肿大、出血、坏死等异常变化。脏器系数结果表明,GBP 给药雌雄组心体比、肝体比、脾体比、肾体比与空白对照组无显著性差异(P>0.05)(表2);从血液指标分析表3 可看出,GBP 试验雌雄组组血液红细胞(RBC)、白细胞(WBC)、血红蛋白(HGB)、碱性磷酸酶(ALT)、天门冬氨酸氨基移换酶(AST)与对照组无显著性差异(P>0.05),均在正常范围内,表明GBP 在最大给药量(21.5 g/kg)不影响小鼠的生化指标和脏器系数,因此,GBP 未见毒性。
表2 GBP 给药对小鼠的脏器系数的影响/%(±s,n=5)Table 2 Effect of GBP on organ/body weight ratio of mouse/%(±s,n=5)

表2 GBP 给药对小鼠的脏器系数的影响/%(±s,n=5)Table 2 Effect of GBP on organ/body weight ratio of mouse/%(±s,n=5)
表3 GPB 给药对小鼠血液生理生化指标的影响(±s,n=5)Table 3 Effect of GBP on blood physiological and biochemical indexes of mouse(±s,n=5)

表3 GPB 给药对小鼠血液生理生化指标的影响(±s,n=5)Table 3 Effect of GBP on blood physiological and biochemical indexes of mouse(±s,n=5)
2.2 Ames 试验结果
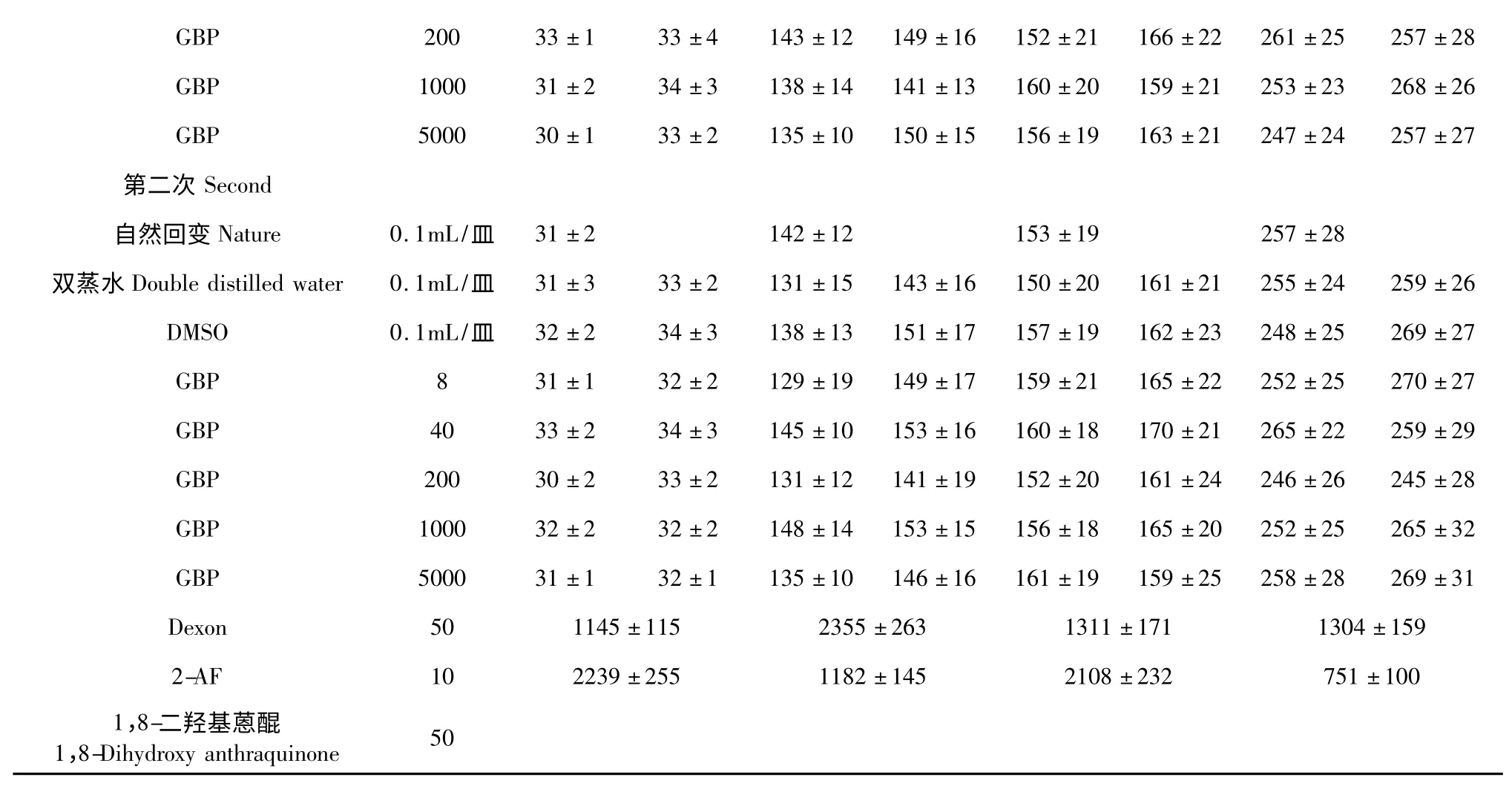
计算同一菌株同一剂量组的3 个平行培养皿上的平均菌落数和标准差,两次试验结果统计如表4。阳性对照组各菌株回变菌落平均数均超过其相应阴性对照组回变菌落平均数的2 倍以上,证实鼠伤寒沙门氏菌的组氨酸营养缺陷型突变菌株对受试物的检测有效。随着GBP 受试物剂量的增加,突变菌落数变化很少,GBP 各剂量组的回变菌落数均未超过阴性对照(自发回变)菌落数的2 倍,且无剂量反应关系,说明在加与不加S9 的条件下,TA97、TA98、TA100、TA102 的自发回变菌落数均在正常范围内,GBP 受试物对标准测试菌TA97、TA98、TA100 和TA102 均未检出明显的诱变活性。
表4 GBP 的Ames 试验S9 菌株的回变结果(±s,n=3)Table 4 Effect of GBP on S9 bacterial strain in the Ames test(±s,n=3)
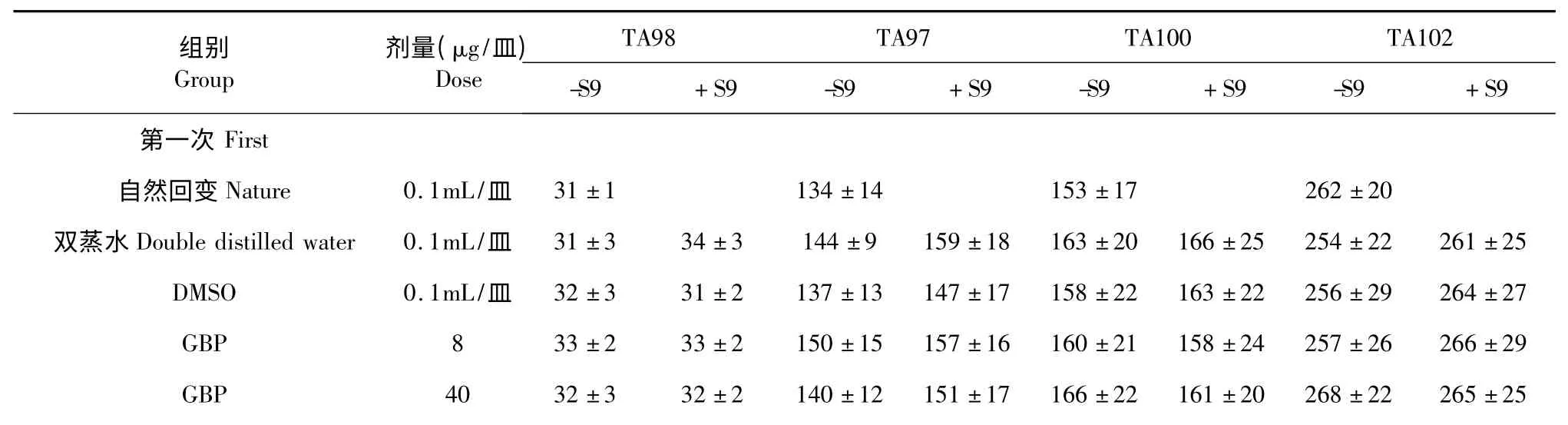
表4 GBP 的Ames 试验S9 菌株的回变结果(±s,n=3)Table 4 Effect of GBP on S9 bacterial strain in the Ames test(±s,n=3)
2.3 微核试验结果
环磷酰胺阳性对照组的微核率与溶剂对照组相比,有极显著差异(P<0.01),证明试验系统可靠。GBP 各剂量组小鼠微核率与阳性对照组有极显著性差异(P<0.01),GBP 各剂量组间无显著性差异(P>0.05)。GBP 各给药剂量组嗜多染红细胞/正染红细胞的比值与阴性对照组比较,差异无统计学意义(P>0.05),并且PCE/NCE 比率均大于0.1,表明GBP 微核试验结果呈阴性,对骨髓红细胞系统的增殖无明显受抑,对嗜多染红细胞微核的观察无明显影响,如表5。
表5 GBP 对小鼠骨髓嗜多染红细胞微核试验结果(±s,n=5)Table 5 Effect of GPB on bone marrow polychromatie erythrocyte micronucleus of mouse(±s,n=5)

表5 GBP 对小鼠骨髓嗜多染红细胞微核试验结果(±s,n=5)Table 5 Effect of GPB on bone marrow polychromatie erythrocyte micronucleus of mouse(±s,n=5)
注:与溶剂对照值相比,**P<0.01。Note:Compare with control,**P<0.01.
2.4 染色体畸变试验结果
染色体畸变试验结果表明:溶剂对照组染色体畸变率为0,MMC 阳性对照中直接诱变剂丝裂霉素组细胞染色体畸变率增高8.4%,阳性对照值与溶剂对照值之间有极显著差异(P<0.01),表明本试验系统可靠。GBP 剂量组随给药量增加,各剂量组间小鼠具染色体畸变的初级精母细胞率与溶剂对照值之间均无统计学差异(P>0.05),也无剂量反应关系,如表6。因此,在GBP 受试剂量下,未检出GBP 对雄性小鼠睾丸初级精母细胞染色体的诱变活性。
表6 GBP 对小鼠睾丸初级精母细胞染色体畸变试验结果(±s,n=5)Table 6 Effect of GBP on primary spermatocyte chromosome aberration of mouse(±s,n=5)

表6 GBP 对小鼠睾丸初级精母细胞染色体畸变试验结果(±s,n=5)Table 6 Effect of GBP on primary spermatocyte chromosome aberration of mouse(±s,n=5)
注:a:断片、易位、微小体等;与溶剂对照值相比,**P<0.01。Note:a:Fragment,translocation,microbody;Compare with control,**P<0.01.
3 讨论
国际上对于针叶聚戊烯醇生物活性和安全性研究已有大量报道。俄罗斯和拉脱维亚按照前苏联卫生部药物委员会“新药用物质临床前毒理试验要求”对针叶聚戊烯醇进行毒理安全评价,实验结果表明,聚戊烯醇对人体安全无毒,无致突变、致畸及致癌作用,已批准针叶聚戊烯醇作为食品和化妆品原料已使用20 年。俄罗斯利用针叶聚戊烯醇开发了“ROPREN”制剂,在免疫功能、护肝、多发性硬化症、抗肝炎病毒和艾滋病毒以及辅助化疗白血病等方面具有明显的药效;并开发喷雾剂用于预防和治疗流感。在新药临床应用方面,2008 年澳大利亚Solagran 公司以针叶聚戊烯醇为原料,开发第一个聚戊烯醇新药BIOACTIVER,应用于肝疾病治疗,在临床上可治疗早期Alzheimer(老年痴呆)症和其它脑疾病。因此针叶聚戊烯醇不仅安全,而且在人体内能够改善细胞膜的流动性、稳定性和渗透性,增强膜的融合,对于生物膜的结构和功能具有明显的调节作用。我们通过对比研究针叶聚戊烯醇和银杏叶聚戊烯醇化学结构及含量[22,23],结果表明银杏叶聚戊烯醇和针叶聚戊烯醇结构相似,均为桦木醇结构,并且异戊烯基单元数接近,尤其是聚戊烯醇在银杏叶中的含量最高,约为1.0%~2.0%,是人体脏器中多萜醇含量的100 倍,因此,银杏叶聚戊烯醇是多萜醇的理想原料。
目前国际上对银杏叶及其提取物中银杏黄酮、萜内酯、银杏酸、多糖等活性组分的化学、药理、临床及其制剂开发进行了深入系统的研究,而银杏叶聚戊烯醇类脂是银杏叶中新的有效成分,具有明显的生物活性。本研究通过Ames 试验、体外小鼠睾丸初级精母细胞染色体畸变试验和小鼠骨髓嗜多染红细胞微核试验,结果表明银杏叶聚戊烯醇属无毒级,对小鼠体、脏器系数和血液生理生化指标没有影响,对小鼠睾丸初级精母细胞染色体无诱变活性,对小鼠骨髓嗜多染红细胞的无致微核作用,在加与不加S9 的条件下,TA97、TA98、TA100、TA102 的自发回变菌落数均在正常范围内,银杏叶聚戊烯醇对标准测试菌TA97、TA98、TA100 和TA102 均未检出明显的诱变活性。因此,银杏叶聚戊烯醇无毒、无致癌、无致畸和无突变作用,GBP 在最大给药量(21.5 g/kg)不影响小鼠的生化指标和脏器系数及肝体比、肾体比、心体比、脾体比,因此,GBP 未见毒性,为GBP 保健食品和新药的开发提供安全理论依据。
1 Chen XJ(陈西娟),Wang CZ(王成章),Ye JZ(叶建中).Research progress of chemical constituents of Ginkgo biloba Linn.leaves and their application.Biomass Chem Eng(生物质化学工程),2008,42(4):57-62.
2 Gong M(龚敏),Zhang WP(张卫萍),Bai Y(白延).The influence of Ginkgo biloba on blood lipids in patients with coronary heart disease(CHD),platelet activating factor and C-reactive protein.Shaanxi J Tradit Chin Med(陕西中医),2005,26:636-637.
3 Li YC(李育臣),Dong YJ(董玉娟),Wang JR(王建茹),et al.The influence of Ginkgo biloba extract on brain-derived neurotrophic factor after cerebral ischemia in rats.J Apoplexy Nervous Dis(中风与神经疾病杂志),2005,22:54-56.
4 Wang CZ(王成章),Shen ZB(沈兆邦),Chen X(陈祥).Polyprenols from Ginkgo biloba Leaves.Chem Ind Forest Prod(林产化学与工业),1992,12:279-286.
5 Wang CZ(王成章),Shen ZB(沈兆邦).Chemical synthesis and drug development of dolichol.World Clin Drugs(世界临床药物),2001,22:350-352.
6 Chojnacki T,Swiezewska E,Vogtman T.Polyprenols from plants-structural analogues of mammalian dolichols.Chemica Scripta,1987,27:209-214.
7 Wu XH,Rush JS,Karaoglu D,et al.Deficiency of UDP-Glc-NAc:dolichol phosphate N-acetylglucosamine-1 phosphate transferase(DPAGT1)causes a novel congenital disorder of glycosylation type Ij.Human Mutation,2003,22:144-150.
8 Chojnacki T.Dallner G.The biological role of dolichol.Biochemistry J,1988,251:1-9.
9 Rip JW,Rupar CA,Ravi K,et al.Distribution,metabolism and function of dolichol and polyprenols.Prog Lipid Res,1985,24:269-309.
10 Kuznecovs S,“ROPREN”,Fons Ltd.,Riga,Latvia,1991.
11 Kuznetsovs S.Effects of polyprenols on p-388 leukemia cell sensitivity and chemotherapy resistance in vitro.18thInternational Congress of Chemotherapy,Stockholm,1993,170.
12 Wang CZ(王成章),Shen ZB(沈兆邦),Yu Q(郁青),et al.The content and seasonal variation of polyprenols from Ginkgo biloba Leaves.J Plant Res Envir(植物资源与环境学报),2000,9(2):57-58.
13 Wang CZ(王成章),Shen ZB(沈兆邦),Gao L(高凌).The biological activities of polyprenols from Ginkgo Biloba L.on antitumor.Nat Prod Res Dev(天然产物研究与开发),2002,14(5):18-20.
14 Wang CZ(王成章),Shen ZB(沈兆邦),Liu YC(刘妤婵),et al.Study of Ginkgo biloba L.polyprenols on immunological function and inducing apoptosis of tumors in mouse.Chem Ind Forestry Prod(林产化学与工业),2005,25(3):9-12.
15 Wang CZ(王成章),Shen ZB(沈兆邦).The effects on transplanted Heps and EC tumors in mouse for polyprenols in combination with chemotherapeutic drug.Chin J Biochem Pharm(中国生化药物杂志),2003,24:113-115.
16 Wang CZ(王成章),Shen ZB(沈兆邦),Liu YC(刘妤婵),et al.The effect of60COradiotherapy in combination with polyprenol from Ginkgo biloba L.in mice transplanted Heps.Pharm Biotechnol(药物生物技术),2004,11:329-331.
17 Wang CZ(王成章),Shen ZB(沈兆邦),Cao ZQ(曹志庆).Pharmacological research on polyprenols and phosphate ester derivates.China J Tradit Chin Med Pharm(中华医药杂志),2005,5(5):23-27.
18 Tao R(陶冉),Wang CZ(王成章),Kong ZW(孔振武).Antimicrobial synergy between polyprenols and other lipids isolated from Ginkgo Folium.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2013,19:203-210.
19 Du WX(杜文欣).Practical Manual of Modern Health Food Research and Development,Production of New Technology and Registration Declaration(现代保健食品研发与和生产新技术新工艺及注册申报实用手册).Beijing:Chinese Science Culture Press,2005.1514-1524.
20 Wang YQ(王亚其),Li HX(李宏霞),Xiao K(肖凯),et al.Comparison of activation of two kinds of liver homogenate S9 in two genetoxic test.Mod Prevent Med(现代预防医学),2006,33:457-463.
21 Pan JH(潘军华),Zhang XY(张星元).The colorimetric method for quick-estimation of L-Histidine in the fermentation broth.J Wuxi Univ Light Ind(无锡轻工大学学报),2002,21:254-258.
22 Wang CZ(王成章),Shen ZB(沈兆邦),Tan WH(谭卫红),et al.The content analysis and application of polyprenols from Ginkgo biloba leaves.J Chem Ind Forest Prod(林产化工通讯),2001,35(5):12-15.
23 Wang CZ(王成章),Shen ZB(沈兆邦),Chen X(陈祥).Structure of polyprenols from five conifer needles.Chem Ind Forestry Prod(林产化学与工业),1994,14(3):1-8.
