芒果苷对慢性支气管炎大鼠CD4+T淋巴细胞的影响
2015-05-17卫智权邓家刚
卫智权,阎 莉*,邓家刚*,邓 静
1广西中药药效研究重点实验室广西中医药大学,南宁530001;2哈佛大学医学院Dana-Farber癌症研究所,马萨诸塞州02115
芒果叶为漆树科植物芒果Mangifera indica L.的叶,芒果苷(mangiferin)是芒果叶中的主要活性成分,是一种天然多酚类化合物,分子式C19H18O11,分子量422,化学结构见图1。
芒果叶在广西民间用于治疗咳嗽、咳痰已有多年历史,成药芒果苷片对于支气管炎的咳嗽、咳痰、喘息、发热等症状具有显著疗效且安全性良好[1]。芒果苷对多种急慢性炎症具有较好抗炎作用,其作用机制与其明显抑制单核-巨噬细胞的活化密切相关[2,3]。CD4+T 淋巴细胞对于慢性支气管炎的病理进程具有重要影响,活化的CD4+T淋巴细胞产生IL-2、IL-4等淋巴因子并进而活化B细胞、NK细胞、单核-巨噬细胞等重要的炎症细胞,是参与支气管及其周围组织慢性炎症的主要的炎症细胞之一。迄今尚无芒果苷影响慢性支气管炎中的CD4+T淋巴细胞的研究报道。香烟烟熏能够建立类似于人慢性支气管炎的动物模型,本研究拟以香烟烟熏诱导慢性支气管炎大鼠为研究对象,观察芒果苷对慢性支气管炎大鼠CD4+T淋巴细胞的影响。

图1 芒果苷的化学结构Fig.1 Chemical structure ofmangiferin
1 材料与仪器
1.1 实验动物
SPF级健康雄性Sprague-Dawley(SD)大鼠,6周龄,体重160~180 g,购自湖南斯莱克景达实验动物有限公司[实验动物生产许可证号SCXK(湘)2011-0003]。
1.2 药品及试剂
芒果苷由广西中医药大学中药药效研究重点实验室惠赠,经高效液相色谱法检测纯度为97.5%,色谱图见图2。香烟(广西卷烟总厂,焦油含量12 mg/支)。IL-2与IL-4 ELISA Kit(武汉华美公司)。Anti-rat CD3-PE抗体、Anti-rat CD4-APC抗体(美国Life technologies公司),10×RBC Lysis Buffer(Multi-species)红细胞裂解液(美国eBioscience公司),RNeasy Plus Mini Kit(德国 Qiagen公司),RNAstore样本保存液、RNAsafe RNase抑制剂、Quant cDNA第一链合成试剂盒、Real Master Mix(Probe)预混试剂盒[天根生化科技(北京)有限公司]。PCR引物、TaqMan荧光探针、质粒DNA标准品由美国Invitrogen公司设计、合成。

图2 芒果苷标准品(A)与样品(B)的高效液相色谱图Fig.2 HPLC chromatograms of mangiferin standard(A)and mangiferin sample(B)
1.3 仪器设备
美国Thermo Fisher Scientific公司Multiskan Speetrum1500酶标仪,德国Qiagen公司QIAcube核酸纯化仪,美国ABI公司7500型实时荧光PCR仪,德国Eppendorf公司5430R高速冷冻离心机,美国Becton Dickinson公司LSR Fortessa多色分析流式细胞仪与FACSAria高速流式细胞分选仪。
2 实验方法
2.1 动物分组、给药与标本采集
大鼠40只随机均分为4组:正常(Control)组、模型(Model)组及芒果苷高、低剂量(MFH、MFL)组。除正常组外,在0.25立方米玻璃仓内每次用10支香烟烟熏各组大鼠,每天2次,上下午各1 h,连续6周。烟熏6周后开始灌胃给药,正常组、模型组给生理盐水,根据参考文献报道的药物剂量设置其余各组大鼠给药剂量[4]:芒果苷高、低剂量组分别为芒果苷200、100 mg/(kg·d),给药时间4周,每天给药后照常烟熏。
实验第10周末,各组大鼠腹腔注射2% 戊巴比妥钠(40 mg/kg)麻醉,下腔静脉穿刺取血,用于分选CD4+T淋巴细胞及CD4+T淋巴细胞比例检测;取左肺组织用于HE染色观察支气管炎症病理形态变化。
2.2 外周血CD4+淋巴细胞比例检测
取EDTA-K2抗凝全血 100μL,加入 Anti-rat CD3-PE抗体、Anti-rat CD4-APC抗体各5μL,混匀,置4℃避光反应30 min。加入红细胞裂解液溶解红细胞,反应10 min后,1000 rpm离心5 min,弃上清,加PBS洗涤2次去除细胞碎片和未结合的抗体。缓慢加入1%多聚甲醛固定液0.5 mL,4℃ 避光固定30 min,过400目细胞筛,立即上机检测。
2.3 CD4+T淋巴细胞分选
取适量EDTA-K2抗凝全血,加入Anti-rat CD3-PE抗体、Anti-rat CD4-APC抗体,混匀,置4℃ 避光反应30 min,加入红细胞裂解液溶解红细胞,反应10 min后,1000 rpm离心5 min弃上清,加PBS洗涤2次去除细胞碎片和未结合的抗体,少量PBS重悬,立即上机进行细胞分选,以CD3-PE+并CD4-APC+设门圈选CD4+T淋巴细胞。分选所得细胞悬液调整细胞浓度至5×106/mL,置于-70℃保存备用。
2.4 ELISA检测CD4+T淋巴细胞IL-2、IL-4蛋白表达水平
取CD4+T淋巴细胞悬液标准样品2 mL,4℃离心(10000 rpm,1 min),吸去上清,加入4℃预冷的细胞裂解匀浆缓冲液(pH 6.8的1.0 mmol/L Tris-HCl 20 mL,10%SDS 120 mL,β-巯基乙醇 4 mL,双蒸水56 mL,混匀即得),超声冰浴匀浆破碎细胞,然后4℃离心(12000 rpm,15 min),取上清液作为待测样品。采用IL-2、IL-4的ELISA Kit,严格按照试剂盒说明书操作,以Curve Expert1.3曲线拟合软件计算标准曲线的回归方程,计算样品中IL-2、IL-4的含量。
2.5 Real-time RT-PCR检测CD4+T淋巴细胞IL-2、IL-4基因表达水平
取CD4+T淋巴细胞悬液标准样品2 mL,以RNeasy PlusMini Kit总RNA提取试剂盒与QIAcube核酸纯化仪提取总RNA。在RNA溶液中加入1/20体积的 RNAsafe,60℃处理20 min以使污染的RAase失活,冷却至室温后置于-70℃ 保存。提取的总RNA以Quant cDNA第一链合成试剂盒逆转录获得cDNA,于-70℃保存供下游PCR用。
目的基因IL-2与IL-4引物序列、TaqMan荧光探针序列见表1。每个PCR反应体系内容如下:2.5×Real Master Mix 20 μL,20 ×Probe Enhancer solution 2.5 μL,上、下游引物各 2 μL,cDNA 或质粒DNA标准品4μL,TaqMan荧光探针2μL,ddH2O加至50μL。PCR反应条件:95℃预变性2 min,95℃变性20 s,60 ℃退火30 s,68 ℃延伸1 min,40个循环。
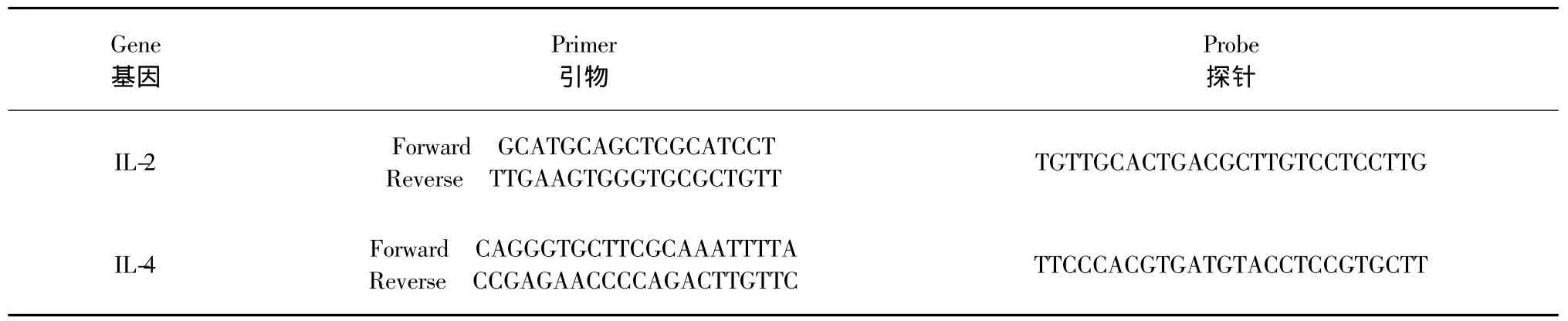
表1 引物序列和探针序列Table 1 Primer and probe sequence used in real-time RT-PCR
2.6 HE染色细支气管炎症病理形态观察
各组大鼠左肺组织标本行常规石蜡包埋、切片、脱水,HE染色,光镜下观察细支气管炎症病理改变。
2.7 统计学处理
所有计量资料均以均数±标准差(¯x±s)表示,以SPSS 13.0统计软件进行多个样本间均数比较。方差齐性数据采用单因素方差分析LSD检验,方差不齐数据采用 Kruskal Wallis秩和检验。以P<0.05为差异具有统计学意义。
3 实验结果
3.1 芒果苷对外周血CD4+T淋巴细胞比例的影响
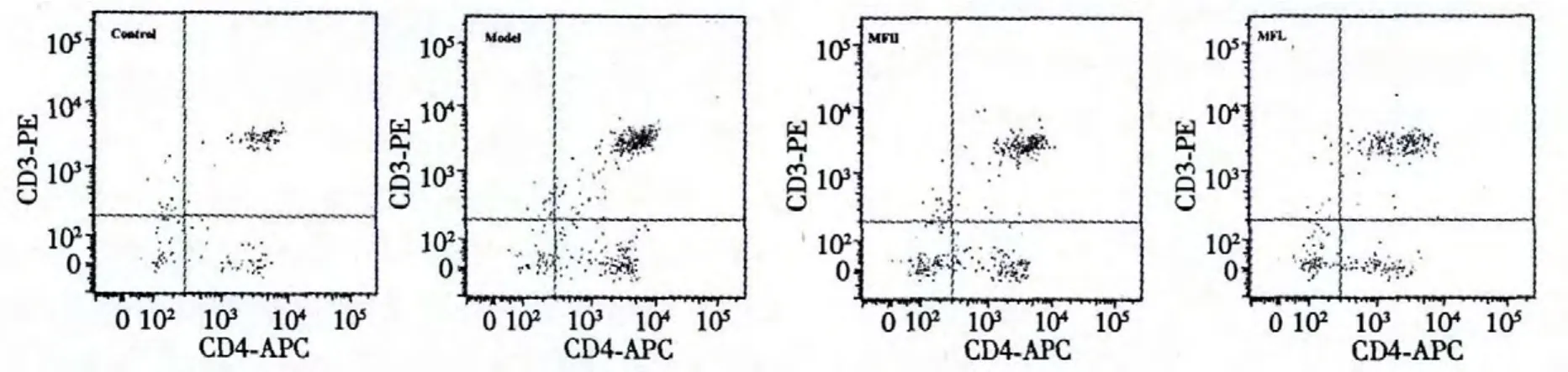
图3 各组大鼠CD4+T淋巴细胞分析流式散点图Fig.3 CD4+T lymphocyte analysis flow cytometry scatter plot of rats in each group
与正常组比较,模型组大鼠外周血CD4+T淋巴细胞比例明显升高(P<0.01)。与模型组比较,200 mg/(kg·d)、100 mg/(kg·d)芒果苷均可抑制烟熏引起的CD4+T淋巴细胞比例升高(P<0.01,P<0.05)。结果见图3、图4。
3.2 芒果苷对CD4+T淋巴细胞IL-2、IL-4基因与蛋白表达水平的影响
与正常组比较,模型组大鼠CD4+T淋巴细胞IL-2、IL-4基因表达水平及蛋白表达水平显著上调(P <0.01)。与模型组比较,200 mg/(kg·d)、100 mg/(kg·d)芒果苷可抑制烟熏引起的CD4+T淋巴细胞IL-2、IL-4的基因与蛋白表达水平上调(P<0.01,P <0.05)。结果见图5。
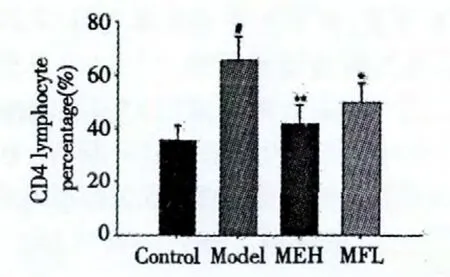
图4 各组大鼠CD4+T淋巴细胞比例Fig.4 CD4+T lymphocyte percentage of rats in each group
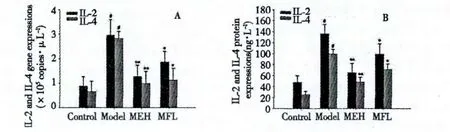
图5 各组大鼠CD4+T淋巴细胞IL-2、IL-4基因和蛋白表达水平Fig.5 IL-2 and IL-4 expressions of CD4+T lymphocyte of rats in each group
3.3 HE染色支气管炎症病理形态观察
正常组细支气管的管壁结构完整,无明显淋巴细胞浸润。模型组细支气管壁可见多量淋巴细胞浸润甚至淋巴滤泡形成,管壁结构有局灶性肿胀、增厚、断裂。200 mg/(kg·d)芒果苷组细支气管结构大致完整,少量淋巴细胞浸润。100 mg/(kg·d)芒果苷组细支气管结构也存在局灶性肿胀、增厚、断裂,中度淋巴细胞浸润。结果见图6。
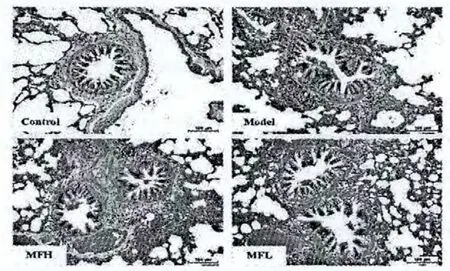
图6 HE染色支气管炎症病理组织镜检(×400)Fig.6 Rat histologic section of chronic bronchitis in each group(HE staining,×400)
4 讨论
目前制备慢性支气管炎模型的方法有二氧化硫吸入法、香烟烟薰法、脂多糖气管内注入法等,其中二氧化硫吸入法、脂多糖气管内注入法存在较多并发症,与人类慢性支气管炎在病因学、病理学与病理生理学方面均存在较大差距,且无法直接反映吸烟与慢性支气管炎的关系,故近年已较少用于制备慢性支气管炎动物模型,因而本实验采用了已被广泛应用的香烟烟薰法制备慢性支气管炎动物模型。对照组大鼠在接受10周的香烟烟熏之后,其肺组织的HE染色病理观察表现出了较为明显的慢性支气管炎的特征性变化:多量淋巴细胞浸润甚至淋巴滤泡形成,管壁结构有局灶性肿胀、增厚、断裂。因而可以认为香烟烟熏制备慢性支气管炎大鼠模型是成功的。
世界卫生组织和世界银行的资料显示,因慢性支气管炎导致的慢性阻塞性肺病的死亡率居所有死因的第4位,且有逐年增加的趋势[5]。慢性支气管炎的基本病理基础是气道炎症,涉及IL-2、IL-4等多种炎症细胞因子,其介导的细支气管炎症在慢性支气管炎的发病中发挥了重要的作用。IL-2、IL-4是主要由活化的CD4+T淋巴细胞产生的促炎细胞因子,可活化更多的CD4+T淋巴细胞,促进B细胞增殖、分化,增强NK细胞杀伤活性,激活单核-巨噬细胞[6]。此外,IL-2、IL-4可协同IL-3刺激肥大细胞增殖,诱导IgG、IgE大量产生,从而介导气道高反应性的病理过程,与喘息性慢性支气管炎密切相关[7]。因此,CD4+T淋巴细胞产生IL-2、IL-4的多寡往往与慢性支气管炎的CD4+T淋巴细胞活化程度呈同向性变化,成为考察慢性支气管炎的T淋巴细胞活化程度的有效指标。本研究中的模型组组大鼠在接受长达10周的香烟烟熏之后,其CD4+T淋巴细胞的IL-2、IL-4基因与蛋白表达水平均持续于较高水平,表明其CD4+T淋巴细胞活化也较为剧烈。
CD4+T淋巴细胞是人体免疫系统的重要组成部分,不仅在慢性支气管炎的急性发作期,在慢性迁延期浸润支气管粘膜与粘膜下组织的CD4+T淋巴细胞数量也是增加的[8]。慢性迁延期的患者肺内仍存在一定程度的炎症活动,外周血CD4+T淋巴细胞增加,机体仍然持续处于不同程度的炎症损伤之下[9,10]。这些T淋巴细胞亚群的病理性变化也是慢性支气管炎能够持续存在并反复发作的重要原因之一。本研究中的模型组大鼠的CD4+T淋巴细胞比例明显升高,显然与其支气管炎症持续活跃密切相关,其HE染色细支气管炎症病理形态观察可见多量淋巴细胞浸润的结果也支持此推论。
在本研究中,接受芒果苷干预的大鼠其HE染色组织病理形态观察均可见到较为明显的细支气管炎症减轻,其抗炎效果呈明显的剂量依赖性,较高的芒果苷剂量可带来更好的抗炎效果。同时观察到的芒果苷干预抑制CD4+T淋巴细胞活化,包括CD4+T淋巴细胞比例以及CD4+T淋巴细胞IL-2、IL-4基因与蛋白表达水平显著下调,也呈现不同程度的剂量依赖性。上述结果提示,芒果苷能够以剂量依赖性的方式抑制CD4+T淋巴细胞活化,显著减轻香烟烟熏诱导的大鼠慢性支气管炎的炎症细胞浸润、支气管及其周围组织的损伤,具有较为良好的抗炎及组织保护作用,这些新的实验证据显著增加了芒果苷在慢性支气管炎治疗新药研发领域的潜在价值。
1 Deng JG(邓家刚),Zheng ZW(郑作文),Hao EW(郝二伟),et al.pharmacodynamics study ofmangiferin tabelet on acute bronchitis.Chin Tradit Pat Med(中成药),2010,32:300-303.
2 Wei ZQ(卫智权),Deng JG(邓家刚),Yan L(阎莉),et al.Effectofmangiferin on the expression ofmyeloid differentiation factor 88 of peripheral blood mononuclear cell in rats with chronic inflammation.Chin Pharm Bull(中国药理学通报),2013,29:482-486.
3 Wei ZQ(卫智权),Yan L(阎莉),Deng JG(邓家刚),etal.Mangiferin protects rats against chronic bronchitis via regulating NF-κB(P65)and IκBα expression in mononuclear cells.Acta Pharm Sin(药学学报),2014,49:596-601.
4 Wei ZQ(卫智权),Yan L(阎莉),Deng JG(邓家刚),etal.Effects ofmangiferin on MAPK signaling pathway in chronic inflammation.Chin J Chin Mater Med(中国中药杂志),2011,36:1798-1802.
5 Kurmi OP,Semple S,Simkhada P,et al.COPD and chronic bronchitis risk of indoor air pollution from solid fuel:a systematic review and meta-analysis.Thorax,2009,65:221-228.
6 Mier-Cabrera J,Gonzalez-Gallardo S,Hernandez-Guerrero C.Effectof nitric oxide and TH1/TH2 cytokine supplementation over ectopic endometrial tissue growth in amurine model of endometriosis.Reprod Sci,2013,20:1332-1338.
7 Nafe LA,DeClue AE,Lee-Fowler TM,et al.Evaluation of biomarkers in bronchoalveolar lavage fluid for discrimination between asthma and chronic bronchitis in cats.Am JVetRes,2010,71:583-591.
8 Hukkinen M,Korhonen T,Broms U,et al.Long-term smoking behavior patterns predicting self-reported chronic bronchitis.COPD,2009,6:242-249.
9 Hodge G,Hodge S,Chambers D,et al.Bronchiolitis obliterans syndrome is associated with absence of suppression of peripheral blood Th1 proinflammatory cytokines.Transplantation,2009,88:211-218.
10 Hodge G,Hodge S,Li-Liew C,et al.Lymphocytic bronchiolitis is associated with inadequate suppression of blood T-cell granzyme B,IFN-gamma,and TNF-alpha.Transplantation,2010,89:1283-1289.
